Etacrynsäure
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Etacrynsäure | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C13H12Cl2O4 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | C03CC01 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 303,14 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand | fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert | 3,50[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Etacrynsäure (auch: Ethacrynsäure) ist ein Schleifendiuretikum.
Chemisch-strukturell gesehen ist sie ein Abkömmling des 2,3-Dichlorphenols, welches in 4-Position des Aromaten mit 2-Methylenbuttersäure acyliert und am Sauerstoff durch Essigsäure substituiert ist.
Sie unterscheidet sich durch luminale und kapillarseitige Wirkung von anderen Schleifendiuretika. Als Nebenwirkungen wurden irreversible Hörschäden beschrieben. Untersuchungen weisen darauf hin, dass Etacrynsäure nicht direkt wirkt, sondern erst der Phase-II-Metabolit, das Cystein-Konjugat, die Wirkung ausübt. Man vermutet, dass das Konjugat einen ähnlichen Wirkungsmechanismus wie die Schleifendiuretika vom Furosemid-Typ hat.[4]
Geschichte
Etacrynsäure wurde erstmals 1962 von E.M. Schultz in der Literatur beschrieben.[5] Die Substanzklasse um Etacrynsäure wurde im Jahre 1961 von der Firma Merck & Co. zum Patent eingereicht.[6]
Darstellung
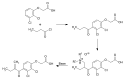
Der Syntheseweg geht von 2,3-Dichlorphenoxyessigsäure aus, welche in einer Friedel-Crafts-Acylierung mit Butyrylchlorid in Schwefelkohlenstoff (CS2) mit Aktivierung des Säurechlorids durch Aluminiumchlorid (AlCl3) zur 2,3-Dichlor-4-butyrylphenoxyessigsäure umgesetzt wird. Diese wird in einer Mannich-Reaktion (mit Paraformaldehyd, trockenem Dimethylammoniumchlorid und katalytischen Mengen an Essigsäure) in α-Position zur Ketogruppe aminomethyliert und nachfolgend unter Abspaltung des Amins durch Behandlung mit einer Base (wässrigem Natriumhydrogencarbonat) zum α,β-ungesättigten Keton Etacrynsäure olefiniert.[7]
Handelsname
Hydromedin
Einzelnachweise
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-232.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Dissociation Constants of Organic Acids and Bases, S. 8-50.
- ↑ a b c d Datenblatt Ethacrynic acid bei Sigma-Aldrich, abgerufen am 18. Oktober 2016 (PDF).
- ↑ Palfrey, H. C. and Leung, S. Am. J. Physiol. 1993, 264, C1270–C1277.
- ↑ Everett M. Schultz, Edward J. Cragoe, John B. Bicking, William A. Bolhofer, James M. Sprague: α,β-Unsaturated Ketone Derivatives of Aryloxyacetic Acids, a New Class of Diuretics. In: Journal of Medicinal and Pharmaceutical Chemistry. Band 5, Nr. 3, Mai 1962, S. 660, doi:10.1021/jm01238a030.
- ↑ Patent US3255241: (2-Alkylidene acyl)phenoxy- and (2-Alkylidene acyl)phenylmercaptocarboxylic acids. Angemeldet am 19. Januar 1961, veröffentlicht am 7. Juni 1966, Anmelder: Merck & Co. Inc., Erfinder: Everett M. Schultz, James M. Sprague.
- ↑ Ulrich Käppler: Synthese und Testung nichtpeptidischer Cystein-Protease-Inhibitoren – Etacrynsäure als Leitstruktur. Dissertation, Würzburg, 2004. DNB 976079887/34.
Auf dieser Seite verwendete Medien
Struktur von Ethacrynsäure
Synthesis of Etacrynic acid