Elektronischer Übergang
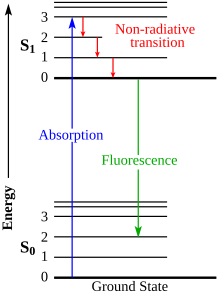
Ein elektronischer Übergang, auch Quantensprung, ist die Änderung des Energieniveaus eines Elektrons in einem Atom, Molekül oder (kristallinem) Festkörper. Solche Übergänge werden elektronisch genannt, da ein Elektron (in Halbleitern kann auch ein Defektelektron gemeint sein) sein Energieniveau wechselt.
Wird bei diesem Übergang ein Photon abgestrahlt (Abregung) oder absorbiert (Anregung), so bezeichnet man den Übergang auch als optischen oder strahlenden Übergang. Wird ein Photon absorbiert, so geht das System in einen angeregten Zustand über. Die Abregungsübergänge können in spontane Emission und induzierte Emission unterteilt werden.
Neben den strahlenden Übergängen gibt es auch nicht-strahlende Übergänge, wie den Auger-Effekt oder Stoßionisationen. Andere quantenmechanische Übergänge sind z. B. vibronische Übergänge, bei denen ein Molekül bei der Wechselwirkung mit einem Photon seine Schwingungsfrequenz ändert sowie Phonon-Photon-Wechselwirkung in Halbleitern.
Wahrscheinlichkeit
In der quantenmechanischen Beschreibung hat ein Atom, Molekül oder kristalliner Festkörper mögliche diskrete Zustände mit unterschiedlicher Energie (Energieniveaus). Der Zustand niedrigster Energie ist der Grundzustand.
Diese Zustände sind im thermodynamischen Gleichgewicht mit Elektronen besetzt:
- in Atomen oder Molekülen gemäß der Boltzmannverteilung
- in Festkörpern, z. B. Halbleitern, gemäß der Fermiverteilung.
Allgemein gilt: Zustände geringerer Energie sind mit höherer Wahrscheinlichkeit besetzt als Zustände höherer Energie. Diese Besetzungswahrscheinlichkeiten beeinflussen die Übergangswahrscheinlichkeiten der Übergänge.
In erster Näherung werden die Übergangswahrscheinlichkeiten durch Fermis Goldene Regel beschrieben. Für das einfachste Modell eines Systems mit Energieniveaus, dem Zweiniveausystem, geben die Einsteinkoeffizienten die Übergangswahrscheinlichkeiten an.
Ein Elektron kann nicht von jedem Energieniveau in jedes andere übergehen, denn aufgrund des Pauli-Prinzips dürfen sich zwei Elektronen nicht im gleichen Zustand befinden. Außerdem können Symmetrien zu Auswahlregeln für die möglichen Übergänge bzw. zu verbotenen Übergängen führen. So ist z. B. in rotationssymmetrischen Systemen der Gesamtdrehimpuls eine Erhaltungsgröße, so dass sich in einem Übergang die Summe der Drehimpulse eines Atoms (zusammengesetzt aus dem Bahndrehimpuls, dem Spin der Elektronen und dem Kernspin) und des elektromagnetischen Feldes nicht ändert. Dies schränkt z. B. bei Übergängen unter Emission nur eines Photons die erlaubten Übergänge stark ein.
Beobachtung
Experimentell werden elektronische Übergänge beispielsweise in der Fluoreszenz- oder Ramanspektroskopie beobachtet. Das abgestrahlte Licht einer angeregten Probe wird spektroskopiert. Die Energiedifferenz des Elektrons vor und nach einem strahlenden Übergang wird durch ein Photon abtransportiert, welches zu einer Resonanzlinie im Fluoreszenzspektrum beiträgt. Die Resonanzlinien bzw. die unterliegenden elektronischen Übergänge werden mittels Termschemata bzw. Grotrian-Diagrammen klassifiziert und dargestellt.
Die elektronischen Übergänge des Wasserstoffatoms und der wasserstoffähnlichen Ionen sind am besten verstanden, da dies die einzigen Teilchen sind, deren Energieniveaus ohne Näherung quantenmechanisch berechnet werden können.
Geschichte
1802 entdeckte der Chemiker William Hyde Wollaston dunkle Linien im Spektrum des Sonnenlichts, welche 1814 von Joseph von Fraunhofer wiederentdeckt wurden und Fraunhoferlinien genannt werden.[1] Gustav Robert Kirchhoff und Robert Wilhelm Bunsen stellten 1861 fest, dass jedes chemische Element charakteristische Linien emittiert, und erklärten die Fraunhoferlinien als Absorptionslinien der Elemente in den oberen Schichten der Sonne.[2] 1885 konnte Johann Jakob Balmer erstmals einen Teil der Spektrallinien beim Wasserstoff, welche als Balmer-Serie bezeichnet werden, mit einer empirischen Formel erfassen. Diese Formel wurde dann 1888 von Johannes Rydberg zur Rydberg-Formel verallgemeinert. Elektronische Übergänge können auch über Elektronenstöße induziert werden, so dass 1913 James Franck und Gustav Hertz mit ihrem Franck-Hertz-Versuch erklärten, dass Atome diskrete Energieniveaus besitzen.[3]
Niels Bohr konnte 1913 das bohrsche Atommodell entwerfen, was erstmals diskrete Energieniveaus des Elektrons zuließ und einige Beobachtungen am Wasserstoff erklärte. Arnold Sommerfeld erweiterte das bohrsche Modell 1915/16 und konnte so die Feinstrukturaufspaltung erklären. In derselben Zeit entwickelte Albert Einstein das einsteinsche Ratenbild, welches erstmals die Berechnung von Übergangswahrscheinlichkeiten in einem Zweiniveausystem ermöglichte.[4] Lise Meitner entdeckte 1922[5] strahlungslose elektronische Übergänge im Zusammenhang mit Röntgenstrahlungsexperimenten, welche Pierre Auger 1926 auch unabhängig entdeckte und die heute als Auger-Effekt bezeichnet werden. In den heutigen Halbleiterbauelementen wie Photodioden und Laserdioden spielt die gezielte Auswahl bestimmter optischer Übergänge eine große Rolle, hauptsächlich werden dazu Resonatoren verwendet.
Siehe auch
- Photophysik
- Huang-Rhys-Faktor
Literatur
- Wolfgang Demtröder: Atoms, Molecules and Photons: An Introduction to Atomic-, Molecular- and Quantum Physics. Springer, 2010 (eingeschränkte Vorschau in der Google-Buchsuche).
Einzelnachweise
- ↑ Joseph Fraunhofer: Bestimmung des Brechungs- und des Farbenzerstreungs-Vermögens verschiedener Glasarten, in Bezug auf die Vervollkommnung achromatischer Fernröhre. In: Annalen der Physik. Band 56, Nr. 7, 1817, S. 264–313, doi:10.1002/andp.18170560706.
- ↑ G. Kirchhoff, R. Bunsen: Chemische Analyse durch Spectralbeobachtungen. In: Annalen der Physik und Chemie. Band 189, Nr. 7, 1861, S. 337–381, doi:10.1002/andp.18611890702.
- ↑ Hermann Haken, Hans Christoph Wolf: Atom- und Quantenphysik: Einführung in die experimentellen und theoretischen Grundlagen. 8., aktualisierte u. erw. Auflage. Springer, 2004, ISBN 3-540-02621-5, S. 116.
- ↑ Albert Einstein: Zur Quantentheorie der Strahlung. In: Physikalische Zeitschrift. Band 18, 1917, S. 121–128 (Zuerst abgedruckt in den Mitteilungen der Physikalischen Gesellschaft Zürich).
- ↑ Lise Meitner: Über die β-Strahl-Spektra und ihren Zusammenhang mit der γ-Strahlung. In: Zeitschrift für Physik A Hadrons and Nuclei. Nr. 11, 1922, ISSN 0939-7922, S. 35–54, doi:10.1007/BF01328399.
Auf dieser Seite verwendete Medien
Autor/Urheber: Д.Ильин: vectorization, Lizenz: CC0
Jablonski diagram of absorbance, non-radiative decay, and fluorescence.
Electronic transitions are about 1 eV. Vibrational transitions are about 0.1 eV. Rotational transitions (not shown) are about 0.001 eV. Absorption is about 1 femtosecond, relaxation takes about 1 picosecond, fluorescence takes about 1 nanosecond.
Secchi's four classes of stellar spectra, from a colored lithograph in a book published around 1870. This shows how someone looking through a spectrograph on a large telescope would see the spectrum from the brightest stars. The spectra would be much fainter for most stars, making for difficult observing. The principal spectral lines are identified underneath by letters that Fraunhofer assigned.
Yes there is a typo in figure two, it should say 2nd not 2rd.

