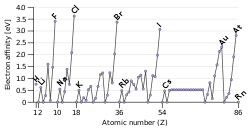Elektronenaffinität


Als Elektronenaffinität (Abkürzung EA auch EEA oder oder χ) bezeichnet man diejenige Energie, die erforderlich ist, um ein Elektron aus einem einfach negativ geladenen Anion zu entfernen und ein neutrales Molekül oder Atom zu bilden. Aus der Sicht des Anions, das ein Elektron abgibt, kann man auch sagen: Die Elektronenaffinität entspricht der Ionisierungsenergie des zugehörigen einfach geladenen Anions.[1]
Die Elektronenaffinität ist also die Energiedifferenz zwischen dem Grundzustand eines einzelnen neutralen Atoms oder Moleküls und dem Grundzustand des zugehörigen negativ geladenen Ions, d. h., es handelt sich um den Energiebetrag, der bei der Aufnahme eines Elektrons durch das neutrale Atom/Molekül freigesetzt bzw. benötigt wird.[2] Für Festkörper ist es die Energiedifferenz zwischen der Vakuumenergie und der unteren Leitungsbandkante wie im Bild dargestellt.[3]
Die Elektronenaffinität ist somit ein Maß dafür, wie stark ein Neutralatom oder -molekül ein zusätzliches Elektron binden kann. Der umgekehrte Vorgang – die Abtrennung eines Elektrons aus einem neutralen Atom oder Molekül – wird als Ionisierung bezeichnet und durch die Ionisierungsenergie charakterisiert. Die Elektronenaffinität gehört zu den sich periodisch ändernden Eigenschaften der Elemente innerhalb des Periodensystems der Elemente.
Elektronenaffinitäten der Elemente
Die Elektronenaffinität ergibt sich für ein Atom durch:
Gelegentlich wird auch eine Definition mit umgekehrtem Vorzeichen verwendet. Werte für die Elektronenaffinität werden meist in der Maßeinheit Elektronenvolt (eV) oder kJ/mol angegeben.
Obwohl die Elektronenaffinitäten im Periodensystem zum Teil stark variieren, sind einige periodisch vorkommende Muster deutlich erkennbar. So besitzen Nichtmetalle in der Regel eine größere Elektronenaffinität als Metalle. Wird durch die Anlagerung eines Elektrons ein voll- oder halbbesetztes Energieniveau erreicht, so zeigen die Elektronenaffinitäten in diesen Gruppen (z. B. 14 und 17) Maxima, weil dadurch besonders stabile Elektronenkonfigurationen erreicht werden. Mit 3,61 eV besitzt Chlor die höchste Elektronenaffinität der Elemente.
Bei Elementen, welche vollbesetzte s-, p- oder d-Valenz-Schalen aufweisen, ist naturgemäß das Bestreben zur weiteren Aufnahme von Elektronen sehr gering. Hier muss Energie aufgewendet werden, um diesen Atomen weitere Elektronen hinzuzufügen. Daher haben die Erdalkalimetalle, die Metalle der Zinkgruppe und die Edelgase negative Elektronenaffinitäten.
Um die Tendenzen der Werte zu interpretieren, hilft auch die Kenntnis des folgenden Sachverhaltes: Da ein Elektron vom positiven Atomkern angezogen wird, finden sich in einer Periode, nach abnehmendem Atomradius von links nach rechts, immer größere Werte für die Elektronenaffinität, da die Orbitale, und somit der Abstand der äußersten Elektronenhülle zum Kern, immer kleiner werden.[4]
| Z | Symbol | Element | (eV) | Quelle |
|---|---|---|---|---|
| 1 | 1H | Wasserstoff | 0,754 195(19) | K. R. Lykke, K. K. Murray, W. C. Lineberger, Phys. Rev. A 43, 6104 (1991) |
| 2D | Deuterium | 0,754 59(8) | ||
| 3 | Li | Lithium | 0,618 049(22) | G. Haeffler, D. Hanstorp, I. Kiyan, A. E. Klinkmüller, U. Ljungblad, D. J. Pegg, Phys. Rev. A 53, 4127 (1996) |
| 5 | B | Bor | 0,279 723(25) | M. Scheer, R. C. Bilodeau, H. K. Haugen, Phys. Rev. Lett. 80, 2562 (1998) |
| 6 | 12C | Kohlenstoff | 1,262 122 6(11) | D. Bresteau, C. Drag, C. Blondel, Phys. Rev. A 93, 013414 (2016) |
| 13C | 1,262 113 6(12) | |||
| 8 | 16O | Sauerstoff | 1,461 113 6(9) | W. Chaibi, R. J. Peláez, C. Blondel, C. Drag, C. Delsart, Eur. Phys. J. D 58, 29 (2010) |
| 17O | 1,461 108(4) | C. Blondel, C. Delsart, C. Valli, S. Yiou, M. R. Godefroid, S. Van Eck, Phys. Rev. A 64, 052504 (2001) | ||
| 18O | 1,461 105(3) | |||
| 9 | F | Fluor | 3,401 189 8(24) | C. Blondel, C. Delsart, F. Goldfarb, J. Phys. B: At. Mol. Opt. Phys. 34, L281 and 2757 (2001) |
| 11 | Na | Natrium | 0,547 926(25) | H. Hotop, W. C. Lineberger, J. Phys. Chem. Ref. Data 14, 731 (1985) |
| 13 | Al | Aluminium | 0,432 83(5) | M. Scheer, R. C. Bilodeau, J. Thøgersen, H. K. Haugen, Phys. Rev. A 57, 1493 (1995) |
| 14 | Si | Silicium | 1,389 521 2(8) | W. Chaibi, R. J. Peláez, C. Blondel, C. Drag, C. Delsart, Eur. Phys. J. D 58, 29 (2010) |
| 15 | P | Phosphor | 0,746 607(10) | Peláez R.J., Blondel C., Vandevraye M., Drag C. & Delsart C., J. Phys. B: At. Mol. Opt. Phys. 44, 195009 (2011) |
| 16 | 32S | Schwefel | 2,077 104 2(6) | Chaibi W., Peláez R.J., Blondel C., Drag C. & Delsart C., Eur. Phys. J. D 58, 29 (2010) |
| 34S | 2,077 104 5(12) | Carette T., Drag C., Scharf O., Blondel C., Delsart C., Froese Fischer C. & Godefroid M., Phys. Rev. A 81, 042522 (2010) | ||
| 17 | Cl | Chlor | 3,612 725(28) | Berzinsh U., Gustafsson M., Hanstorp D., Klinkmüller A., Ljungblad U. & Martensson-Pendrill A.M., Phys. Rev. A 51, 231 (1995) |
| 19 | K | Kalium | 0,501 459(13) | Andersson K.T., Sandström J., Kiyan I.Y., Hanstorp D. & Pegg D.J., Phys. Rev. A 62, 22503 (2000) |
| 20 | Ca | Calcium | 0,024 55(10) | Petrunin V.V., Andersen H.H., Balling P. & Andersen T., Phys. Rev. Lett. 76, 744 (1996) |
| 21 | Sc | Scandium | 0,188(20) | Feigerle C.S., Herman Z. & Lineberger W.C., J. Electron Spectrosc. Rel. Phenom. 23, 441 (1981) |
| 22 | Ti | Titan | 0,075 54(5) | Tang R., Fu X. & Ning C., J. Chem. Phys. 149, 134304 (2018) |
| 23 | V | Vanadium | 0,527 66(20) | Fu X., Luo Z., Chen X., Li J. & Ning C., J. Chem. Phys. 145, 164307 (2016) |
| 24 | Cr | Chrom | 0,675 84(12) | Bilodeau R.C., Scheer M. & Haugen H.K., J. Phys. B: At. Mol. Opt. Phys. 31, 3885 (1998) |
| 26 | Fe | Eisen | 0,153 236(34) | Chen X., Luo Z., Li J. & Ning C., Sci. Rep. 6, 24996 (2016) |
| 27 | Co | Cobalt | 0,662 26(5) | Chen X. & Ning C., Phys. Rev. A 93, 052508 (2016) |
| 28 | Ni | Nickel | 1,157 16(12) | Scheer M., Brodie C.A., Bilodeau R.C. & Haugen H.K., Phys. Rev. A 58, 2051 (1998) |
| 29 | Cu | Kupfer | 1,235 78(4) | Bilodeau R.C., Scheer M. & Haugen H.K., J. Phys. B: At. Mol. Opt. Phys. 31, 3885 (1998) |
| 31 | Ga | Gallium | 0,301 20(11) | Gibson N.D., Walter C.W., Crocker C., Wang J., Nakayama W., Yukich J.N., Eliav E. & Kaldor U., Phys. Rev. A 100, 052512 (2019) |
| 32 | Ge | Germanium | 1,232 676 4(13) | Bresteau D., Babilotte Ph., Drag C. & Blondel C., J. Phys. B: At. Mol. Opt. Phys. 48, 125001 (2015) |
| 33 | As | Arsen | 0,8048(2) | Walter C.W., Gibson N.D., Field R.L., Snedden A.P., Shapiro J.Z., Janczak C.M. & Hanstorp D., Phys. Rev. A 80, 014501 (2009) |
| 34 | Se | Selen | 2,020 604 7(12) | Vandevraye M., Drag C. & Blondel C., Phys. Rev. A 85, 015401 (2012) |
| 35 | Br | Brom | 3,363 588(3) | Blondel C., Cacciani P., Delsart C. & Trainham R., Phys. Rev. A 40, 3698 (1989) |
| 37 | Rb | Rubidium | 0,485 916(21) | Frey P., Breyer F. & Hotop H., J. Phys. B: At. Mol. Phys. 11, L589 (1978) |
| 38 | Sr | Strontium | 0,052 06(6) | Andersen H.H., Petrunin V.V., Kristensen P. & Andersen T., Phys. Rev. A 55, 3247 (1997) |
| 39 | Y | Yttrium | 0,307(12) | Feigerle C.S., Herman Z. & Lineberger W.C., J. Electron Spectrosc. Rel. Phenom. 23, 441 (1981) |
| 40 | Zr | Zirconium | 0,433 28(9) | Fu X., Li J., Luo Z., Chen X. & Ning C., J. Chem. Phys. 147, 064306 (2017) |
| 41 | Nb | Niob | 0,917 40(6) | Luo Z., Chen X., Li J. & Ning C., Phys. Rev. A 93, 020501 (2016) |
| 42 | Mo | Molybdän | 0,747 3(3) | Bilodeau R.C., Scheer M. & Haugen H.K., J. Phys. B: At. Mol. Opt. Phys. 31, 3885 (1998) |
| 44 | Ru | Ruthenium | 1,046 38(25) | Norquist P.L., Beck D.R., Bilodeau R.C., Scheer M., Srawley R.A. & Haugen H.K., Phys. Rev. A 59, 1896 (1999) |
| 45 | Rh | Rhodium | 1,142 89(20) | Scheer M., Brodie C.A., Bilodeau R.C. & Haugen H.K., Phys. Rev. A 58, 2051 (1998) |
| 46 | Pd | Palladium | 0,562 14(12) | |
| 47 | Ag | Silber | 1,304 47(3) | Bilodeau R.C., Scheer M. & Haugen H.K., J. Phys. B: At. Mol. Opt. Phys. 31, 3885 (1998) |
| 49 | In | Indium | 0,383 92(6) | Walter C.W., Gibson N.D., Carman D.J., Li Y.-G. & Matyas D.J., Phys. Rev. A 82, 032507 (2010) |
| 50 | Sn | Zinn | 1,112 070(2) | Vandevraye M., Drag C. & Blondel C., J. Phys. B: At. Mol. Opt. Phys. 46, 125002 (2013) |
| 51 | Sb | Antimon | 1,047 401(19) | Scheer M., Haugen H.K. & Beck D.R., Phys. Rev. Lett. 79, 4104 (1997) |
| 52 | Te | Tellur | 1,970 875(7) | Haeffler G., Klinkmüller A.E., Rangell J., Berzinsh U. & Hanstorp D., Z. Phys. D 38, 211 (1996) |
| 53 | 127I | Iod | 3,059 046 5(37) | R.J. Peláez, C. Blondel, C. Delsart & C. Drag, J. Phys. B: At. Mol. Opt. Phys. 42 (2009) |
| 128I | 3,059 052(38) | Rothe S. et al., J. Phys. G: Nucl. Part. Phys. 44, 104003 (2017) | ||
| 55 | Cs | Cäsium | 0,471 630(25) | Hotop H. & Lineberger W.C., J. Phys. Chem. Ref. Data 14, 731 (1985) |
| 56 | Ba | Barium | 0,144 62(6) | Petrunin V.V., Voldstad J.D., Balling P., Kristensen P., Andersen T. & Haugen H.K., Phys. Rev. Lett. 75, 1911 (1995) |
| 57 | La | Lanthan | 0,55(2) | Pan L. & Beck D.R., Phys. Rev. A 93, 062501 (2016) |
| 58 | Ce | Cer | 0,57(2) | Felton J., Ray M. & Jarrold C.C., Phys. Rev. A 89, 033407(2014) |
| 59 | Pr | Praseodym | 0,962(24) | Davis V.T. & Thompson J.S., J. Phys. B: At. Mol. Opt. Phys. 35, L11 (2002) |
| 63 | Eu | Europium | 0,116(13) | Cheng S.-B. & Castleman A.W. Jr , Sci. Rep. 5, 12414 (2015) |
| 69 | Tm | Thulium | 1,029(22) | Davis V.T. & Thompson J.S., Phys. Rev. A 65, 010501 (2001) |
| 71 | Lu | Lutetium | 0,2388(7) | Fu X., Tang R., Lu Y. & Ning C., Chinese J. Chem. Phys. 32, 187 (2019) |
| 72 | Hf | Hafnium | 0,1780(7) | Tang R., Chen X., Fu X., Wang H. & Ning C., Phys. Rev. A 98, 020501(R) (2018) |
| 73 | Ta | Tantal | 0,323(12) | Feigerle C.S., Corderman R.R., Bobashev S.V. & Lineberger W.C., J. Chem. Phys. 74, 1580 (1981) |
| 74 | W | Wolfram | 0,816 26(8) | Lindahl A.O., Andersson P., Diehl C., Forstner O., Klason P. & Hanstorp D., Eur. Phys. J. D 60, 219 (2010) |
| 75 | Re | Rhenium | 0,060 396(64) | Chen, X., & Ning, C., J. Phys. Chem. Lett. 8, 2735 (2017) |
| 76 | Os | Osmium | 1,077 80(12) | Bilodeau R.C. & Haugen H. K., Phys. Rev. Lett. 85, 534 (2000) |
| 77 | Ir | Iridium | 1,564 36(15) | Bilodeau R.C., Scheer M., Haugen H.K. & Brooks R.L., Phys. Rev. A 61, 012505 (1999) |
| 78 | Pt | Platin | 2,125 10(5) | |
| 79 | Au | Gold | 2,308 610(25) | Andersen T., Haugen H.K. & Hotop H., J. Phys. Chem. Ref. Data 28, 1511 (1999) |
| 81 | Tl | Thallium | 0,377(13) | Carpenter D.L., Covington A. M. & Thompson J.S., Phys. Rev. A 61, 042501 (2000) |
| 82 | Pb | Blei | 0,356 721(2) | Bresteau D., Drag C. & Blondel C., J. Phys. B: At. Mol. Opt. Phys. 52, 065001 (2019) |
| 83 | Bi | Bismut | 0,942 362(13) | Bilodeau R.C. & Haugen H.K., Phys. Rev. A 64, 024501 (2001) |
| 84 | Po | Polonium | 1,405(61) (theoretisch) | Li, Zhao, Andersson, Zhang & Chen, J. Phys. B: At. Mol. Opt. Phys. 45, 165004 (2012) |
| 85 | At | Astat | 2,42(12) (theoretisch) | |
| 87 | Fr | Francium | 0,491(5) (theoretisch) | Landau A., Eliav E., Ishikawa Y. & Kaldor U., J. Chem. Phys. 115, 2389 (2001) |
Siehe auch
Einzelnachweise
- ↑ Eintrag zu electron affinity. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.E01977 – Version: 2.3.1.
- ↑ Theodore L. Brown, H. Eugene LeMay, Bruce E. Bursten: Chemie. Die zentrale Wissenschaft. Pearson Studium, 2007, ISBN 978-3-8273-7191-1, S. 321.
- ↑ Harald Ibach, Hans Lüth: Festkörperphysik. Einführung in die Grundlagen. 5. Auflage. Springer, Berlin 1999, S. 480.
- ↑ Charles E. Mortimer, Ulrich Müller (Hrsg.): Chemie – Basiswissen der Chemie. 8. Auflage. Thieme, Marburg 2003, S. 95.
Auf dieser Seite verwendete Medien
Autor/Urheber: Agung Karjono, Lizenz: CC BY-SA 3.0
Elektronenaffinität der Elemente aufgetragen über ihrer Ordnungszahl (die Hilfslinien zeigen den Trend innerhalb der Perioden; Edelgase sind in "Gruppe 0" und beginnen eine Trendlinie).
Autor/Urheber: Impartofit, Lizenz: CC BY-SA 3.0
Electron affinity EEA in a band diagram; EVAC, EC, EF, EV stands for vacuum energy, conduction band, fermi energy and the valence band, respectively.