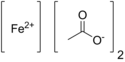
Eisen(II)-acetat
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Eisen(II)-acetat | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C4H6FeO4 | |||||||||||||||
| Kurzbeschreibung | hellbrauner Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 173,93 g·mol−1 | |||||||||||||||
| Aggregatzustand | fest[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit | löslich in Wasser[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Eisen(II)-acetat ist eine chemische Verbindung des Eisens aus der Gruppe der Acetate mit der Konstitutionsformel Fe(CH3COO)2.
Gewinnung und Darstellung
Eisen(II)-acetat kann durch Reaktion von Eisen mit Essigsäure gewonnen werden.[4]
Eigenschaften
Eisen(II)-acetat ist ein hellbrauner bis fast weißer, luft- und feuchtigkeitsempfindlicher Feststoff, der löslich in Wasser ist. Sein Tetrahydrat ist löslich in Wasser und Ethanol und besitzt eine grüne bis (durch Oxidation) braune Farbe.[5] Eisen(II)-acetat kristallisiert in der Raumgruppe Pbcn (Raumgruppen-Nr. 60) und als 2D-Koordinationspolymer aus Eisenatomen und Acetatgruppen.[6]
Verwendung
Eisen(II)-acetat wird als Zusatzstoff in Farben und als Beizmittel verwendet. Es dient auch als Katalysator in der organischen Chemie und als Ausgangsmaterial für andere Eisenverbindungen (z. B. Eisenkomplexe).[3] Das Tetrahydrat wird als Farbstoff für Textilien und Leder, in der Medizin und als Holzschutzmittel eingesetzt.[5]
Einzelnachweise
- ↑ Datenblatt Iron(II) acetate, anhydrous, Fe 29.5% min bei AlfaAesar, abgerufen am 17. Juli 2013 (PDF) (JavaScript erforderlich).
- ↑ a b c d Datenblatt Iron(II) acetate, ≥99.99% trace metals basis bei Sigma-Aldrich, abgerufen am 17. Juli 2013 (PDF).
- ↑ a b Alison E. Lewis, Christine Olsen: BIWIC 2007: 14th International Workshop on Industrial Crystallization : September 9th-11th, 2007, University of Cape Town, Cape Town, South Africa. IOS Press, 2007, ISBN 1-58603-790-0, S. 214 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ National Centre for Scientific Research "Demokritos", Institute of Materials Science Athens, Greece: Synthesis of Iron(II) acetate hydrate (ferrous acetate) (Memento des Originals vom 25. August 2013 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- ↑ a b Dale L. Perry: Handbook of Inorganic Compounds, Second Edition. Taylor & Francis US, 2011, ISBN 1-4398-1461-9, S. 173 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Birgit Weber, Richard Betz, Wolfgang Bauer, Stephan Schlamp: Crystal Structure of Iron(II) Acetate. In: Zeitschrift für anorganische und allgemeine Chemie. 637, 2011, S. 102–107, doi:10.1002/zaac.201000274.
Auf dieser Seite verwendete Medien
chemical structure of iron (II) acetate