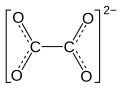
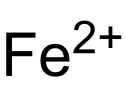Eisen(II)-oxalat
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Eisen(II)-oxalat | |||||||||||||||
| Andere Namen | Ferrooxalat | |||||||||||||||
| Summenformel | FeC2O4 | |||||||||||||||
| Kurzbeschreibung | gelbes Pulver[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 143,85 g·mol−1 | |||||||||||||||
| Aggregatzustand | fest | |||||||||||||||
| Dichte | 2,28 g·cm−3 (Dihydrat)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Eisen(II)-oxalat ist ein Eisensalz der Oxalsäure.
Vorkommen

Natürlich kommt Eisen(II)-oxalat-dihydrat als äußerst seltenes Mineral Humboldtin (nach Friedrich Heinrich Alexander von Humboldt) vor.[4]
Gewinnung und Darstellung
Man kann Eisen(II)-oxalat durch die Reaktion von wässrigen Eisen(II)-salzlösungen mit Oxalsäure oder Alkalioxalaten herstellen.
Eigenschaften

Eisen(II)-oxalat bildet blassgelbe, rhombische Kristalle. Das Dihydrat kommt in zwei verschiedenen (monoklin und orthorhombisch) Kristallformen vor.[6][7]
Wird Eisen(II)-oxalat auf über 190 °C erhitzt, so erhält man die sogenannte Wüstit-Phase[8] , ein schwarzes Eisenoxid-Produkt, das einen mehr oder minder großen Eisenunterschuss gegenüber der Formel FeO aufweist. Nachfolgend die Gleichung dieser Reaktion:
- .
- Eisenoxalat zerfällt bei Erhitzung zu → Eisen(II)-oxid + Kohlenstoffmonoxid + Kohlenstoffdioxid
Unter bestimmten Bedingungen kann über diese Reaktion auch stöchiometrisches Eisen(II)-oxid dargestellt werden (siehe hier).
Verwendung
Verwendung findet Eisen(II)-oxalat seit 1879 in der Analogfotografie als Entwickler.[9] Es wird weiterhin für optische Gläser verwendet.[10] Es eignet sich auch zur Herstellung von pyrophorem Eisen. Mit Kupfersulfat kann es zu Kupfer(II)-oxalat umgesetzt werden.[5]
Literatur
- R. Zboril, L. Machala u. a.: Structural, magnetic and size transformations induced by isothermal treatment of ferrous oxalate dihydrate in static air conditions. In: physica status solidi. 1, 2004, S. 3583, doi:10.1002/pssc.200405511.
- William Allen Miller: Elements of chemistry: theoretical and practical, Band 2 (eingeschränkte Vorschau in der Google-Buchsuche)
Einzelnachweise
- ↑ a b c d Datenblatt Eisen(II)-oxalat (Dihydrat) bei Alfa Aesar, abgerufen am 7. Januar 2010 (Seite nicht mehr abrufbar).
- ↑ tradekorea.com: Ferrous oxalate, battery grade, abgerufen am 3. März 2019.
- ↑ a b Eintrag zu Eisen(II)-oxalat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ mineralienatlas.de: Humboldtin (mindat).
- ↑ a b Patent US3846460A: Method of Manufacturing Copper Oxalate. Angemeldet am 25. April 1973, veröffentlicht am 5. November 1974, Anmelder: Cities Service Co, Erfinder: C Fite.
- ↑ I. Sledzinska and A. Murasik: Nuclear and magnetic diffuse scattering of neutrons from β-ferrous oxalate dihydrate, in: Journal of Applied Crystallography, 1988, 21 (5), 504–511; doi:10.1107/S0021889888005758.
- ↑ F. Aramu, V. Maxia, C. Muntoni: Mössbauer spectroscopy of polymorphous iron oxalate. In: Hyperfine Interactions. 5, 1977, S. 399, doi:10.1007/BF01021710.
- ↑ A. F. Holleman, E. Wiberg: Lehrbuch der Anorganischen Chemie. 37.–39. Auflage. Walter de Gruyter, Berlin 1956, S. 534.
- ↑ Sir William De W. Abney: Instruction in Photography (eingeschränkte Vorschau in der Google-Buchsuche)
- ↑ Schott: Spektroskopische Untersuchungen.
Auf dieser Seite verwendete Medien
Eisen(II)-oxalat
Autor/Urheber: Heiko4, Lizenz: CC BY-SA 4.0
Eisen(II)-oxalat-Dihydrat aus Eisen(II)-sulfat-Lösung mittels Oxalsäure gefällt
Struktur des Fe2+-Ions
Autor/Urheber: Vektorisierung: Alhadis, Lizenz: CC BY-SA 4.0
Structural formula for oxalate anion (C2O42–).