Einsteinium
| Eigenschaften | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Einsteinium, Es, 99 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elementkategorie | Actinoide | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | Ac, 7, f | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 252 u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius | 203 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Rn] 5f11 7s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 6.36758(25) eV[2] ≈ 614.38 kJ/mol[3] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 12.2(4) eV[2] ≈ 1180 kJ/mol[3] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 22.7(4) eV[2] ≈ 2190 kJ/mol[3] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ionisierungsenergie | 38.8(4) eV[2] ≈ 3740 kJ/mol[3] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Ionisierungsenergie | 54.1(1,9) eV[2] ≈ 5220 kJ/mol[3] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Modifikationen | 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | kubisch | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte | (berechnet) 8,84 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 1133 K (860 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 1269 K (996 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemisch[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | +2, +3, (+4) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Normalpotential | ? V (Es3+ + 3 e− → Es) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotope | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gefahren- und Sicherheitshinweise | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Radioaktiv | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Einsteinium ist ein ausschließlich künstlich erzeugtes chemisches Element mit dem Elementsymbol Es und der Ordnungszahl 99. Im Periodensystem steht es in der Gruppe der Actinoide (7. Periode, f-Block) und zählt zu den Transuranen. Einsteinium ist ein radioaktives Metall, welches nur mit hohem Aufwand in gerade noch wägbaren Mengen herstellbar ist. Es wurde 1952 nach dem Test der ersten amerikanischen Wasserstoffbombe entdeckt und Albert Einstein zu Ehren benannt, der jedoch persönlich mit der Entdeckung bzw. Forschung an Einsteinium nichts zu tun hatte. Es entsteht in sehr geringen Mengen in Kernreaktoren. Das Metall wie auch seine Verbindungen werden in geringen Mengen in erster Linie zu Studienzwecken gewonnen.
Geschichte

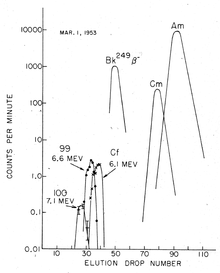
chromatographische Trennung von Fm (100), Es (99), Cf, Bk, Cm, Am.

Einsteinium wurde zusammen mit Fermium nach dem Test der ersten amerikanischen Wasserstoffbombe, Ivy Mike, am 1. November 1952 auf dem Eniwetok-Atoll gefunden. Erste Proben erhielt man auf Filterpapieren, die man beim Durchfliegen durch die Explosionswolke mitführte. Größere Mengen isolierte man später aus Korallen. Aus Gründen der militärischen Geheimhaltung wurden die Ergebnisse zunächst nicht publiziert.[5]
Eine erste Untersuchung der Explosionsüberreste hatte die Entstehung eines neuen Plutoniumisotops 244Pu aufgezeigt, dies konnte nur durch die Aufnahme von sechs Neutronen durch einen Uran-238-Kern und zwei folgende β-Zerfälle entstanden sein.
Zu der Zeit nahm man an, dass die Absorption von Neutronen durch einen schweren Kern ein seltener Vorgang wäre. Die Identifizierung von 244Pu ließ jedoch den Schluss zu, dass Urankerne viele Neutronen einfangen können, was zu neuen Elementen führt.[5]
Die Trennung der gelösten Actinoid-Ionen erfolgte in Gegenwart eines Citronensäure/Ammoniumcitrat-Puffers im schwach sauren Medium (pH ≈ 3,5) mit Ionenaustauschern bei erhöhter Temperatur. Element 99 (Einsteinium) wurde schnell nachgewiesen; man fand zuerst das Isotop 253Es, einen hochenergetischen α-Strahler (6,6 MeV).[5] Es entsteht durch Einfangen von 15 Neutronen aus 238U, gefolgt von sieben β-Zerfällen.[5]
Diese Bildung durch fortgesetzten Neutroneneinfang war möglich, weil im Moment der Detonation die Neutronenflussdichte so hoch war, dass die meisten der zwischenzeitlich gebildeten – radioaktiven – Atomkerne bis zum jeweils nächsten Neutroneneinfang noch nicht zerfallen waren. Bei sehr hohem Neutronenfluss steigt also die Massenzahl stark an, ohne dass sich die Ordnungszahl ändert. Erst anschließend zerfallen die entstandenen instabilen Nuklide über viele β-Zerfälle zu stabilen oder instabilen Nukliden mit hoher Ordnungszahl:
Im September 1953 war noch nicht abzusehen, wann die Ergebnisse der Teams in Berkeley, Argonne und Los Alamos veröffentlicht werden könnten. Man entschied sich dazu, die neuen Elemente durch Beschussexperimente herzustellen; gleichzeitig versicherte man sich, dass diese Ergebnisse nicht unter Geheimhaltung fallen würden und somit veröffentlicht werden konnten.[5] Einsteiniumisotope wurden kurz danach am University of California Radiation Laboratory durch Beschuss von Uran (238U) mit Stickstoff (14N) hergestellt. Dabei merkte man an, dass es Forschungen zu diesem Element gebe, die bislang noch unter Geheimhaltung stehen.[6][5] Isotope der beiden neu entdeckten Elemente wurden durch Bestrahlung des Plutoniumisotops 239Pu erzeugt, die Ergebnisse wurden in fünf kurz aufeinander folgenden Publikationen veröffentlicht.[7][8][9][10][11] Die letzten Reaktionen ausgehend von Californium sind:
Das Team in Berkeley war zudem besorgt, dass eine andere Forschergruppe die leichteren Isotope des Elements 100 durch Ionenbeschuss entdecken und veröffentlichen könnte, bevor sie ihre unter Geheimhaltung stehende Forschung hätten veröffentlichen können.[5] Denn im ausgehenden Jahr 1953 sowie zu Anfang des Jahres 1954 beschoss eine Arbeitsgruppe des Nobel-Instituts für Physik in Stockholm Urankerne mit Sauerstoffkernen; es bildete sich das Isotop mit der Massenzahl 250 des Elements 100 (250Fm).[12]
Das Team in Berkeley veröffentlichte schon einige Ergebnisse der chemischen Eigenschaften beider Elemente.[13][14] Schließlich wurden die Ergebnisse der thermonuklearen Explosion im Jahr 1955 freigegeben und anschließend publiziert.[15][16]
Letztlich war die Priorität des Berkeley-Teams allgemein anerkannt, da ihre fünf Publikationen der schwedischen Publikation vorausgingen, und sie sich auf die zuvor noch geheimen Ergebnisse der thermonuklearen Explosion von 1952 stützen konnten. Damit war das Vorrecht verbunden, den neuen Elementen den Namen zu geben. Sie entschieden sich, diese fortan nach berühmten, bereits verstorbenen Wissenschaftlern zu benennen. Man war sich schnell einig, die Namen zu Ehren von Albert Einstein und Enrico Fermi zu vergeben, die beide erst vor kurzem verstorben waren:[5] „We suggest for the name for the element with the atomic number 99, einsteinium (symbol E) after Albert Einstein and for the name for the element with atomic number 100, fermium (symbol Fm), after Enrico Fermi.“[15] Die Bekanntgabe für die beiden neu entdeckten Elemente Einsteinium und Fermium erfolgte durch Albert Ghiorso auf der 1. Genfer Atomkonferenz, die vom 8. bis 20. August 1955 stattfand.[5] Das Elementsymbol für Einsteinium wurde später von E auf Es geändert.[17]
Isotope
Sämtliche bisher bekannten 17 Nuklide und 3 Kernisomere sind radioaktiv und instabil.[18] Die bekannten Massenzahlen reichen von 241 bis 258. Die längste Halbwertszeit hat das Isotop 252Es mit 471,7 Tagen[19], so dass es auf der Erde keine natürlichen Vorkommen mehr geben kann. 254Es hat eine Halbwertzeit von 275,7 Tagen[20], 255Es von 39,8 Tagen und 253Es von 20,47 Tagen. Alle weiteren radioaktiven Isotope haben Halbwertszeiten unterhalb von 40 Stunden, bei der Mehrzahl von ihnen liegt diese unter 30 Minuten. Von den 3 Kernisomeren ist 254mEs das stabilste mit t½ = 39,3 Stunden.[21]
→ Liste der Einsteiniumisotope
Gewinnung und Darstellung
Einsteinium wird durch Beschuss von leichteren Actinoiden mit Neutronen in einem Kernreaktor erzeugt. Die Hauptquelle ist der 85 MW High-Flux-Isotope Reactor am Oak Ridge National Laboratory in Tennessee, USA, der auf die Herstellung von Transcuriumelementen (Z > 96) eingerichtet ist.[22]
Im Jahr 1961 wurde genügend Einsteinium synthetisiert, um eine wägbare Menge des Isotops 253Es zu erhalten. Diese Probe wog etwa 0,01 mg und wurde zur Herstellung von Mendelevium eingesetzt. Weiteres Einsteinium wurde am Oak Ridge National Laboratory durch Beschuss von 239Pu mit Neutronen hergestellt.[23] Ungefähr 3 Milligramm wurden in einer vierjährigen Dauerbestrahlung aus einem Kilogramm Plutonium und anschließender Trennung erhalten.
Gewinnung von Einsteiniumisotopen
Geringe Mengen an Einsteinium und Fermium wurden aus Plutonium isoliert und abgetrennt, welches mit Neutronen bestrahlt wurde. Vier Einsteiniumisotope wurden gefunden (mit Angabe der damals gemessenen Halbwertszeiten):
- 253Es: α-Strahler mit t½ = 20,03 Tagen sowie mit einer Spontanspaltungs-Halbwertszeit von 7×105 Jahren
- 254mEs: β-Strahler mit t½ = 38,5 Stunden
- 254Es: α-Strahler mit t½ ≈ 320 Tagen
- 255Es: β-Strahler mit t½ = 24 Tagen
Zwei Fermiumisotope wurden gefunden:
- 254Fm: α-Strahler mit t½ = 3,24 Stunden sowie mit einer Spontanspaltungs-Halbwertszeit von 246 Tagen
- 255Fm: α-Strahler mit t½ = 21,5 Stunden[24]
Durch Beschuss von Uran mit fünffach ionisierten Stickstoff- und sechsfach ionisierten Sauerstoffatomen wurden gleichfalls Einsteinium- und Fermiumisotope erzeugt.[25]
Das Isotop 248Es wurde beim Beschuss von 249Cf mit Deuterium identifiziert. Es zerfällt hauptsächlich durch Elektroneneinfang (ε) mit einer Halbwertszeit von 25 ± 5 Minuten, aber auch durch die Aussendung von α-Teilchen (6,87 ± 0,02 MeV). Das Verhältnis (ε / α) von ≈ 400 konnte durch die Menge des durch Elektroneneinfang entstandenen 248Cf identifiziert werden.[26]
Die Isotope 249Es, 250Es, 251Es und 252Es wurden durch Beschuss von 249Bk mit α-Teilchen erzeugt. Dabei können 4 bis 1 Neutronen den Kern verlassen, so dass die Bildung von vier unterschiedlichen Isotopen möglich ist.[27]
Obwohl das Isotop 252Es die längste Halbwertszeit ausweist, ist das Isotop 253Es leichter zugänglich und wird überwiegend für die Bestimmung der chemischen Eigenschaften herangezogen. Es wurde durch Bestrahlung von 100 bis 200 μg 252Cf mit thermischen Neutronen erhalten (Flussdichte: 2 bis 5×1014 Neutronen × cm−2 s−1, Zeitraum: 500 bis 900 h). Zur Trennung wurde Ammonium-α-hydroxyisobutyrat verwendet.[28]
Darstellung elementaren Einsteiniums
Einsteinium erhält man durch Reduktion von Einsteinium(III)-fluorid mit Lithium[29] oder Einsteinium(III)-oxid mit Lanthan.[30]
Eigenschaften

Im Periodensystem steht das Einsteinium mit der Ordnungszahl 99 in der Reihe der Actinoide, sein Vorgänger ist das Californium, das nachfolgende Element ist das Fermium. Sein Analogon in der Reihe der Lanthanoide ist das Holmium.
Physikalische Eigenschaften
Einsteinium ist ein radioaktives Metall mit einem Schmelzpunkt von 860 °C, einem Siedepunkt von 996 °C und einer Dichte von 8,84 g/cm3.[31] Es kristallisiert im kubischen Kristallsystem in der Raumgruppe Fm3m (Raumgruppen-Nr. 225) mit dem Gitterparameter a = 575 pm, was einem kubisch flächenzentrierten Gitter (f.c.c.) beziehungsweise einer kubisch dichtesten Kugelpackung mit der Stapelfolge ABC entspricht. Die Radioaktivität ist derart stark, dass dadurch das Metallgitter zerstört wird.[30] Das Metall ist divalent und besitzt eine merklich hohe Flüchtigkeit.[32]
Chemische Eigenschaften
Einsteinium ist wie alle Actinoide sehr reaktionsfähig. In wässriger Lösung ist die dreiwertige Oxidationsstufe am beständigsten, jedoch kennt man auch zwei- und vierwertige Verbindungen. Zweiwertige Verbindungen konnten bereits als Feststoffe dargestellt werden; der vierwertige Zustand konnte bereits beim chemischen Transport in Tracermengen postuliert werden, eine endgültige Bestätigung steht aber noch aus.[17] Wässrige Lösungen mit Es3+-Ionen haben eine blassrosa Farbe.[33]
Sicherheitshinweise
Einstufungen nach der CLP-Verordnung liegen nicht vor, weil diese nur die chemische Gefährlichkeit umfassen und eine völlig untergeordnete Rolle gegenüber den auf der Radioaktivität beruhenden Gefahren spielen. Auch Letzteres gilt nur, wenn es sich um eine dafür relevante Stoffmenge handelt.
Verwendung
Einsteinium findet vor allem Anwendung bei der Erzeugung höherer Transurane und Transactinoide. Ansonsten werden das Metall wie auch seine Verbindungen in erster Linie in geringen Mengen zu Studienzwecken gewonnen.
Verbindungen
→ Kategorie: Einsteiniumverbindung
Die Untersuchung von Einsteiniumverbindungen ist durch mehrere Faktoren begrenzt:[34]
- Das am leichtesten erhältliche Isotop 253Es ist nur ein- oder zweimal im Jahr im Mikrogramm-Maßstab verfügbar.
- Durch die in rund 20-tägiger Halbwertszeit erzeugte intensive Alphastrahlung werden Fernordnungen in Feststoffen sehr rasch zerstört.
- Durch den radioaktiven Zerfall entstehen die Isotope 249Bk und 249Cf, die die Probe rasch verunreinigen. Die Rate beträgt pro Tag ca. 3 %.[35]
Oxide
Einsteinium(III)-oxid (Es2O3) wurde durch Glühen des entsprechenden Nitrats in Submikrogramm-Mengen erhalten. Der Gitterparameter des kubisch-raumzentrierten Kristalls beträgt 1076,6(6) pm.[35] Es sind ferner noch eine monokline und eine hexagonale Lanthan(III)-oxid-Struktur bekannt.[36]
Oxihalogenide
Bekannt sind die Oxihalogenide Einsteinium(III)-oxichlorid (EsOCl),[37] Einsteinium(III)-oxibromid (EsOBr)[38] und Einsteinium(III)-oxiiodid (EsOI).[37] Einsteinium(III)-oxichlorid besitzt eine tetragonale Struktur vom PbFCl-Typ.[37]
Halogenide

Halogenide sind für die Oxidationsstufen +2 und +3 bekannt.[37][39] Die stabilste Stufe +3 ist für sämtliche Verbindungen von Fluor bis Iod bekannt und auch in wässriger Lösung stabil.
| Oxidationszahl | F | Cl | Br | I |
| +3 | Einsteinium(III)-fluorid EsF3 | Einsteinium(III)-chlorid EsCl3 orange | Einsteinium(III)-bromid EsBr3 weißgelb | Einsteinium(III)-iodid EsI3 bernsteinfarben |
| +2 | Einsteinium(II)-chlorid EsCl2 | Einsteinium(II)-bromid EsBr2 | Einsteinium(II)-iodid EsI2 |
Einsteinium(III)-fluorid (EsF3) kann durch Ausfällung aus Einsteinium(III)-chlorid-Lösungen mit Fluorid dargestellt werden, als auch aus Einsteinium(III)-oxid durch Umsetzung mit ClF3 oder F2 bei 1–2 Atmosphären Druck und 300–400 °C. Die Kristallstruktur konnte nicht bestimmt werden, es wird aber davon ausgegangen, dass sie wie bei Berkelium(III)-fluorid (BkF3) und Californium(III)-fluorid (CfF3) dem LaF3-Typ entspricht.[34][40]
Einsteinium(III)-chlorid (EsCl3) ist ein orangefarbener Feststoff und bildet eine hexagonale Struktur vom UCl3-Typ, wobei das Es-Atom 9-fach koordiniert ist.[41][42]
Einsteinium(III)-bromid (EsBr3) ist ein weißgelber Feststoff und bildet eine monokline Struktur vom AlCl3-Typ.[43]
Einsteinium(III)-iodid (EsI3) ist ein bernsteinfarbener Feststoff und bildet eine hexagonale Struktur vom BiI3-Typ.[44][45]
Die zweiwertigen Verbindungen des Einsteiniums werden durch Reduktion der dreiwertigen Halogenide mit Wasserstoff dargestellt.[38]
Von Einsteinium(II)-chlorid (EsCl2)[46], Einsteinium(II)-bromid (EsBr2)[47] und Einsteinium(II)-iodid (EsI2)[37] sind keine näheren kristallographischen Daten bekannt, wohl aber Messwerte von Absorptionsbanden.
Literatur
- Richard G. Haire: Einsteinium, in: Lester R. Morss, Norman M. Edelstein, Jean Fuger (Hrsg.): The Chemistry of the Actinide and Transactinide Elements, Springer, Dordrecht 2006; ISBN 1-4020-3555-1, S. 1577–1620 (doi:10.1007/1-4020-3598-5_12).
- Glenn T. Seaborg (Hrsg.): Proceedings of the 'Symposium Commemorating the 25th Anniversary of Elements 99 and 100', 23. Januar 1978; Report LBL-7701, April 1979.
- Gmelins Handbuch der anorganischen Chemie, System Nr. 71, Transurane: Teil A 1 II, S. 20–21; Teil A 2, S. 46–47; Teil B 1, S. 82–84.
- Structural and spectroscopic characterization of an einsteinium complex
Weblinks
- Eintrag zu Einsteinium. In: Römpp Online. Georg Thieme Verlag, abgerufen am 3. Januar 2015.
- Albert Ghiorso: Einsteinium and Fermium, Chemical & Engineering News, 2003.
- Nadja Podbregar: Neuer Einblick in das exotische Element Einsteinium, scinexx.de – 5. Februar 2021
- Das mysteriöse Element mit 99 Elektronen
Einzelnachweise
- ↑ Die Werte der atomaren und physikalischen Eigenschaften (Infobox) sind, wenn nicht anders angegeben, entnommen aus: Richard G. Haire:Einsteinium ( vom 17. Juli 2010 im Internet Archive), in: Lester R. Morss, Norman M. Edelstein, Jean Fuger (Hrsg.): The Chemistry of the Actinide and Transactinide Elements, Springer, Dordrecht 2006; ISBN 1-4020-3555-1, S. 1577–1620.
- ↑ a b c d e Eintrag zu einsteinium in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1). Hrsg.: NIST, Gaithersburg, MD. doi:10.18434/T4W30F (physics.nist.gov/asd). Abgerufen am 13. Juni 2020.
- ↑ a b c d e Eintrag zu einsteinium bei WebElements, www.webelements.com, abgerufen am 13. Juni 2020.
- ↑ Die von der Radioaktivität ausgehenden Gefahren gehören nicht zu den einzustufenden Eigenschaften nach der GHS-Kennzeichnung. In Bezug auf weitere Gefahren wurde dieses Element entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b c d e f g h i Albert Ghiorso: Einsteinium and Fermium, Chemical & Engineering News, 2003.
- ↑ Albert Ghiorso, G. Bernard Rossi, Bernard G. Harvey, Stanley G. Thompson: Reactions of U238 with Cyclotron-Produced Nitrogen Ions, in: Physical Review, 1954, 93 (1), S. 257–257 (doi:10.1103/PhysRev.93.257).
- ↑ S. G. Thompson, A. Ghiorso, B. G. Harvey, G. R. Choppin: Transcurium Isotopes Produced in the Neutron Irradiation of Plutonium, in: Physical Review, 1954, 93 (4), S. 908–908 (doi:10.1103/PhysRev.93.908).
- ↑ B. G. Harvey, S. G. Thompson, A. Ghiorso, G. R. Choppin: Further Production of Transcurium Nuclides by Neutron Irradiation, in: Physical Review, 1954, 93 (5), S. 1129–1129 (doi:10.1103/PhysRev.93.1129).
- ↑ M. H. Studier, P. R. Fields, H. Diamond, J. F. Mech, A. M. Friedman, P. A. Sellers, G. Pyle, C. M. Stevens, L. B. Magnusson, J. R. Huizenga: Elements 99 and 100 from Pile-Irradiated Plutonium, in: Physical Review, 1954, 93 (6), S. 1428–1428 (doi:10.1103/PhysRev.93.1428).
- ↑ P. R. Fields, M. H. Studier, J. F. Mech, H. Diamond, A. M. Friedman, L. B. Magnusson, J. R. Huizenga: Additional Properties of Isotopes of Elements 99 and 100, in: Physical Review, 1954, 94 (1), S. 209–210 (doi:10.1103/PhysRev.94.209).
- ↑ G. R. Choppin, S. G. Thompson, A. Ghiorso, B. G. Harvey: Nuclear Properties of Some Isotopes of Californium, Elements 99 and 100, in: Physical Review, 1954, 94 (4), S. 1080–1081 (doi:10.1103/PhysRev.94.1080).
- ↑ Hugo Atterling, Wilhelm Forsling, Lennart W. Holm, Lars Melander, Björn Åström: Element 100 Produced by Means of Cyclotron-Accelerated Oxygen Ions, in: Physical Review, 1954, 95 (2), S. 585–586 (doi:10.1103/PhysRev.95.585.2).
- ↑ G. T. Seaborg, S. G. Thompson, B. G. Harvey, G. R. Choppin: Chemical Properties of Elements 99 and 100 (Abstract; Maschinoskript (23. Juli 1954), Radiation Laboratory, University of California, Berkeley, UCRL-2591 (Rev.)).
- ↑ S. G. Thompson, B. G. Harvey, G. R. Choppin, G. T. Seaborg: Chemical Properties of Elements 99 and 100, in: J. Am. Chem. Soc., 1954, 76 (24), S. 6229–6236 (doi:10.1021/ja01653a004).
- ↑ a b A. Ghiorso, S. G. Thompson, G. H. Higgins, G. T. Seaborg (Radiation Laboratory and Department of Chemistry, University of California, Berkeley, California), M. H. Studier, P. R. Fields, S. M. Fried, H. Diamond, J. F. Mech, G. L. Pyle, J. R. Huizenga, A. Hirsch, W. M. Manning (Argonne National Laboratory, Lemont, Illinois), C. I. Browne, H. L. Smith, R. W. Spence (Los Alamos Scientific Laboratory, Los Alamos, New Mexico): New Elements Einsteinium and Fermium, Atomic Numbers 99 and 100, in: Physical Review, 1955, 99 (3), S. 1048–1049 (doi:10.1103/PhysRev.99.1048; Maschinoskript (9. Juni 1955), Lawrence Berkeley National Laboratory. Paper UCRL-3036).
- ↑ P. R. Fields, M. H. Studier, H. Diamond, J. F. Mech, M. G. Inghram, G. L. Pyle, C. M. Stevens, S. Fried, W. M. Manning (Argonne National Laboratory, Lemont, Illinois); A. Ghiorso, S. G. Thompson, G. H. Higgins, G. T. Seaborg (University of California, Berkeley, California): Transplutonium Elements in Thermonuclear Test Debris, in: Physical Review, 1956, 102 (1), S. 180–182 (doi:10.1103/PhysRev.102.180).
- ↑ a b Richard G. Haire:Einsteinium ( vom 17. Juli 2010 im Internet Archive), in: Lester R. Morss, Norman M. Edelstein, Jean Fuger (Hrsg.): The Chemistry of the Actinide and Transactinide Elements, Springer, Dordrecht 2006; ISBN 1-4020-3555-1, S. 1577–1620.
- ↑ G. Pfennig, H. Klewe-Nebenius, W. Seelmann-Eggebert (Hrsg.): Karlsruher Nuklidkarte, 7. Aufl., 2006.
- ↑ Irshad Ahmad, Frank Wagner, Jr.: Half-life of the longest-lived Einsteinium Isotope-252Es, in: J. Inorg. Nucl. Chem., 1977, 39 (9), S. 1509–1511 (doi:10.1016/0022-1902(77)80089-4).
- ↑ William McHarris, F. S. Stephens, F. Asaro, I. Perlman: Decay Scheme of Einsteinium-254, in: Physical Review, 1966, 144 (3), S. 1031–1045 (doi:10.1103/PhysRev.144.1031).
- ↑ G. Audi, O. Bersillon, J. Blachot, A. H. Wapstra: The NUBASE evaluation of nuclear and decay properties, in: Nuclear Physics A, 729, 2003, S. 3–128. doi:10.1016/j.nuclphysa.2003.11.001. (PDF; 1,0 MB).
- ↑ High Flux Isotope Reactor, Oak Ridge National Laboratory; abgerufen am 23. September 2010.
- ↑ Darleane C. Hoffman, Albert Ghiorso, Glenn Theodore Seaborg: The Transuranium People: The Inside Story, Imperial College Press, 2000, ISBN 978-1-86094-087-3, S. 190–191 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ M. Jones, R. P. Schuman, J. P. Butler, G. Cowper, T. A. Eastwood, H. G. Jackson: Isotopes of Einsteinium and Fermium Produced by Neutron Irradiation of Plutonium, in: Physical Review, 1956, 102 (1), S. 203–207 (doi:10.1103/PhysRev.102.203).
- ↑ L. I. Guseva, K. V. Filippova, Yu. B. Gerlit, V. A. Druin, B. F. Myasoedov, N. I. Tarantin: Experiments on the Production of Einsteinium and Fermium with a Cyclotron, in: Journal of Nuclear Energy, 1954, 3 (4), S. 341–346 (übersetzt im November 1956) (doi:10.1016/0891-3919(56)90064-X).
- ↑ A. Chetham-Strode, L. W. Holm: New Isotope Einsteinium-248, in: Physical Review, 1956, 104 (5), S. 1314–1314 (doi:10.1103/PhysRev.104.1314).
- ↑ Bernard G. Harvey, Alfred Chetham-Strode, Albert Ghiorso, Gregory R. Choppin, Stanley G. Thompson: New Isotopes of Einsteinium, in: Physical Review, 1956, 104 (5), S. 1315–1319 (doi:10.1103/PhysRev.104.1315).
- ↑ S. A. Kulyukhin, L. N. Auerman, V. L. Novichenko, N. B. Mikheev, I. A. Rumer, A. N. Kamenskaya, L. A. Goncharov, A. I. Smirnov: Production of Microgram Quantities of Einsteinium-253 by the Reactor Irradiation of Californium, in: Inorganica Chimica Acta, 1985, 110 (1), S. 25–26 (doi:10.1016/S0020-1693(00)81347-X).
- ↑ B. B. Cunningham, T. C. Parsons, USAEC Doc. UCRL-20426 (1971), S. 239.
- ↑ a b R. G. Haire, R. D. Baybarz: Studies of einsteinium metal, in: Journal de Physique Colloques, 1979, 40 (C4), S. 101–102 (doi:10.1051/jphyscol:1979431; PDF; PDF (Maschinoskript)).
- ↑ R. G. Haire: Properties of the Transplutonium Metals (Am-Fm), in: Metals Handbook, Vol. 2, 10. Auflage, (ASM International, Materials Park, Ohio, 1990), S. 1198–1201.
- ↑ Phillip D. Kleinschmidt, John W. Ward, George M. Matlack, Richard G. Haire: Henry’s Law vaporization studies and thermodynamics of einsteinium‐253 metal dissolved in ytterbium, in: J. Chem. Phys., 1984, 81, S. 473–477 (doi:10.1063/1.447328).
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1956.
- ↑ a b D. D. Ensor, J. R. Peterson, R. G. Haire, J. P. Young: Absorption spectrophotometric study of 253EsF3 and its decay products in the bulk-phase solid state, in: J. Inorg. Nucl. Chem., 1981, 43 (10), S. 2425–2427 (doi:10.1016/0022-1902(81)80274-6).
- ↑ a b R. G. Haire, R. D. Baybarz: Identification and Analysis of Einsteinium Sesquioxide by Electron Diffraction, in: J. Inorg. Nucl. Chem., 1973, 35 (2), S. 489–496 (doi:10.1016/0022-1902(73)80561-5).
- ↑ R. G. Haire, L. Eyring, in: Handbook on the Physics and Chemistry of Rare Earths, vol. 18 Lanthanoids and Actinides Chemistry (hrsg. von K. A. Gscheidner, Jr., L. Eyring, G. R. Choppin, G. H. Lander), North-Holland, New York 1994, S. 414–505.
- ↑ a b c d e J. P. Young, R. G. Haire, J. R. Peterson, D. D. Ensor, R. L. Fellow: Chemical Consequences of Radioactive Decay. 2. Spectrophotometric Study of the Ingrowth of Berkelium-249 and Californium-249 into Halides of Einsteinium-253, in: Inorg. Chem., 1981, 20 (11), S. 3979–3983 (doi:10.1021/ic50225a076).
- ↑ a b J. R. Peterson, D. D. Ensor, R. L. Fellows, R. G. Haire, J. P. Young: Preparation, characterization, and decay of einsteinium(II) in the solid state, in: Journal de Physique Colloques, 1979, 40 (C4), S. 111–113 (doi:10.1051/jphyscol:1979435; PDF).
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1969.
- ↑ J. P. Young, R. G. Haire, R. L. Fellows, J. R. Peterson: Spectrophotometric studies of transcurium element halides and oxyhalides in the solid state, in: Journal of Radioanalytical Chemistry, 1978, 43 (2), S. 479–488 (doi:10.1007/BF02519508).
- ↑ D. K. Fujita, B. B. Cunningham, T. C. Parsons, J. R. Peterson: The solution absorption spectrum of Es3+, in: Inorg. Nucl. Chem. Lett., 1969, 5 (4), S. 245–250 (doi:10.1016/0020-1650(69)80192-3).
- ↑ D. K. Fujita, B. B. Cunningham, T. C. Parsons: Crystal structures and lattice parameters of einsteinium trichloride and einsteinium oxychloride, in: Inorg. Nucl. Chem. Lett., 1969, 5 (4), S. 307–313 (doi:10.1016/0020-1650(69)80203-5).
- ↑ R. L. Fellows, J. R. Peterson, M. Noé, J. P. Young, R. G. Haire: X-ray diffraction and spectroscopic studies of crystalline einsteinium(III) bromide, 253EsBr3, in: Inorg. Nucl. Chem. Lett., 1975, 11 (11), S. 737–742 (doi:10.1016/0020-1650(75)80090-0).
- ↑ R. G. Haire, ORNL Report 5485, 1978.
- ↑ J. R. Peterson: Chemical Properties of Einsteinium: Part II, in: G. T. Seaborg (Hrsg.): Proceedings of the 'Symposium Commemorating the 25th Anniversary of Elements 99 and 100', 23. Januar 1978; Report LBL-7701, April 1979, S. 55–64.
- ↑ R. L. Fellows, J. P. Young, R. G. Haire, J. R. Peterson, in: The Rare Earths in Modern Science and Technology (hrsg. von G. J. McCarthy und J. J. Rhyne), Plenum Press, New York 1977, S. 493–499.
- ↑ J. P. Young, R. G. Haire, R. L. Fellows, M. Noé, J. R. Peterson: Spectroscopic and X-ray Diffraction Studies of the Bromides of Cf-249 and Es-253, in: Transplutonium 1975 (hrsg. von W. Müller und R. Lindner), North Holland, Amsterdam 1976, S. 227–234.
Auf dieser Seite verwendete Medien
Einsteinium(III) iodide glowing in the dark (not illuminated!)
Self‐luminescence arising from the intense radiation from ~300 µg of 253Es solid in a quartz cone (9 mm diameter). The heat and radiation accompanying decay often generate detrimental effects in studies of Es.
U.S. nuclear weapon test MIKE of Operation Ivy, 31 Oct 1952, the first test of a thermonuclear weapon (hydrogen bomb).
Elutionskurven Fm Es Cf Bk Cm Am





