Druse (Netzhaut)
| Klassifikation nach ICD-10 | |
|---|---|
| H35.3 | Degeneration der Makula und des hinteren Poles |
| ICD-10 online (WHO-Version 2019) | |
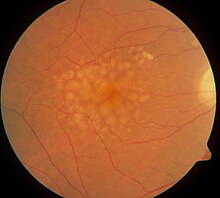
Als Drusen bezeichnet man Ablagerungen von extrazellulärem Material unterhalb der Netzhaut. Sie kommen ubiquitär in allen Altersklassen vor, nehmen jedoch mit steigendem Lebensalter an Größe und Anzahl zu. Sie gelten als Frühform der altersbedingten Makuladegeneration. Drusen verursachen per se keine Einschränkung der Sehkraft, können jedoch zu Störungen der Farb- und Kontrastsensitivität führen.
Etymologie und Geschichte
Drusen wurden erstmals 1855, im ersten Band des Archivs für Ophthalmologie, von F.C. Donders beschrieben.[1] Er entdeckte kugelförmige Ablagerungen unterhalb der Netzhaut einer 80-jährigen Patientin und präparierte sie. Aufgrund der von ihm durchgeführten Experimente kam er zu dem Schluss, sie am ehesten mit Kolloidgewebe vergleichen zu können:
Aber wie ist sie zu nennen? Für den Augenblick weiss ich es in der That nicht, aber der Begriff von dem hybriden Wort Colloid ist so dehnbar, dass ich glaube nicht indiscret zu sein, wenn ich mir darin vorläufig ein Plätzchen für diese Kugeln erbitte. Ich will sie daher einfach Colloidkugeln nennen.
Und weiter:
Wie und woraus entwickeln sich diese Kugeln? Beim ersten Anblick kam es mir bereits wahrscheinlich vor, dass sie aus den Kernen der Pigmentzellen entstehen. Weitere Untersuchungen haben mich von der Richtigkeit dieser Vermuthung vollständig überzeugt.
Diese Feststellung legte den Grundstein für die Transformationstheorie über die Entstehung von Drusen. Bereits ein Jahr später, 1856, entwickelte H. Müller die sog. Depositionstheorie, wonach Drusen aus Ablagerungen von Abbauprodukten der Netzhaut entstehen.[2] Er führte auch den Begriff "Druse" ein, in Anlehnung an deren Aussehen, das ihn an die mineralischen Steinformationen erinnerte. Der Begriff Druse setzte sich schlussendlich in der internationalen Fachliteratur durch.
Definition und Formen
Als Druse wird definitionsgemäß eine fokale Ablagerung von extrazellulärem Material zwischen der basalen Lamina des retinalen Pigmentepithels und der inneren kollagenen Schicht der Bruch´schen Membran bezeichnet.[3]
Bereits Donders beschrieb in seinem wissenschaftlichen Aufsatz das unterschiedliche Aussehen von Drusen. Klinisch wird heute zwischen harten und weichen Drusen unterschieden, in Abhängigkeit ihrer Ränder, sowie weiters von kalzifizierten Drusen, wenn diese funduskopisch einen hochreflektiven weißlichen Inhalt aufweisen.[4] Histologisch wurde jedoch eine wesentlich größere Vielfalt an unterschiedlichen Drusenformen beobachtet.[5] Eine ähnliche Vielfalt findet sich in den Tomographieschnitten der Optischen Kohärenztomographie.[6]

Eine genauere Beurteilung über die klinische Bedeutung dieser unterschiedlichen Drusentypen für die Progression der altersbedingten Makuladegeneration steht noch aus.
Eine Drusenpapille ist eine andere Entität.
Epidemiologie
98,8 % der Gesamtpopulation besitzen zumindest eine Druse.[7] Dabei sind kleine harte Drusen (unter 63 µm Durchmesser) die mit Abstand häufigsten, was die Vermutung nahelegt, dass es sich bei diesen um physiologische Erscheinungen ohne Krankheitswert handelt. Die Prävalenz von Drusen über 63 µm Durchmesser sowie weichen Drusen steigt mit zunehmendem Alter an; sie lassen sich in rund 60 % aller Personen über 75 Jahre finden.
Entstehung
Der genaue Entstehungsmechanismus von Drusen ist trotz zahlreicher wissenschaftlicher Forschungsarbeit zu einem guten Teil noch unbekannt. Generell wird eine Mischung aus oben genannter Transformations- und Depositionstheorie angenommen. Dabei dienen z. B. durch oxidativen Stress und entsprechender genetischen Veranlagung vorgeschädigte Pigmentepithelzellen als Trigger für immun-mediierte Prozesse, bei denen vor allem das Komplementsystem eine große Rolle zu spielen scheint. In weiterer Folge kommt es zur Ablagerung von Immunkomplexen, Proteinen und Lipiden.[8]
Drusenbestandteile
Hauptbestandteil von Drusen bilden Lipide, vor allem Cholesterin,[9] welches auch für das gelbliche Aussehen von Drusen verantwortlich gemacht wird. Weiters finden sich Kohlenhydrate, Zink sowie extrazelluläre Matrixbestandteile. Bis dato konnten außerdem mindestens 129 verschiedene Proteine im Inneren der Drusen identifiziert werden, von denen der Großteil im Zusammenhang mit Entzündungen oder immun-assoziierten Prozessen stehen.[8] Zudem finden sich in Drusen auch diverse Zellbestandteile, wie Lipofuszin und Melanin, bis hin zu kompletten Zellen, wie etwa dendritische Zellen.
Weiterer Verlauf
Über die weitere Entwicklung von Drusen kann anhand der histologischen Studien nur spekuliert werden. Bei der physiologischen Form von Drusen nimmt man an, dass nach erfolgter Heilung des Pigmentepithels die Ablagerungen durch die Bruch-Membran durchgeschleust werden und von der Choroidea absorbiert werden. Die Druse verschwindet somit nach einiger Zeit spurlos. Speziell bei den im höheren Alter beobachteten weichen Drusen scheint jedoch eine irreversible Schädigung des Pigmentepithels vorzuliegen, die durch die Entwicklung einer Druse noch gefördert wird. Zudem dürfte der Abtransport der Drusenbestandteile durch eine altersbedingt verdickte Bruch-Membran erheblich vermindert sein. Es kommt schließlich zu einer kompletten Degeneration und Atrophie des Pigmentepithels über der Druse und damit einhergehend zu einer Degeneration der darüberliegenden Photorezeptoren. Dieses Stadium bildet definitionsgemäß den Beginn einer Altersbedingten Makuladegeneration (AMD).
Drusen als Risikofaktor für die Altersbedingte Makuladegeneration
Das Auftreten von weichen Drusen mit oder ohne Pigmentverschiebungen charakterisiert definitionsgemäß das Krankheitsbild der Altersbedingten Makulopathie.[10] Harten Drusen wird derzeit kein Krankheitswert beigemessen. Die Altersbedingte Makulopathie wird gerne auch als "Frühform" der AMD bezeichnet. Basierend auf diesen Klassifikationen, die fließend in die der AMD einfließt, wurde in den 1990er Jahren die großangelegte multizentrische Studie Age-Related Eye Disease Study (AREDS) aufgebaut, die sich zum Ziel setzte, die klinischen Erscheinungen und Entwicklungen der Altersbedingten Makulopathie und -degeneration zu untersuchen.[11] Dabei konnte die Anzahl von Drusen als auch deren Gesamtflächeninhalt pro Auge als klinisch signifikanter Risikofaktor für die Entwicklung einer AMD festgesetzt werden.[12] Über das exakte Risikopotential gehen die Schätzungen jedoch auseinander. Studien berichten über ein Risiko, bei bilateral vorhandenen Drusen innerhalb der nächsten 5 Jahre eine feuchte AMD zu entwickeln, zwischen 0,2 %[13] und 40 %.[14] Diese großen Unterschiede legen nahe, dass es eine Vielzahl unterschiedlicher Drusentypen gibt, für die entsprechende Studienmodelle entwickelt werden müssten.
Klinik
Drusen verursachen per se keine Störungen der Sehkraft und sind daher meistens ein Zufallsbefund. In manchen Fällen wird jedoch bei meist großer Anzahl von Drusen von Störungen des Kontrastsehens und Farbempfindens, sowie von Abnahme der Sensitivität im zentralen Gesichtsfeld berichtet.[8]
Drusen in anderen Erkrankungen als AMD
Primär werden Drusen als Frühform der AMD verstanden, sie finden sich jedoch auch in anderen Erkrankungen, etwa oberhalb pigmentierter Nävi oder maligner Melanome.[15] Ebenso wurden Drusen bei lange bestehender Retinopathia centralis serosa beschrieben. Zudem wurde ein Zusammenhang von Drusen und Glomerulonephritis Typ II gefunden, was insofern interessant ist, als höchstwahrscheinlich derselbe Mechanismus pathologischer Ablagerungen zugrunde liegt.[16] Weiters finden sich Drusen bei einigen familiären Makuladegenerationen, etwa Malattia Leventinese (auch Doynsche Honigwaben-Dystrophie)[17] und der Sorsby Fundusdystrophie.[18]
Therapie
Nach derzeitigem Stand der medizinischen Wissenschaft gibt es keine effektive Therapie gegen Drusen. Die in den 90ern gerne eingesetzte Laserkoagulationstherapie konnte zwar ein eindrucksvolles Zurückbilden weicher Drusen nach erfolgter Laserkoagulation zeigen, das Risiko, eine AMD zu entwickeln, verringerte sich jedoch nicht. Patienten mit Drusen wird gemäß den Ergebnissen der AREDS-Studie eine prophylaktische Vitamin-Supplemention mit Lutein und Omega-3-Fettsäuren empfohlen. Diese senkt das Risiko des Eintretens einer AMD signifikant.[19] Weiters wird eine vierteljährliche Kontrolle beim Augenfacharzt empfohlen, um das Eintreten einer AMD frühestmöglichst diagnostizieren zu können.
Weblinks
Einzelnachweise
- ↑ F. C. Donders: Beiträge zur pathologischen Anatomie des Auges. In: Archiv für Ophthalmologie. 1855;1(2), S. 106–118.
- ↑ H. Müller: Untersuchungen über die Glashäute des Auges, insbesondere die Glaslamelle der Choroidea und ihre senilen Veränderungen. In: Arch Ophthalmol. 1856;2(2), S. 1–64.
- ↑ W. R. Green: Histopathology of age-related macular degeneration. In: Mol Vis. 1999;5, S. 27.
- ↑ R. Klein, M. Davis, Y. Magli, P. Segal, B. Klein, L. Hubbard: The Wisconsin age-related maculopathy grading system. In: Ophthalmology. 1991;98, S. 1128–1134.
- ↑ M. Rudolf, M. E. Clark, M. F. Chimento, C. M. Li, N. E. Medeiros, C. A. Curcio: Prevalence and Morphology of Druse Types in the Macula and Periphery of Eyes with Age-Related Maculopathy. In: IOVS. 2008;49, S. 1200–1209.
- ↑ A. A. Khanifar, A. F. Koreishi, J. A. Izatt, C. A. Toth: Drusen ultrastructure imaging with spectral domain optical coherence tomography in age-related macular degeneration. In: Ophthalmology. 2008;115, S. 1883–1890.
- ↑ R. Klein, B. Klein, K. Linton: Prevalence of age-related maculopathy. In: Ophthalmology. 1992;99, S. 933–943.
- ↑ a b c G. S. Hageman u. a.: An Integrated Hypothesis that considers Drusen as Biomarkers of immune-mediated Processes at the RPE-Bruch´s membrane Interface in Aging and Age-Related Macular Degeneration. In: Prog Ret Eye Res. 2001;20, S. 705–732.
- ↑ C. Curcio, C. Millican, T. Bailey, H. Kruth: Accumulation of cholesterol with age in human Bruch´s membrane. In: IOVS. 2001;42, S. 265–274.
- ↑ A. C. Bird u. a.: An International Classification and Grading System for Age-related Makulopathy and Age-related Macular Degeneration. In: Surv Ophthalmol. 1995;39, S. 367–374.
- ↑ The Age-Related Eye Disease Study Group. The Age-Related Eye Disease Study (AREDS): design implications. AREDS report no. 1. In: Control Clin Trials 1999;20, S. 573–600.
- ↑ The Age-Related Eye Disease Study Group. Risk factors associated with age-related macular degeneration. A case-control study in the age-related eye disease study: Age-Related Eye Disease Study Report Number 3. In: Ophthalmol. 2000;107, S. 2224–2232.
- ↑ N. M. Bressler u. a.: Five-year incidence and disappearance of drusen and retinal pigment epithelial abnormalities: Waterman Study. In: Arch Ophthalmol. 1995;113, S. 301–308.
- ↑ F. G. Holz u. a.: Bilateral macular drusen in age-related macular degeneration: prognosis and risk factors. In: Ophthalmol. 1994;101, S. 1522–1528.
- ↑ G. Fishman, D. Apple, M. Goldberg: Retinal and pigment epithelial alterations over choroidal malignant melanomas. In: Ann Ophthalmol. 1975;7, S. 487–489.
- ↑ Y. D´Souza u. a.: Ten year review of drusen-like lesions in mesangiocapillary glomerulonephritis F ii. In: IOVS. 2000;41, S. 164.
- ↑ K. Evans u. a.: Assessment of the phenotypic range seen in Doyne honeycomb retinal dystrophy. In: Arch Ophthalmol. 1997;115, S. 904–910.
- ↑ P. Polkinghorne u. a.: Sorsby´s fundus dystrophy. A clinical study. In: Ophthalmol. 1989;96, S. 1763–1768.
- ↑ The Age-Related Eye Disease Study Research Group. A randomized, placebo-controlled, clinical trial of high-dose supplementation with vitamins C and E, beta carotene, and zinc for age-related macular degeneration and vision loss: AREDS report no. 8. In: Arch Ophthalmol. 2001;119, S. 1417–1436.
Auf dieser Seite verwendete Medien
Autor/Urheber: Ipoliker, Lizenz: CC BY-SA 3.0
Fundus image of macular soft Drusen in the right eye of a 70 year old male
Autor/Urheber: Ipoliker, Lizenz: CC BY-SA 3.0
Drusen in Optical Coherence Tomography

