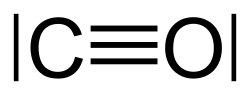Drei-Wege-Katalysator

Der Drei-Wege-Katalysator ist ein Fahrzeugkatalysator mit Lambdaregelung zur Abgasnachbehandlung in Fahrzeugen mit Ottomotor, bei dem Kohlenstoffmonoxid, Stickoxide und unverbrannte Kohlenwasserstoffe zu Kohlenstoffdioxid, Stickstoff und Wasser umgewandelt werden. Aus der gleichzeitigen Umwandlung dieser drei Luftschadstoffe ergibt sich der Name des Katalysators.
Die Zusammensetzung des Luft-Kraftstoff-Gemisches von Ottomotoren ist abhängig von der Fahrzeuggeschwindigkeit und den vorherrschenden Verkehrsbedingungen. Sie variiert zwischen einem mageren Zustand mit einem überstöchiometrischen Luftanteil und einem fetten Zustand, bei dem nicht genügend Sauerstoff für die komplette Verbrennung des Kraftstoffs vorhanden ist. Die unbehandelten Abgase von Verbrennungsmotoren mit Fremdzündung weisen beim Betrieb mit mageren Gemischen eine signifikante Konzentration an Stickoxiden auf. Beim Betrieb mit fetten Gemischen ist hingegen eine hohe Konzentration an Kohlenstoffmonoxid und Kohlenwasserstoffen vorhanden. Um einen hohen Umwandlungsgrad der Schadstoffe zu gewährleisten, wird mit Hilfe eines Regelkreises mit Lambdasonde das Verbrennungsluftverhältnis, also das Luft-Kraftstoff-Verhältnis oder die „Luftzahl“ Lambda, in einem engen Bereich, dem sogenannten Lambda-Fenster, gehalten.
In den 1970er Jahren erließen die Vereinigten Staaten, Japan sowie Europa erste gesetzliche Vorschriften zur Begrenzung der Emissionen der wichtigsten Schadstoffe. Die vorgeschriebenen Maßnahmen führten bereits zu einer deutlichen Verbesserung der Luftqualität. Die Einführung des geregelten Drei-Wege-Katalysators ermöglichte schließlich die Umwandlung eines Großteils der Schadstoffe in unschädliche Bestandteile und somit eine erhebliche Reduzierung des Schadstoffausstoßes eines Verbrennungsmotors. Zudem erforderte der Einsatz des Drei-Wege-Katalysators ein Verbot von Tetraethylblei als Kraftstoffzusatz, wodurch die Bleiemissionen im Straßenverkehr erheblich zurückgingen. Der Drei-Wege-Katalysator gilt als einer der größten Erfolge in der Geschichte des Umweltschutzes des 20. Jahrhunderts.
Geschichte
Eine Kombination verschiedener Umstände veranlasste die Kraftfahrzeughersteller gegen Ende der 1970er Jahre dazu, Drei-Wege-Katalysatoren einzuführen. Wichtige Faktoren dabei waren das wachsende Umweltbewusstsein und die kontinuierliche Verschärfung der Abgasnormen seit den 1960er Jahren. Dadurch wurde die Entwicklung und Massenproduktion von Systemkomponenten wie dem Katalysator selbst, der Lambdasonde sowie Gemischbildungssystemen und Steuereinheiten zur Einstellung des Luft-Kraftstoff-Gemischs zu einem zentralen Thema der Automobil- und Zulieferindustrie. Drei-Wege-Katalysatoren erfüllten die Abgasnormen bei einem geringeren Kraftstoffverbrauch und einer höheren Leistung als die meisten anderen Technologien zur Abgasreduzierung.[1]
Luftverschmutzung in Kalifornien

In Kalifornien und insbesondere in Los Angeles, das von Bergen umgeben ist, die den Luftaustausch behindern und Schadstoffe in der Luft zurückhalten, bestand seit Anfang der 1950er Jahre ein chronisches Luftverschmutzungsproblem. Zu jener Zeit erforschte Arie Jan Haagen-Smit vom California Institute of Technology die Entstehung von Sommersmog und wies nach, dass die Emissionen von Kraftfahrzeugen maßgeblich zu dessen photochemischer Entstehung beitragen.[2] Die Emissionen von Neuwagen lagen damals typischerweise bei 8,1 Gramm Kohlenwasserstoffen, 2,2 Gramm Stickoxiden und 54,1 Gramm Kohlenstoffmonoxid pro Kilometer.[3]
Ein wesentlicher Faktor für die Luftverschmutzung war das starke industrielle Wachstum Kaliforniens während des Zweiten Weltkriegs. Da die Wohngebiete weit von den Industriegebieten entfernt lagen und keine öffentlichen Verkehrsmittel zur Verfügung standen, benutzten die Einwohner in Gebieten wie Los Angeles hauptsächlich das Auto als Verkehrsmittel. Die intensive Nutzung führte zu einer starken Zunahme der Luftverschmutzung, die insbesondere im Einzugsgebiet von Los Angeles zu Reizungen der Augen und der Atemwege der Bevölkerung führte. Zur Bekämpfung der Luftverschmutzung durch Kraftfahrzeuge erließ Kalifornien 1960 den „Motor Vehicle Pollution Control Act“, der den Einbau von Abgasreinigungsanlagen in Fahrzeuge des Modelljahres 1968 vorschrieb.[4]
In der Folge wurden die Abgasemissionen von Kraftfahrzeugen landesweit als ernstes Problem erkannt. Das US-Department of Health, Education and Welfare begrenzte 1965 die Abgasemissionen von Neufahrzeugen ab Januar 1968 auf 2,05 Gramm Kohlenwasserstoffe und 20,5 Gramm Kohlenstoffmonoxid pro Kilometer. Forschungsgruppen von Automobilherstellern begannen, die Möglichkeiten zur Reduzierung von Emissionen zu untersuchen. Aufgrund ihrer zentralen Rolle bei der Bildung von photochemischem Smog wurden Kohlenwasserstoffe als primär zu eliminierende Schadstoffe eingestuft. Der Einsatz von Oxidationskatalysatoren wurde als ein vielversprechender Ansatz zur Reduzierung von Kohlenwasserstoffemissionen angesehen, aufgrund verschiedener motortechnischer Probleme und der Deaktivierung durch Blei wurde ihre Verwendung jedoch zunächst als nicht realistisch bewertet.[1]
Stattdessen wurden die Grenzwerte anfangs durch magere Luft-Kraftstoff-Gemische, leicht verzögerte Zündzeitpunkte sowie durch den Einbau von Kurbelgehäuseentlüftungen eingehalten. Diese reduzierten die Kohlenwasserstoffemissionen aus Kurbelgehäusen, die etwa ein Viertel der Gesamtkohlenwasserstoffemissionen ausmachten.[1]
Clean Air Act 1970

Im Jahr 1970 wurde die Environmental Protection Agency (EPA) gegründet, die damit beauftragt wurde, die Luftqualität beeinträchtigenden Emittenten zu regulieren. Dazu wurde der Clean Air Act von 1970 verabschiedet.[5] Demnach durften Fahrzeuge des Modelljahres 1975, die in den USA verkauft wurden, auf den ersten 80.500 Kilometern maximal 0,93 Gramm Kohlenwasserstoffe, 9,32 Gramm Kohlenstoffmonoxid und 1,93 Gramm Stickoxide pro Kilometer ausstoßen.
Bis zu jenem Zeitpunkt orientierten sich die Gesetze zur Luftreinhaltung an vorhandenen Technologien und schrieben Grenzwerte vor, die damit erreichbar waren. Der Clean Air Act von 1970 legte hingegen Normen für das Jahr 1975 fest, sodass die Industrie die entsprechende Technologie erst entwickeln musste, um diese einzuhalten. Führende Vertreter der Automobilindustrie bezweifelten zunächst, dass eine Reduzierung der Fahrzeugemissionen um 90 % in fünf Jahren technologisch möglich sei.[6]
Ein von studentischen Ingenieursteams des California Institute of Technology (Caltech) und des Massachusetts Institute of Technology (MIT) initiiertes Rennen, das sogenannte Clean Air Car Race, zeigte jedoch, dass die geforderten Abgaswerte bereits 1970 mit bestehender Technologie erreicht werden konnten. Das Rennen gewann ein mit einem Oxidationskatalysator und einer Abgasrückführung ausgestatteter Mercury Capri, der mit bleifreiem Benzin fuhr. Mit dieser Technologie konnten die Reduktionsziele für Kohlenstoffmonoxid und Kohlenwasserstoffen erreicht werden.[6]
Oxidationskatalysatoren
Unter der Leitung von Ed Cole übernahm General Motors (GM) ab 1970 eine führende Position bei der Senkung des Verdichtungsverhältnisses von Motoren sowie bei der Entwicklung von bleifreiem Benzin.[7] Beides waren Voraussetzungen für die Einführung von Oxidationskatalysatoren. Zwischen 1970 und 1974 investierte GM etwa 800 Millionen US-Dollar (2025: etwa 4,66 Milliarden US-Dollar) in die Forschung und Entwicklung im Bereich der Emissionskontrolle und der Katalysatorentwicklung. Zudem erwarb GM für 100 Millionen US-Dollar (entsprechend etwa 583 Millionen US-Dollar im Jahr 2025) die Rechte an der Platin- und Palladiumproduktion südafrikanischer Minen. Die Oxidationskatalysatoren wurden in einem neu errichteten Werk der AC Spark Plug Division in Oak Creek (Wisconsin), hergestellt, das im April 1974 in Betrieb genommen wurde. Dort sollten sechs Millionen Oxidationskatalysatoren pro Jahr für GM und Kunden wie die American Motors Corporation produziert werden.[8]

Die Oxidationskatalysatoren basierten auf einem von Eugene Houdry Anfang der 1950er Jahre entwickelten Oxidationskatalysator, zum Teil als Zwei-Wege-Katalysator bezeichnet, dessen aktive Komponente Platin auf Aluminiumoxidpellets war.[9] Der von GM entwickelte Konverter erzeugte einen hohen Gegendruck und die mit Edelmetall imprägnierten Pellets zerrieben sich während des Fahrbetriebs. Die Pellets konnten zwar durch Nachfüllen ersetzt werden, der Konverter war jedoch relativ groß und schwer und erwärmte sich nur langsam, was Probleme bei der Abgaskonvertierung nach einem Kaltstart verursachte.[10]
Eine bessere mechanische Belastbarkeit zeigten Fahrzeugkatalysatoren auf Basis keramischer Monolithen. Engelhard hatte in den 1960er Jahren mit der Herstellung dieser sogenannten PTX-Katalysatoren mittels Washcoat-Technologie begonnen. Diese Technologie wurde für die spätere Anwendung im Automobilbereich übernommen.[11]
General Motors stattete alle Modelle des Jahres 1975 mit Oxidationskatalysatoren aus. Dadurch stiegen die Kosten eines durchschnittlichen Autos zwar um etwa 140 US-Dollar (2025: etwa 816 US-Dollar), gleichzeitig sank der Kraftstoffverbrauch dieser Modelle im Vergleich zum Modelljahr 1974 jedoch um durchschnittlich 28,3 %. Die Verwendung von bleifreiem Benzin sollte zudem die Lebensdauer einiger Motor- und Auspuffkomponenten verlängern. Die Kraftstoffersparnis überzeugte auch die Ford Motor Company, Oxidationskatalysatoren einzusetzen.[12]
Andere Konzerne versuchten zunächst mit Konzepten wie dem Schichtladungsmotor die vorgeschriebenen Abgaswerte zu erreichen.[8] Die Standards wurden jedoch bereits für das Modelljahr 1978 auf 0,25 Gramm Kohlenwasserstoffe, 2,11 Gramm Kohlenstoffmonoxid und 0,25 Gramm Stickoxide pro Kilometer reduziert.[13] Diese Werte waren ohne den Einsatz von Oxidationskatalysatoren nicht einzuhalten. Zudem legte die EPA fest, dass bis zum 1. Juli 1974 bleifreies Benzin allgemein verfügbar sein müsse, sodass die Einführung des Oxidationskatalysators ermöglicht wurde.[14]
Für die Umwandlung von Stickoxiden stand anfangs kein wirksames Katalysatormaterial zur Verfügung. Als technische Maßnahme wurde zunächst eine partielle Rückführung des an Wasser, Stickstoff und Kohlenstoffdioxid reichen Abgases in den Ansaugtrakt des Motors durchgeführt. Dadurch wurde die Wärmekapazität des Gasgemischs erhöht und die Verbrennungstemperatur gesenkt und damit die Bildung von Stickoxiden verringert.[15]
Dual-Bed-Systeme

Die Einhaltung der ersten Standards für Stickoxidemissionen war noch durch rein motortechnische Einstellungen möglich. Die Abgasrückführung senkte die Stickoxidemissionen zwar um etwa 30 %, wirkte sich jedoch negativ auf die Motorleistung aus. Eine Verbesserung boten Katalysatoren der zweiten Generation, sogenannte Dual-Bed-Systeme. Diese bestanden aus zwei verschiedenen Arten von Katalysatoren, die hintereinander installiert wurden. Um die Reduktion der Stickoxide zu gewährleisten, wurde der Verbrennungsmotor mit einem Kraftstoffüberschuss betrieben. Dies vereinfachte das Motormanagement, führte jedoch zu einer niedrigeren Kraftstoffeffizienz.[17]
Die Umsetzung der Stickoxide erfolgte in einem ersten Katalysator in einer durch den Kraftstoffüberschuss reduzierenden Atmosphäre. Hinter diesem wurde zusätzliche Verbrennungsluft injiziert, sodass die Oxidation von Kohlenstoffmonoxid und Kohlenwasserstoffen über den zweiten Katalysator erfolgen konnte.[16]
Es wurden verschiedene Materialien als katalytisch aktive Komponenten für den Reduktionskatalysator getestet, darunter Monel und Ruthenium. Bei Temperaturen ab 700 °C reduzierte Monel, eine Nickel-Kupfer-Legierung, die durch einen vorgeschalteten Sauerstoffwäscher geschützt wurde, den Stickstoffmonoxidausstoß unter reduzierenden Bedingungen um 90 %. Temperaturen über 900 °C oder Spuren von Blei im Benzin verringerten die katalytische Aktivität jedoch schnell.[16]
Katalysatoren auf Ruthenium-Basis zeigten eine gute Aktivität bei der Reduktion von Stickstoffmonoxid mit geringer Selektivität zur Bildung von Ammoniak. Dies war insofern wichtig, als dass das gebildete Ammoniak im zweiten Katalysator eines Dual-Bed-Systems wieder zu Stickoxiden oxidiert wurde.[17]
Nach einem Kaltstart wurde Luft vor dem Reduktionskatalysator dosiert, um die Katalysatoren durch die Verbrennung von Kohlenwasserstoffen und Kohlenstoffmonoxid schnell auf Betriebstemperatur zu bringen. Der Reduktionskatalysator war daher wiederholt einer oxidierenden Umgebung ausgesetzt. Ruthenium bildet bei höheren Temperaturen in einer oxidierenden Umgebung jedoch das flüchtige Ruthenium(VIII)-oxid, was zum Verlust von Ruthenium und damit zu einer Deaktivierung des Katalysators führte.[17]
Entwicklung des Drei-Wege-Katalysators

Technologien wie das Dual-Bed-System, der Oxidationskatalysator mit Abgasrückführung oder Chryslers Lean-Burn-Motoren wiesen eine Vielzahl von Nachteilen auf. Dazu zählten entweder ein erhöhter Kraftstoffverbrauch oder eine verschlechterte Motorleistung. Darüber hinaus erfüllten sie die schnell schärfer werdenden Vorgaben nicht oder nur zum Teil.[18]
Die Vorschriften zur Reduktion von Stickoxiden wurden 1980 weiter verschärft. Da Abgasrückführungssysteme die geforderte Reduktion um 90 % nicht erreichten, wurde nach einer anderen Methode gesucht. Dabei erwies sich Rhodium als effektiver Reduktionskatalysator für Stickoxide. Platin und Palladium wiederum zeigten die beste Wirkung bei der Oxidation von Kohlenstoffmonoxid und Kohlenwasserstoffen.[15]
Eine Herausforderung bei der Konvertierung von Autoabgasen war der diskontinuierliche und instationäre Betrieb von Kraftfahrzeugen. Während industrielle katalytische Verfahren kontinuierlich und im stationären Zustand ablaufen, kommt es beim Drei-Wege-Katalysator in Abhängigkeit von den Fahrbedingungen zu erheblichen Schwankungen der Raumgeschwindigkeit, der Temperatur und der Zusammensetzung des Abgases.[19]
Versuche zeigten, dass ein stöchiometrisches Kraftstoffgemisch die Voraussetzung für die gleichzeitige katalytische Umwandlung der drei Hauptschadstoffe ist. Die Kontrolle des Luft-Kraftstoff-Verhältnisses war jedoch unter normalen Fahrbedingungen schwierig. Schwankungen der Luftzusammensetzung, der Kraftstoffqualität sowie des Motorzustands und Einbauten wie Turbolader oder Luftfilter erschwerten die Einstellung eines stöchiometrischen Verhältnisses. Dafür waren eine Sauerstoffsonde sowie eine Elektronik mit geschlossenem Regelkreis zur Steuerung der Luft-Kraftstoff-Dosierung erforderlich. Die ersten Untersuchungen des Drei-Wege-Katalysators in dieser Konfiguration begannen 1974 mit einem Volvo-B21-Motor, der mit einer K-Jetronic-Saugrohreinspritzung und einem Sauerstoffsensor ausgestattet war.[20]

Der Durchbruch gelang schließlich John J. Mooney und Carl D. Keith mit der Entwicklung des Drei-Wege-Katalysators auf Basis Platin/Rhodium.[21] Für dessen Erfindung, Anwendung und Kommerzialisierung wurden die beiden Wissenschaftler mit der National Medal of Technology and Innovation ausgezeichnet.[22][23] Mitarbeiter der Ford Motor Company berichteten 1976 erstmals über den Einsatz von Ceroxiden als Sauerstoffspeicherkomponente. Die Eigenschaften von Ceroxiden bezüglich der Speicherung und Freisetzung von Sauerstoff in der Abgaskatalyse erweitern das operative Luft-Kraftstoff-Fenster eines Drei-Wege-Katalysators deutlich.[24]
Volvo, das als technologisch innovatives Unternehmen galt, verkaufte 1976 die ersten Fahrzeuge aus der Volvo-240-Serie mit Drei-Wege-Katalysator in Kalifornien. Diese Modelle waren mit B21-Motoren ausgestattet und erfüllten die geltenden Abgasnormen. Erst nachdem Volvo und Saab die Technologie bereits eingeführt hatten, folgten 1977 schließlich auch Ford und General Motors und statteten in begrenzter Stückzahl Fahrzeuge mit Drei-Wege-Katalysator für den kalifornischen Markt aus.[1]
Europäische Regelungen
Im September 1984 beschloss die Bundesregierung Deutschlands die Einführung des Katalysators für alle Fahrzeuge mit Ottomotor, der ab dem 1. Januar 1989 für alle neu zugelassenen Fahrzeuge Pflicht wurde. Gleichzeitig wurde bleifreies Benzin eingeführt.[25] In der Europäischen Union wurde der geregelte Drei-Wege-Katalysator für Neuwagen mit Ottomotor zum 1. Januar 1993 mit Einführung der Euro-1-Norm verpflichtend. Diese Regelung galt für alle neu zugelassenen Fahrzeuge dieser Kategorie ab diesem Datum. Es wurden Grenzwerte für den Ausstoß von Kohlenstoffmonoxid sowie ein Summenparameter für Stickoxide und Kohlenwasserstoffe festgelegt. Sie wurde durch die Euro-2-Norm abgelöst, die für Neufahrzeuge ab dem 1. Januar 1997 galt. Die Norm forderte eine Reduzierung der Kohlenstoffmonoxidkonzentration von 2720 auf 2200 Milligramm pro Kilometer und eine Reduzierung der Kohlenwasserstoffe und Stickoxide von 970 auf 500 Milligramm pro Kilometer.[26]
Parallel zur Verschärfung der Abgasvorschriften führte die EU auch strengere Kraftstoffvorschriften ein. Dazu gehörte neben der Eliminierung von Tetraethylblei die schrittweise Senkung des Schwefelgehalts von maximal 150 ppm im Jahr 2000 auf 50 ppm im Jahr 2005 und ab 2009 auf „schwefelfreies“ Motorenbenzin mit weniger als 10 ppm Schwefel.[27]
Wie bereits bei der Einführung der strengeren Abgasnormen in den USA setzten europäische Hersteller zunächst auf motortechnische Modifikationen, um die neuen Grenzwerte zu erreichen. Dazu zählten ein verzögerter Zündzeitpunkt, eine Abgasrückführung oder eine Nachverbrennung der Abgase mittels Pulsair-Systemen. Zwar konnten mit diesen Maßnahmen Schadstoffe im Abgas teilweise eliminiert werden, gleichzeitig sank jedoch die Leistung und der Verbrauch stieg. VW bot Pakete zur Nachrüstung mit Katalysator und Lambdasonde an. Der Katalysator konnte nachgerüstet werden, sobald ausreichend bleifreies Benzin verfügbar war.[28]
Weitere Entwicklungen
Im Jahr 1988 führte der Bundesstaat Kalifornien die Pflicht ein, dass Autos mit einem On-Board-Diagnosesystem der ersten Generation ausgestattet werden, das etwa die Sekundärluftzufuhr überwachte. Im Jahr 1994 erfolgte die Einführung von Systemen der zweiten Generation (OBD II). Diese Systeme dienen der Überwachung des Katalysators, der Lambdasonde sowie von Motorfehlzündungen.[29] Die europäischen Vorschriften für On-Board-Diagnosesysteme (EOBD) entsprechen den OBD-II-Vorschriften und galten ab dem 1. Januar 2001 für alle Personenkraftwagen der Klasse M1.[30]
In den 1990er Jahren kamen vermehrt trimetallische Katalysatoren auf Basis von Platin, Palladium und Rhodium zum Einsatz. Katalysatoren mit einem relativ hohen Palladiumgehalt wiesen eine verbesserte Selektivität der Kohlenwasserstoffkonvertierung auf, wie sie die neuen Emissionsstandards erforderten. Zudem zeichneten sich die trimetallischen Katalysatoren durch eine gute Alterungsstabilität aus.[31]
Entwicklung der Fahrzeugemissionen

Nach einer Studie der Environmental Protection Agency (EPA) sanken zwischen 1970 und 1990 durch den Einbau von Autoabgaskatalysatoren in Neuwagen die Emissionen von Stickoxiden um 30 %, die Emissionen von flüchtigen organischen Verbindungen um 45 % und die Kohlenstoffmonoxidemissionen um 50 %.[33] Die Einführung des Drei-Wege-Katalysators führte in Kalifornien zu einem Rückgang der Smogalarmtage. Im Jahr 1994 wurde in Los Angeles an 23 Tagen die Alarmstufe 1 ausgerufen, gegenüber 121 Tagen im Jahr 1977.[34] Die Konzentration der flüchtigen organischen Verbindungen in der Luft im Raum Los Angeles reduzierte sich von etwa 100 parts per billion im Jahr 1960 auf 2 ppb im Jahr 2010, bei einem mehr als 2,5-fachen Anstieg des Kraftstoffverbrauchs im selben Zeitraum.[32]
Im Jahr 2023 waren in der EU etwa 256 Millionen Personenkraftwagen zugelassen, davon 49 Millionen in Deutschland. In Deutschland lag der Anteil der mit Ottomotor betriebenen Fahrzeuge bei 56,3 %.[35] In den USA waren 2020 286,9 Millionen Autos zugelassen, davon etwa 97 % Benziner.[36][37] Im Jahr 2020 waren mehr als 96 % der produzierten Autos mit Drei-Wege-Katalysatoren ausgerüstet. Nach Schätzungen wurden zwischen 1975 und 2020 mit Drei-Wege-Katalysatoren mehr als 12 Milliarden Tonnen Autoabgase konvertiert.[38]
Katalytische Umsetzung
Rohemissionen
Kohlenwasserstoffe

In einem Ottomotor werden die Kohlenwasserstoffe des Motorenbenzins mit Luftsauerstoff verbrannt. Bei einer vollständigen Verbrennung würden dabei nur Kohlenstoffdioxid, Wasser und Wärme entstehen. Unter Fahrbedingungen erfolgt nur eine unvollständige Verbrennung der Kohlenwasserstoffe, zum Teil werden der Luftstickstoff sowie die Schwefelbestandteile des Kraftstoffs oxidiert. Daher finden sich in den Motorabgasen neben Kohlenstoffdioxid und Wasser auch Kohlenstoffmonoxid, nur teilweise oder unverbrannte Kohlenwasserstoffe, Stickoxide, Schwefeldioxid, Wasserstoff und Feinstaub.[39] Die Emission von nicht-konvertierten Autoabgasen hat eine Vielzahl direkter oder indirekter negativer Auswirkungen auf die Gesundheit und die Umwelt.
Bei den Kohlenwasserstoffen handelt es sich um unverbrannten Kraftstoff sowie teilweise oxidierte Produkte wie Aldehyde, Ketone und Carbonsäuren. Diese werden in diesem Zusammenhang ebenfalls als Kohlenwasserstoffe bezeichnet. Kohlenwasserstoffe tragen wesentlich zur Entstehung von Sommersmog bei. Ein entscheidender Faktor war die Benzinherstellung mittels des von Eugene Houdry entwickelten Verfahrens des katalytischen Crackens. Nach der Inbetriebnahme des Verfahrens im Jahr 1937 stieg der Olefinanteil im Benzin in den Folgejahren rasch an und betrug etwa 20 %. Die reaktionsträgeren n-Paraffine wurden durch den Crackprozess durch Olefine und verzweigtkettige Paraffine ersetzt, und deren Rohemissionen sind für die Entstehung von Smog mitverantwortlich.[40][41]
Neben der Motortechnik und dem Luft-Kraftstoff-Verhältnis wird die Beschaffenheit der Kohlenwasserstoffemissionen von der Zusammensetzung des Benzins beeinflusst. Dabei korreliert der Anteil der Aromaten in den Emissionen mit der Aromatenkonzentration im Kraftstoff. Aufgrund der Dealkylierung höherer Alkylaromaten kann die Benzol- und Toluolkonzentration im Abgas teilweise höher sein als im Kraftstoff. Der Anteil der Olefine im Abgas ist direkt proportional zur Summe der Olefine und Paraffine im Kraftstoff.[42] Kohlenwasserstoff- und Stickoxidemissionen führen über photochemische Reaktionen zur Bildung von Sekundärschadstoffen wie Ozon, freien Kohlenwasserstoffradikalen und Peroxyacetylnitrat.[43]
Stickoxide
Stickoxide entstehen im größeren Maße ab Temperaturen von etwa 1500 °C durch die Oxidation von Stickstoff mit Sauerstoff. Stickoxide tragen ebenfalls zur Bildung von Smog und saurem Regen bei und umfassen Stickstoffmonoxid und Stickstoffdioxid. Letzteres steht im Gleichgewicht mit seinem Dimeren. Dieses ist sehr reaktiv und reagiert an der Luft mit Wasser zu Salpetersäure (HNO3) und salpetriger Säure (HNO2):[44]
Weiterhin zerfällt es zu Stickstoffmonoxid und atomarem Sauerstoff, der wiederum mit molekularem Sauerstoff zu Ozon (O3) reagiert:[45]
Kohlenstoffmonoxid
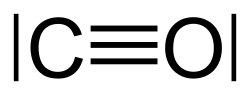
Kohlenstoffmonoxid ist das Produkt einer unvollständigen Verbrennung sowie der Umsetzung von Kohlenwasserstoffen bei hoher Temperatur mit Wasser.[46] Seine atmosphärische Halbwertszeit beträgt ein bis zwei Monate.[47]
Eingeatmetes Kohlenstoffmonoxid bindet sich an Hämoglobin und vermindert die Fähigkeit des Blutes, Sauerstoff zu transportieren. Eine Kohlenmonoxidvergiftung kann tödlich sein. Eine erhöhte Sterblichkeitsrate wird mit der Exposition gegenüber höheren Konzentrationen in der Nähe stark befahrener Straßen, im Berufsverkehr oder in Tunneln in Verbindung gebracht.[48]
Partikel und Schwefeldioxidemissionen
Die Motorentechnik ist ein wichtiger Einflussfaktor in Bezug auf die Partikelemissionen von Ottomotoren, da sie eine Schlüsselrolle bei der Vermischung und Verbrennung von Benzin und Luft spielt. Während herkömmliche Benzinmotoren als weitgehend unproblematisch gelten, erzeugt die Verbrennung in Motoren mit Benzindirekteinspritzung (GDI) Partikel. Darüber hinaus beeinflussen auch die Eigenschaften des Kraftstoffs, die Fahrbedingungen, die Umgebungstemperatur und weitere Parameter die Partikelemissionen.[49]
Schwefeldioxid entsteht bei der Verbrennung von schwefelhaltigen Bestandteilen des Kraftstoffs. Weder Partikel- noch Schwefeldioxidemissionen werden durch den Drei-Wege-Katalysator eliminiert. Dazu bedarf es einer separaten Abgasreinigungstechnik für Partikel, der Schwefeldioxidausstoß wird über die Begrenzung des Schwefels im Kraftstoff limitiert.[50] Kraftstoffe mit weniger als 10 Milligramm pro Liter Schwefel gelten als schwefelfrei.[51]
Konvertierung
Lambdaregelung

Es zeigte sich in Versuchen, dass die gleichzeitige Umwandlung aller Schadstoffe mit einem Drei-Wege-Katalysator gelingt, sofern ein stöchiometrisches Kraftstoffgemisch am Katalysatoreingang im Fahrbetrieb beibehalten werden kann. Das Verbrennungsluftverhältnis setzt das aktuelle Luft-zu-Kraftstoffverhältnis (Air-to-fuel-ratio, A/F) ins Verhältnis zum idealen Luft-Kraftstoffverhältnis , bei dem eine stöchiometrisch vollständige Verbrennung theoretisch möglich ist:
Der stöchiometrische Punkt λ = 1 gibt die Luftmenge an, die erforderlich ist, um den gesamten Kraftstoff zu Kohlenstoffdioxid und Wasser zu oxidieren. Er liegt für Benzin bei einem Massenverhältnis von etwa 14,6.

Lambdasonden sind ein wesentlicher Bestandteil moderner elektronischer Kraftstoffeinspritz- und Emissionskontrollsysteme. Sie ermöglichen die Echtzeit-Überwachung des Luft-Kraftstoff-Verhältnisses in Verbrennungsmotoren und sorgen so für optimale Leistung und Abgaszusammensetzung.
Die Sonden befinden sich im Abgasstrom und ermöglichen eine indirekte Messung des Luft-Kraftstoff-Verhältnisses. Dies ermöglicht eine präzise Steuerung der Kraftstoffeinspritzung, wobei die Kraftstoffeinspritzung die Einspritzmenge entsprechend den Sensordaten in Echtzeit variiert. Anstatt die tatsächliche Sauerstoffkonzentration zu messen, misst der Sensor die Differenz zwischen der Sauerstoffmenge im Abgas und der Sauerstoffmenge in der Luft.
Bei einer Abweichung vom stöchiometrischen Luft-Kraftstoff-Verhältnis () hin zu „magerem“ Gemisch (Luftüberschuss, ) werden nicht alle Stickoxide abgebaut, da die benötigten Reduktionsmittel schon vorher oxidiert werden. Bei „fettem“ Gemisch (Luftmangel, ) werden nicht alle Kohlenwasserstoffe und Kohlenstoffmonoxid abgebaut. Im Fahrbetrieb schwanken die Werte für das Luft-Kraftstoff-Gemisch ein- bis dreimal pro Sekunde um den stöchiometrischen Mittelwert.[53]
Daher ist entweder zu viel oder zu wenig Sauerstoff für die Umsetzung aller Schadstoffkomponenten vorhanden. Durch die Verwendung einer Sauerstoffspeicherkomponente wie Ceroxid lässt sich dieses Problem jedoch lösen.[54] Eine kurzzeitige Abweichung kann durch den Sauerstoffspeicher abgefangen werden. Cer(IV)-oxid wird als Sauerstoffspeicherkomponente eingesetzt und stellt im fetten Bereich Sauerstoff gemäß folgender Gleichung zur Verfügung:
Im Sauerstoffüberschuss bildet sich wieder die Ausgangskomponente:
Katalytische Reaktionen
Die Schadstoffe Kohlenstoffmonoxid, unverbrannte Kohlenwasserstoffe und Stickoxide werden nach folgenden Gleichungen aus dem Abgas entfernt:
Kohlenstoffmonoxid wird mit Luftsauerstoff zu Kohlenstoffdioxid oxidiert, Kohlenwasserstoffe zu Kohlenstoffdioxid und Wasser. Kohlenstoffmonoxid dient zugleich als Reduktionsmittel für Stickoxide.
Das kinetische Modell für die Oxidation von Kohlenstoffmonoxid auf Platin basiert auf der Langmuir-Isotherme, aus der sich die Langmuir-Hinshelwood-Kinetik ableiten lässt. Die Oxidation von Kohlenstoffmonoxid besteht aus den Schritten: Adsorption von Kohlenstoffmonoxid, dissoziative Adsorption von Sauerstoff, Reaktion der beiden adsorbierten Spezies an der Katalysatoroberfläche und Desorption des gebildeten Kohlenstoffdioxids.[55]
Für die Dissoziation von Sauerstoff sind benachbarte freie Oberflächenplätze erforderlich. Sobald die Bedeckung mit Kohlenstoffmonoxid einen bestimmten Wert überschreitet, fehlen diese benachbarten Oberflächenplätze, sodass die Adsorption von Sauerstoff gehemmt wird. Bei einer Bedeckung mit Sauerstoff hingegen kann die Adsorption von Kohlenstoffmonoxid weiterhin stattfinden. Aufgrund des unterschiedlichen Adsorptionsverhaltens der beiden Gase kommt es unter stationären Bedingungen zu einer vollständigen Bedeckung der Oberfläche durch adsorbiertes Kohlenstoffmonoxid.[56]
Dadurch wird die Sauerstoffadsorption gehemmt und die katalytische Oxidationsreaktion kann nicht stattfinden. Erst bei einer ausreichend hohen Temperatur findet eine Teildesorption des adsorbierten Kohlenstoffmonoxids statt, wodurch wieder eine Sauerstoffadsorption ermöglicht wird. Dies ist der Grund, warum die katalytische Umsetzung im Drei-Wege-Katalysator nur oberhalb der sogenannten Anspring- oder light-off-Temperatur stattfindet.[56] Diese liegt bei etwa 250–300 °C.[57] Um diese schnell zu erreichen wird nach dem Start die Leerlauf-Drehzahl erhöht und der Motor mit spätem Zündwinkel und zusätzlichen Nacheinspritzungen zur Erhöhung der Abgastemperatur betrieben. Für eine gute katalytische Umsetzung der Abgase sollte das Volumen des Drei-Wege-Katalysators etwa dem Hubraum des Motors entsprechen. Die entsprechende Verweilzeit des Gases im Katalysator beträgt dann je nach Motordrehzahl etwa 0,08 bis 0,03 Sekunden, was für eine vollständige katalytische Umsetzung der Schadstoffe bei den entsprechenden Temperaturen ausreichend ist.[58]
Die Reduktion von Stickmonoxid erfolgt über die Adsorption an der Rhodiumoberfläche, gefolgt vom Zerfall in adsorbierten Sauerstoff und Stickstoff. Der adsorbierte atomare Stickstoff reagiert unter Bildung von freiem Stickstoffgas, welches desorbiert. Im nächsten Schritt reagiert der adsorbierte atomare Sauerstoff mit ebenfalls adsorbiertem Kohlenstoffmonoxid unter Bildung von Kohlenstoffdioxid, das ebenfalls desorbiert. Dadurch entsteht eine freie Rhodiumoberfläche.
Die Reaktionsgeschwindigkeiten der Kohlenstoffmonoxidoxidation und der Stickoxidreduktion sind verschieden. Wenn das Kohlenstoffmonoxid zu schnell oxidiert wird, steht es als Reduktionsmittel für die Stickoxidreduktion nicht mehr in vollem Umfang zur Verfügung. Dies führte zur Entwicklung von Double-Layer-Katalysatoren, bei denen zunächst eine platin- oder palladiumhaltige Washcoatschicht als Oxidationskatalysator aufgetragen wird, und danach als obere Schicht eine rhodiumhaltige Washcoatschicht als Stickoxid-Reduktionskatalysator. Bei der Diffusion durch die obere rhodiumhaltige Schicht steht noch genügend Kohlenstoffmonoxid zur Verfügung, um eine vollständige Reduktion der Stickoxide zu gewährleisten, bevor es in der unteren Schicht zu einer Oxidation kommt.[59]
Wegen der Abgasnachbehandlung muss darauf verzichtet werden, zur Verbesserung des Kraftstoffverbrauchs in bestimmten Bereichen des Motorbetriebes mit magerem Gemisch zu fahren. Bei älteren Modellen wurde im fetten Bereich außerdem auf dem Katalysator adsorbiertes Sulfat zu Schwefelwasserstoff reduziert und verursachte einen unangenehmen Geruch nach faulen Eiern.
Durch eine weitere Nebenreaktion kann im Katalysator Ammoniak gebildet werden. Kraftfahrzeuge mit Katalysator stoßen etwa 14 Milligramm Ammoniak je gefahrenem Kilometer aus.[60]
Der Wasserstoff der Reaktion stammt aus der Wassergas-Shift-Reaktion zwischen Kohlenstoffmonoxid und Wasser, die als Nebenreaktion abläuft.
Herstellung
Substrate
Keramische Substrate
- Keramische Substrate
- Verleihung der National Medal of Technology and Innovation an Ronald M. Lewis, Irwin Lachman und Rodney Bagley durch US-Präsident George W. Bush (v. l. n. r.)
Ein Drei-Wege-Katalysator besteht aus einem keramischen Wabenkörper aus Cordierit (2 MgO · 2 Al2O3 · 5 SiO2), einem feuerfesten Magnesium-Aluminium-Silikat mit geringer Wärmeleitfähigkeit und Wärmeausdehnung, oder aus einem metallischen Träger, auf den ein sogenannter Washcoat aufgebracht ist. Nachdem zunächst gebohrte keramische Substrate verwendet wurden, entwickelten Rodney Bagley, Irwin Lachman und Ronald Lewis bei Corning Glass den stranggepressten keramischen Monolithen. Für diese Erfindung wurden sie 2002 in die „National Inventors Hall of Fame“ der USA aufgenommen.[61] Präsident George W. Bush verlieh ihnen 2003 die National Medal of Technology and Innovation.[62]
Die geringe Wärmeausdehnung, die sich aus der bevorzugten Ausrichtung der anisotropen Cordierit-Kristalle während der Extrusion ergibt, ermöglicht eine hohe Arbeitstemperatur und gewährleistet eine ausgezeichnete Thermoschock- oder Temperaturwechselbeständigkeit. Die Porosität des Materials ermöglicht das Auftragen eines katalytisch aktiven Washcoats.[63]
Die keramischen Monolithe haben je nach Kanalgröße eine geometrische Oberfläche von etwa einem bis fünf Quadratmetern pro Liter Katalysatorvolumen. Keramische Substrate weisen typischerweise 64 quadratische Zellen pro Quadratzentimeter auf. Die Wandstärke des Cordierits beträgt etwa 0,11 bis 0,17 Millimeter.[64] Die Anzahl der Zellen sowie die Wandstärke können jedoch variieren. Die Größe des Substrats wird so gewählt, dass der hydraulische Durchmesser der Kanäle dem Durchmesser des Abgasrohres entspricht. Dadurch wird der Gegendruck verringert, so dass die Motorleistung nicht negativ beeinflusst wird. Die Form der Substrate kann rund, oval, dreieckig oder quadratisch sein.[65]
Metallsubstrate

Metallsubstrate werden aus dünnen, abwechselnd glatten und gewellten, spiralförmig gewickelten Metallfolien hergestellt. Sie bestehen aus ferritischen Chromstählen mit einem hohen Aluminiumanteil und Zusätzen von Hafnium und Ytterbium, die für das Aufbringen des Washcoats erforderlich sind.[66] Zudem muss der Stahl hitzebeständig sein, da die Anwendungstemperaturen über 1100 °C liegen können. Die Dicke der Metallfolien beträgt etwa 0,04 Millimeter, die Untergrenze liegt bei etwa 0,025 Millimetern. Die Folien werden durch ein hochtemperaturfestes Lötverfahren miteinander verbunden, das die Ausspiralisierung der Folien verhindert.[64]
Keramikmonolithen werden eher motorfern eingebaut, da sie den hohen mechanischen Belastungen beim motornahen Einbau nicht standhalten. Nach einem Kaltstart kühlt das Abgas auf dem Weg zum Katalysator zunächst ab, sodass die für die katalytische Umwandlung der Schadstoffe notwendige Temperatur erst nach einer gewissen Zeit erreicht wird. Die Abgase enthalten daher in den ersten Betriebsminuten einen hohen Anteil an Schadstoffen, da sie den Katalysator ohne Umwandlung durchströmen. Drei-Wege-Katalysatoren auf Basis von Metallsubstraten erlauben einen motornahen Einbau und tragen damit zur Reduzierung der Kaltstartemissionen bei, da sich das Abgas auf dem Weg zum Katalysator kaum abkühlt und daher den Katalysator schneller auf Betriebstemperatur bringt.[64]
Washcoat

Der Washcoat besteht aus einer Slurry verschiedener Metalloxide wie γ-Aluminiumoxid, Zirconiumdioxid und Cerdioxid, die in einer sauren wässrigen Lösung suspendiert sind. Diese stellen die Trägersubstanzen für die katalytisch aktiven Edelmetalle wie Platin, Palladium und Rhodium dar, Cerdioxid, gegebenenfalls stabilisiert durch die Zugabe von Zirconiumdioxid, dient sowohl als Trägersubstanz als auch als Sauerstoffspeicherkomponente. Für die Herstellung von Drei-Wege-Katalysatoren wurden im Jahr 2018 etwa 360 Tonnen Platinmetalle verwendet.[67] Die Dicke des getrockneten und calcinierten Washcoats auf dem Träger beträgt etwa 0,05 bis 0,12 Millimeter.[15]
Edelmetalle
Ein Standardkatalysator enthält etwa 50 Gramm der Edelmetalle Platin und Rhodium pro Kubikfuß Katalysatorvolumen (etwa 28,31 Liter) im Verhältnis von Platin : Rhodium von 5 : 1. Ein typischer Platin-Palladium-Rhodium-Katalysator weist eine Edelmetallbeladung von etwa 95 Gramm pro Kubikfuß auf, mit einem Verhältnis von Platin : Palladium : Rhodium von etwa 1 : 14 : 1. Die Edelmetallbeladung und das Verhältnis der Edelmetalle können jedoch je nach Katalysatortyp erheblich variieren.[68]
Die Imprägnierung des Trägermaterials kann als trockene Imprägnierung oder diffusionskontrollierte Imprägnierung erfolgen. Bei der trockenen Imprägnierung werden die Edelmetallsalze in einer wässrigen Lösung, die dem Porenvolumen des Trägermaterials entspricht, diesem zugeführt. Bei der diffusionskontrollierten Imprägnierung wird ein Metallsalz im Lösungsmittelüberschuss verwendet, dass eine dem Träger entgegengesetzte Ladung aufweist. In alkalischen Lösungen ist die Oberflächenladung von Aluminiumoxid negativ, so dass die diffusionskontrollierte Imprägnierung mit Kationen wie Hexamminplatinsalzen (Pt(NH3)2+) erfolgen kann. In saurer Lösung ist die Oberflächenladung dagegen positiv, die Imprägnierung erfolgt dann mit Anionen wie Hexachloroplatinate (PtCl62−).[69]
Aluminiumoxid
Aluminiumoxid ist das bei weitem am häufigsten verwendete Trägermaterial für die in Drei-Wege-Katalysatoren eingesetzten Edelmetalle. Je nach Herkunft weist es unterschiedliche innere Oberflächen, Porengrößenverteilungen und andere Eigenschaften auf. Diese sind abhängig von der Herstellung, der Reinheit und der thermischen Vorgeschichte. Durch die Kalzinierung von Aluminiumhydroxiden entsteht bis zu Temperaturen von 800 °C γ-Aluminiumoxid, das bei höheren Temperaturen in δ-, θ- und bei etwa 1100 °C in α-Aluminiumoxid übergeht. Da die innere Oberfläche mit steigender Temperatur abnimmt, werden dem Aluminiumoxid verschiedene Seltenerd- und Erdalkalistabilisatoren wie Lanthan- oder Bariumoxid zugesetzt. Ebenfalls stabilisierend wirkt Ceroxid. Die Stabilisatoren erhöhen die thermische Stabilität von Aluminiumoxid, indem sie dessen Umwandlung von der γ- in die α-Phase hemmen.[70]
Cer- und Zirconiumoxide
Ceroxid und feste Ceroxid-Zirconiumoxid-Mischkristalllösungen übernehmen vielfältige Aufgaben in einem Drei-Wege-Katalysator. Zur Herstellung der festen Lösungen werden Cer- und Zirkoniumsalze, beispielsweise Cer(III)-nitrat (Ce(NO3)3), Cer(III)-chlorid (CeCl3) oder Cer(III)-acetat (Ce(CH3CO2)3) sowie die entsprechenden Nitrate, Chloride und Acetate des Zirconiums verwendet. Die Salze werden in Wasser gelöst und durch Zugabe eines alkalischen Fällungsmittels, wie einer Ammoniaklösung, gemeinsam ausgefällt. Durch anschließende Trocknung und Kalzinierung entsteht die entsprechenden feste Lösung der beiden Oxide.[71]
Ihre Hauptaufgabe besteht darin, als Sauerstoffpuffer zu fungieren und das Lambdafenster zu erweitern, in dem der Katalysator alle drei Schadstoffe gleichzeitig konvertieren kann. In Mischkristalllösungen hemmt Zirconiumdioxid unter anderem die Bildung von Ceraluminat (CeAlO3), das über keine Sauerstoffspeicherkapazität verfügt. Zudem weisen die Mischkristalle eine höhere Sauerstoffspeicherkapazität als reines Ceroxid auf. Dies wird mit der hohen Reduzierbarkeit von Cer(IV) in zirconiumdotiertem Ceroxid in Verbindung gebracht. Sie ist eine Folge der hohen Sauerstoffbeweglichkeit innerhalb des Gitters. Grund hierfür ist die Defektstruktur und Gitterspannung, die durch die Einführung des kleineren, isovalenten Zirconium(IV)-Kations in das Cerdioxid-Gitter entsteht. Der Ionenradius von Zirconium(IV) beträgt bei einer achtfachen Koordination 0,084 Nanometer und ist damit etwa 15 % kleiner als der von Cer(IV), der 0,097 Nanometer beträgt.[72][73]
Zudem verbessern Ceroxide die Edelmetalldispersion und erhöhen die thermische Stabilität von Aluminiumoxid, indem sie dessen Umwandlung von der γ- in die α-Phase hemmen. Darüber hinaus fördern sie die Wassergas-Shift-Reaktion, die Kohlenstoffmonoxidoxidation und die Dampfreformierungsreaktionen.[73]
Beschichtung, Trocknung, Kalzinierung
Zur Herstellung des Katalysators wird zunächst eine saure Metalloxidsuspension hergestellt. Diese kann durch verschiedene Verfahren auf den Cordieritträger aufgebracht werden. Im einfachsten Fall wird der Wabenkörper in die Suspension getaucht. Die überschüssige Suspension wird ausgeblasen. In den feinen Kanälen des Wabenkörpers befindet sich dann eine dünne Schicht eines Metalloxid-Gemisches. Im nächsten Schritt wird diese Schicht mit Edelmetallsalzlösungen getränkt.[74] Der beschichtete Wabenkörper anschließend bei etwa 110 °C getrocknet und bei etwa 400 bis 500 °C kalziniert. Durch weitere Trocknung und Kalzinierung werden die Edelmetalle auf dem Träger fixiert. Alternativ können die Edelmetalle bereits vor der Beschichtung des Cordieritträgers auf den Metalloxiden imprägniert werden.[59]
Canning

Für den Einbau im Fahrzeug wird der beschichtete Cordierit-Wabenkörper in ein Blechgehäuse eingeschweißt. Dieses Verfahren wird als Canning (englisch für ‚Eindosen‘) bezeichnet. Um eine Beschädigung eines keramischen Monolithen durch mechanische Einwirkungen wie Vibrationen oder Stöße zu vermeiden, wird eine keramische oder Mineralfasermatte zwischen dem Monolithen und dem Metallgehäuse angebracht. Die Matte gleicht zudem die unterschiedliche Wärmeausdehnung des Monolithen und dem Metallgehäuse aus und verhindert, dass nicht umgesetzte Abgase zwischen dem Monolithen und dem Metallgehäuse vorbeiströmen. Dabei werden sowohl intumeszente Isoliermatten, die sich bei Erwärmung in Richtung der Dicke ausdehnen und dazu beitragen, den Montagedruck aufrechtzuerhalten, als auch nicht-intumeszente Isoliermatten verwendet.[75]
Die Matte isoliert zudem den Katalysator und verhindert Wärmeverluste, die die katalytische Umsetzung beeinträchtigen könnten. Fast alle verwendeten Stützmatten bestehen aus Aluminiumsilikatfasern, etwa Vermiculit. Die Form des Substrats hat Einfluss auf seine Stabilität, wobei runde Formen die größte und sogenannte „Racetrack“-Formen die niedrigste Bruchsicherheit aufweisen.[76]
Zum Canning gehört die Verwendung der geeigneten Ein- und Auslasstrichter, die für eine optimale Anströmung des Monolithen sorgen. Anschließend wird der eingepackte Katalysator in das Abgassystem eingeschweißt und mit Sensoren ausgestattet.[61] Metallische Träger können direkt in den Abgasstrang eingeschweißt werden.
Funktionstest
Alterung

Wichtige technische Merkmale eines Drei-Wege-Katalysators sind neben der chemischen Zusammensetzung sein Light-off-Verhalten, der Druckverlust, das Thermoschockverhalten und die Washcoatadhäsion. Um die Langzeitbeständigkeit von Drei-Wege-Katalysatoren zu bewerten, wurden schnelle Katalysatoralterungszyklen entwickelt. Diese simulieren in kurzer Zeit die Deaktivierung des Katalysators unter realen Fahrbedingungen.[77]
Die Fahrzeughersteller mussten anfangs Testfahrzeuge mit einer Laufleistung von 80.000 Kilometern (50.000 Miles) als Dauerlauffahrzeuge einsetzen. Im Rahmen regelmäßiger Abgastests nach dem US-amerikanischen Federal Test Procedure (FTP-75) wurden die Emissionen bei verschiedenen Laufleistungen zwischen 6400 und 80.000 Kilometern ermittelt.[78]
Um die langfristige Haltbarkeit von Drei-Wege-Katalysatoren ohne aufwändige Straßentests bewerten zu können, wurden schnelle Katalysatoralterungszyklen entwickelt. Diese ahmen die Deaktivierung des Katalysators unter Fahrbedingungen in kurzer Zeit nach. Dabei wird der Katalysator auf einem Teststand unter simulierten Fahrbedingungen mit wechselnden Luft-Kraftstoff-Verhältnissen getestet. Nach einer gewissen Alterungszeit – beispielsweise 50 Stunden bei einer Durchschnittsgeschwindigkeit von 200 Kilometern pro Stunde, was 10.000 gefahrenen Kilometern entspricht – wird die katalytische Aktivität mit einem Standardmotor getestet.[77]
Testzyklen

Dauer = 1874 Sekunden, Distanz = 11,04 Meilen, Durchschnittliche Geschwindigkeit = 21,19 Meilen pro Stunde

Die Fahrzeugemissionen werden nach bestimmten Fahrzyklen ermittelt, bei denen die Geschwindigkeit eines Fahrzeugs über einen gewissen Zeitraum hinweg variiert wird, um definierte Fahrsituationen, wie etwa den Stadtverkehr, zu simulieren. Einer der ersten Tests war das Federal Test Procedure (FTP-75), ein von der EPA festgelegter Fahrzyklus, mit dem die Emissionen und der Kraftstoffverbrauch von Personenkraftwagen gemäß dem Clean Air Act gemessen wurden. Der Test umfasst drei Fahrmodi, die auf Motorprüfständen mit Analysegeräten zur Messung von Abgasbestandteilen ausgewertet werden können. Im Jahr 2007 wurden mit den sogenannten Supplemental Federal Test Procedures (SFTP) weitere Prüfverfahren eingeführt. Diese decken das Fahrverhalten bei hohen Geschwindigkeiten und Beschleunigungen sowie bei raschen Geschwindigkeitsschwankungen ab.[15]
Bei Ottomotoren für Personenkraftwagen ist es gängige Praxis, beim Abruf der maximalen Leistung im Volllastbereich („Vollgas“) durch Anfetten des Kraftstoff-Luft-Gemisches die Leistung zu maximieren. Dazu muss das Kraftstoff-Luft-Gemisch im Vergleich zu Teillast etwas angefettet werden, da die Flammengeschwindigkeit in leicht fetten Gemischen höher ist (rascheres sogenanntes Durchbrennen des Gemisches).[79] Wie stark das Gemisch angefettet wird, hängt von der Programmierung des jeweiligen Motorsteuergerätes ab; Werte bis λ = 0,8 sind gebräuchlich (Stand 2018).[80] Außerdem wird durch die Volllastanreicherung die Innenkühlung der Brennräume verbessert: Da die Verdampfung von Kraftstoff Energie benötigt, werden durch den zusätzlichen Kraftstoff die Brennräume zusätzlich gekühlt.
Durch die unvollständige Verbrennung sinkt die Abgastemperatur und dadurch werden Motorbetriebspunkte erreichbar, bei denen ohne die Anfettung der Abgaskrümmer, der Turbolader oder der Katalysator zerstört würden. Durch die Abweichung von verliert der Dreiwegekatalysator einen Teil seiner Wirkung, da Kohlenwasserstoffe und Kohlenstoffmonoxid nicht mehr vollständig umgewandelt werden können.[81] Volllastanreicherung ist eine Technik, die bereits vor Jahrzehnten bei Vergasermotoren angewandt worden ist.
Im früher geltendem NEFZ-Zyklus wurden keine hohen Beschleunigungen, wie sie etwa beim Auffahren auf die Autobahn üblich sind, abgerufen, sodass unter diesen Testbedingungen, anders als in der Praxis, keine Volllastanreicherung stattfand und dementsprechend nicht in die Messung eingingen.[82] In dem seit 2017 geltenden WLTP Zyklus und den Tests entsprechend der RDE Vorschriften sind die Beschleunigungen deutlich höher. Mithilfe der neuen Testprotokolle wird das Verhalten unter realen Lastbedingungen simuliert, wodurch sich das Fahren unter Volllastanreicherung verringert. Dabei sind gemäß der Euro-6-Abgasnorm pro Kilometer Emissionen von maximal 100 Milligramm Gesamtkohlenwasserstoffen, 60 Milligramm Stickoxide und 1000 Milligramm Kohlenstoffmonoxid einzuhalten.[83]
On-Board-Diagnose
On-Board-Diagnose (OBD) bezeichnet die Fähigkeit eines Fahrzeugs, selbst Diagnosen durchzuführen und Fehler zu melden. Zur Überwachung der Funktion des Drei-Wege-Katalysators wird beispielsweise die Sauerstoffkonzentration an dessen Ausgang mithilfe eines zweiten Sensors gemessen. Aufgrund der Sauerstoffspeicherkapazität der Cerkomponenten wäre ein ordnungsgemäß funktionierender Katalysator in der Lage, Sauerstoffschwankungen im Abgasstrom zu dämpfen. Daher sollte der zweite Sauerstoffsensor ein relativ konstantes Signal erzeugen, das anzeigt, dass die Katalysatorfunktion normal ist. Erzeugt der Sensor jedoch ein fluktuierendes Signal, das dem Signal des Lambdasensors im Katalysatoreingang entspricht, deutet dies darauf hin, dass die Sauerstoffspeicherfunktion beeinträchtigt ist und der Katalysator seine Funktionsfähigkeit verloren hat.[29]
Katalysatordeaktivierung
Sinterung
Die Deaktivierung des Katalysators wird durch mehrere Faktoren beeinflusst. Hohe Temperaturen oder Verunreinigungen im Kraftstoff haben einen starken Einfluss auf die Lebensdauer des Katalysators. Da der Katalysator die durchschnittliche Lebensdauer eines Fahrzeugs überdauern soll, muss seine Leistung am Ende der Lebensdauer noch ausreichen, um die gesetzlichen Anforderungen zu erfüllen. Drei-Wege-Katalysatoren werden unter anderem durch thermische Alterung deaktiviert.[70]
Das Sintern kann sowohl das Trägermaterial als auch die Edelmetalle betreffen. Beim Sintern des Trägermaterials geht die innere Oberfläche verloren, beim Sintern der Edelmetalle die katalytisch aktiven Zentren.[84] Das verwendete Trägermaterial, γ-Aluminiumoxid, ist stabil bis etwa 800 °C und geht bei höheren Temperaturen zunächst in δ-Aluminiumoxid über. Ab 1100 °C entsteht schließlich α-Aluminiumoxid. Diese Umwandlungen sind mit einem Verlust an BET-Oberfläche und katalytischer Aktivität verbunden.[70]
Die feinverteilten Edelmetalle Platin und Palladium können bei erhöhten Temperaturen größere Partikel bilden. Damit nimmt die für die Katalyse zur Verfügung stehende Oberfläche ab. Platin liegt auf Aluminiumoxid im metallischen Zustand vor. Aufgrund der schwachen Wechselwirkung mit dem Trägermaterial neigt Platin unter oxidierenden Bedingungen dazu, über die Oberfläche des Aluminiumoxids zu wandern und zu sintern. Die mittlere Oxidationsstufe von Platin auf einem Ceroxidträger beträgt dagegen etwa 3,5. Die Platin-Sauerstoff-Ceroxid-Bindung wirkt dabei wie ein Anker, der das Sintern von Platin unterdrückt.[84] Rhodium kann mit Aluminiumoxid zu einem katalytisch inaktiven Rhodiumaluminat reagieren.[85]
Katalysatorgifte
- Katalysatorgifte
- Tetraethylblei
- MMT
- Zinkdialkyldithiophosphate
(R=Alkylrest)
Katalysatorgifte wie Tetraethylblei (TEL) oder (Methylcyclopentadienyl)mangantricarbonyl (MMT), die als Oktanzahlverbesserer genutzt wurden, zerfallen auf der Katalysatoroberfläche in die Metalle und können die Edelmetallpartikel physikalisch blockieren.[85] Bei der Verbrennung von MMT-haltigen Kraftstoffen entstehen Manganoxide, die sich als rötlich-braune Ablagerungen auf dem Katalysator ablagern und diesen unter Betriebsbedingungen mechanisch blockieren können. In einem Fahrzeugflottentest erfüllten einige mit MMT-haltigen Kraftstoffen betriebene Fahrzeuge die Abgasnormen innerhalb von 50.000 Meilen nicht.[86]
Weiterhin kann es zu einer Deaktivierung durch Phosphorbestandteile des Schmieröls kommen, die beispielsweise in Form von Zinkdialkyldithiophosphaten als Verschleißschutzmittel eingesetzt werden. Der Phosphor lagert sich im Einlassbereich des Katalysators ab, was eine verminderte Kaltstarteffizienz zur Folge hat.[15]
Washcoatadhäsion
Eine ungenügende Washcoatadhäsion in Verbindung mit hohen Gasgeschwindigkeiten und stetigen Temperaturänderungen kann zum Verlust des Washcoats durch Austrag führen, was eine irreversible Deaktivierung des Katalysators zur Folge hat. Ebenso können Unterschiede in der thermischen Ausdehnung zwischen Washcoat und Monolith zu einer Lockerung der Bindung zwischen Washcoat und Substrat und damit zu einem Washcoatverlust führen. Bei Metallsubstraten ist die thermische Ausdehnung des Substrats größer als die des Washcoats, bei keramischen Substraten ist es hingegen umgekehrt.[87]
Metallrückgewinnung
Zur Rückgewinnung von Platinmetallen aus gebrauchten Katalysatoren werden pyro-, hydro- und elektrometallurgische Verfahren eingesetzt.[88] Bei hydrometallurgischen Verfahren wird der Katalysator zerkleinert und die keramischen Bestandteile werden mithilfe von Säure aufgelöst. Beim pyrometallurgischen Verfahren wird die Keramik geschmolzen. Die Keramik schwimmt dann als Schlacke über der Edelmetallphase. Diese sinkt zu Boden und wird mit einem zugesetzten Metall wie Kupfer oder Eisen legiert. In beiden Fällen wird der edelmetallreiche Rückstand durch chemische oder elektrochemische Verfahren anschließend weiter gereinigt.[89]
Katalysatordiebstahl
- Im Rahmen einer Razzia beschlagnahmte Katalysatoren (2022)
- Entwicklung der Platin- und Palladiumpreise seit 1980
In den Jahren 2020 bis 2022 stahl eine kriminelle Gruppe im großen Stil Drei-Wege-Katalysatoren in den USA. Durch den Anstieg der Edelmetallpreise wurde der Katalysatordiebstahl sehr lukrativ. Allein im Jahr 2022 wurden in den USA etwa 153.000 Katalysatoren als gestohlen gemeldet.[90]
Die gestohlenen Katalysatoren wurden zur Edelmetallrückgewinnung an DG Auto Parts in Freehold, New Jersey, geschickt. Dort wurden die Monolithen gemahlen und zur Raffination an Dowa Metals & Mining America verkauft. Der dabei erzielte Gewinn wird auf rund 545 Millionen US-Dollar beziffert. Im November 2022 wurde die kriminelle Gruppe zerschlagen, wobei es zu 21 Festnahmen in fünf Bundesstaaten kam.[91]
Nachdem ein Hilfssheriff des Harris County (Texas) bei der Verfolgung von Katalysatordieben erschossen wurde, wurde der nach dem Ermordeten benannte Deputy Darren Almendarez Act in Kraft gesetzt, der die Strafen für Katalysatordiebstähle verschärfte. Das Gesetz stuft die Verwendung einer Schusswaffe beim Diebstahl eines Katalysators als Kapitalverbrechen ein, das mit bis zu zwei Jahren Gefängnis bestraft werden kann.[92] Nach der Zerschlagung des Diebesrings und der Gesetzesänderung nahm die Zahl der Katalysatordiebstähle rasch ab.[93]
Literatur
- H. Bode: Materials Aspects in Automotive Catalytic Converters. Wiley-VCH, 2002, ISBN 978-3-527-30491-2.
- Ronald M. Heck, Robert J. Farrauto, Suresh T. Gulati: Catalytic Air Pollution Control: Commercial Technology. John Wiley & Sons, 2009, ISBN 978-0-470-27503-0.
- Calvin H. Bartholomew, Robert J. Farrauto: Fundamentals of Industrial Catalytic Processes. John Wiley & Sons, 2006, ISBN 978-0-471-45713-8.
Weblinks
Einzelnachweise
- ↑ a b c d Daniel Dexter: Case study of the innovation process characterizing the development of the three-way catalytic converter system. No. DOT-TSC-NHTSA-79-36. United States. National Highway Traffic Safety Administration, 1979 (online). (PDF).
- ↑ Arie J. Haagen-Smit: The air pollution problem in Los Angeles. In: Engineering and Science. 14.3, 1950, S. 7–13, (online). (PDF; 0,9 MB).
- ↑ Timeline of Major Accomplishments in Transportation, Air Pollution, and Climate Change. In: epa.gov. 27. Juni 2016, abgerufen am 10. Juli 2025 (englisch).
- ↑ Harold W. Kennedy, Martin E. Weekes: Control of Automobile Emissions. California Experience and the Federal Legislation. In: Law and Contemporary Problems. 33.2, 1968, S. 297–314, JSTOR:1190920.
- ↑ Michael Reagan: 5 Ways EPA is Protecting People and the Planet. In: epa.gov. 18. April 2023, abgerufen am 4. Juli 2025 (englisch).
- ↑ a b Environment: Senate wins Clean Car Race. In: Nature. 228.5266, 1970, S. 11–12, doi:10.1038/228011b0.
- ↑ Elliott M. Estes: Edward Nicholas Cole 1909-1977. In: nae.edu. 17. Juni 2025, abgerufen am 13. Juli 2025 (englisch).
- ↑ a b G. M.'s Pollution‐Control Battle. In: New York Times. 24. März 1974, abgerufen am 9. Juli 2025.
- ↑ a b Patent US2674521: Catalytic Converter for Exhaust Gases. Veröffentlicht am 6. April 1954, Erfinder: Eugene Houdry.
- ↑ Ronald M. Heck, Robert J. Farrauto, Suresh T. Gulati: Catalytic Air Pollution Control: Commercial Technology. John Wiley & Sons, 2009, ISBN 978-0-470-27503-0, S. 178.
- ↑ Ronald M. Heck, Robert J. Farrauto, Suresh T. Gulati: Catalytic Air Pollution Control: Commercial Technology. John Wiley & Sons, 2009, ISBN 978-0-470-27503-0, S. 109.
- ↑ Gregory Skwira: A Look at the Record on Catalytic Converters. In: The New York Times. 25. Januar 1976, abgerufen am 30. Juli 2025.
- ↑ EPA: Progress in the Implementation of Motor Vehicle Emission Standards through June 1974. Report to Congress, EPA 230/3–74–013, S. I–4. In: nepis.epa.gov. 30. Juni 1974, abgerufen am 4. Juli 2025.
- ↑ EPA Requires Phase-Out of Lead in All Grades of Gasoline. In: epa.gov. 28. November 1973, abgerufen am 4. Juli 2025 (englisch).
- ↑ a b c d e R. J. Farrauto, M. Deeba, S. Alerasool: Gasoline automobile catalysis and its historical journey to cleaner air. In: Nature Catalysis. 2.7, 2019, S. 603–613, doi: 10.1038/s41929-019-0312-9.
- ↑ a b c L. S. Bernstein u. a.: Application of Catalysts to Automotive NOx Emissions Control. In: SAE Transactions. 1971, S. 42–62, JSTOR:44731351.
- ↑ a b c W. A. Mannion u. a.: Catalytic Reduction of Oxides of Nitrogen Emissions in Auto Exhaust Gas. In: Advances in Chemistry. 1975, S. 1–13, doi:10.1021/ba-1975-0143.ch001.
- ↑ Jeff Koch: Chrysler’s Lean-Burn System. In: hemmings.com. 26. März 2024, abgerufen am 7. August 2025.
- ↑ Heinz Heinemann: A Brief History of Industrial Catalysis. In: J. Anderson, M. Boudart (Hrsg.): Catalysis Science and Technology. Bd. 1, Springer-Verlag, Berlin, 1981, S. 1–41, ISBN 978-3-642-93173-4.
- ↑ J. J. Mooney, C. E. Thompson, J. C. Dettling: Three-Way Conversion Catalysts Part of the New Emission Control System. In: SAE Transactions. Bd. 86, Sektion 2: 770189–770402, 1977, S. 1553–1562, JSTOR:44648173.
- ↑ J. J. Mooney, C. D. Falk: Three-Way Conversion Catalysts: Effect of Closed-Loop Feed-Back Control and Other Parameters on Catalyst Efficiency. In: SAE Technical Papers, doi:10.4271/800462.
- ↑ John J. Mooney - National Science and Technology Medals Foundation. In: nationalmedals.org. 15. Juli 2020, abgerufen am 17. Mai 2024 (englisch).
- ↑ Carl D. Keith - National Science and Technology Medals Foundation. In: nationalmedals.org. 15. Juli 2020, abgerufen am 17. Mai 2024 (englisch).
- ↑ H. S. Gandhi, A. G. Piken, M. Shelef, R. G. Delosh: Laboratory Evaluation of Three-Way Catalysts. In: SAE Transactions. 85.2, 1976, S. 901–912, JSTOR:44631875.
- ↑ 18. September 2009 - Vor 25 Jahren: Bundesregierung beschließt den Katalysator. In: www1.wdr.de. 6. Oktober 2015, abgerufen am 15. Juli 2025.
- ↑ Egbert S. J. Lox: Automotive Exhaust Treatment. In: G. Ertl, H. Knözinger, J. Weitkamp: Handbook of Heterogeneous Catalysis Environmental Catalysis. Wiley‐VCH, 2008, ISBN 978-3-527-31241-2, S. 2274–2278.
- ↑ Konrad Reif: Abgasemission. In: Konrad Reif (Hrsg.): Dieselmotor-Management im Überblick. Bosch Fachinformation Automobil. Springer Vieweg, Wiesbaden, 2014, doi:10.1007/978-3-658-06555-3_17.
- ↑ Wunder der Technik. In: Spiegel Online. 10. November 1985, abgerufen am 10. August 2025.
- ↑ a b G. C. Koltsakis, A. M. Stamatelos: Catalytic automotive exhaust aftertreatment. In: Progress in Energy and Combustion Science. 23.1, 1997, S. 1–39, doi:10.1016/s0360-1285(97)00003-8.
- ↑ Richtlinie 98/69/EG
- ↑ Alfred Punke u. a.: Trimetallic Three-Way Catalysts. In: SAE Transactions. 104.4, 1995, S. 279–288, JSTOR:44615083.
- ↑ a b NOAA Chemical Sciences Laboratory (CSL): NOAA CSL: 2012 News & Events: 50-year decline in some Los Angeles vehicle-related pollutants. In: csl.noaa.gov. 9. August 2012, abgerufen am 16. Juli 2025 (englisch).
- ↑ The Benefits and Costs of the Clean Air Act, 1970 to 1990 (PDF; 6,0 MB) auf epa.gov, abgerufen am 19. Mai 2024
- ↑ Marla Cone: Area's Smog Year Almost as Clean as Record 1993 : Air: Officials blame temporary, local wind patterns this year for Orange County's three days of alerts. In: Los Angeles Times. 1. November 1994, abgerufen am 22. Mai 2024 (englisch).
- ↑ Passenger cars in the EU - Statistics Explained - Eurostat. In: ec.europa.eu. 31. Dezember 2024, abgerufen am 8. Juli 2025 (englisch).
- ↑ Nestor Gilbert: The Number of Cars in the US in 2024: Market Share, Distribution, and Trends. In: financesonline.com. 24. Juni 2025, abgerufen am 8. Juli 2025 (englisch).
- ↑ Adrienne Selko: 7 Million Diesel Vehicles Registered in U.S. In: newequipment.com. 9. Juni 2014, abgerufen am 8. Juli 2025 (englisch).
- ↑ V. Balaram: Environmental Impact of Platinum, Palladium, and Rhodium Emissions from Autocatalytic Converters – A Brief Review of the Latest Developments. In: C. Hussain (Hrsg.): Handbook of Environmental Materials Management. Springer, Cham, 2020, S. 6, doi:10.1007/978-3-319-58538-3_194-1.
- ↑ P. Brijesh, S. Sreedhara: Exhaust emissions and its control methods in compression ignition engines: A review. In: International Journal of Automotive Technology. 14.2, 2013, S. 195–206, doi:10.1007/s12239-013-0022-2.
- ↑ Marcus Hook: The Houdry Process for the Catalytic Conversion of Crude Petroleum to High-Octane Gasoline (PDF; 17 MB) auf acs.org
- ↑ A. J. Haagen-Smits: Smog Research pays off. (PDF; 0,4 MB) auf calteches.library.caltech.edu
- ↑ A. K. Jain u. a.: Effect of Gasoline Composition (Olefins, Aromatics and Benzene) on Automotive Exhaust Emissions – A Literature Review. In: SAE Technical Paper Series. 2004, doi:10.4271/2004-28-0081.
- ↑ Calvin H. Bartholomew, Robert J. Farrauto: Fundamentals of Industrial Catalytic Processes. John Wiley & Sons, 2006, ISBN 978-0-471-45713-8, S. 706.
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 713–717.
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 520–523.
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 896–900.
- ↑ L. Curtis u. a.: Adverse health effects of outdoor air pollutants. In: Environment International. 32.6, 2006, S. 815–830, doi:10.1016/j.envint.2006.03.012.
- ↑ T.-M. Chen u. a.: Outdoor Air Pollution: Overview and Historical Perspective. In: The American Journal of the Medical Sciences. 333.4, 2007, S. 230–234, doi:10.1097/maj.0b013e31803b8c91.
- ↑ R. Zhu u. a.: Effects of aromatics, olefins and distillation temperatures (T50 & T90) on particle mass and number emissions from gasoline direct injection (GDI) vehicles. In: Energy Policy. 101, 2017, S. 185–193, doi:10.1016/j.enpol.2016.11.022.
- ↑ E. Achleitner u. a.: Herausforderungen an die Benzindirekteinspritzsysteme zur Einhaltung der EU6c Abgasgrenzwerte. In: H. Tschöke (Hrsg.): 9. Tagung Diesel- und Benzindirekteinspritzung 2014. Springer Vieweg, Wiesbaden 2015, doi:10.1007/978-3-658-07650-4_13.
- ↑ Schwefelbestimmung in schwefelfreien Kraftstoffen. In: analytik.news. 3. August 2005, abgerufen am 15. Juli 2025.
- ↑ D. Lou u. a.: Effect of Operating Conditions and TWC Parameters on Emissions Characteristics of a Stoichiometric Natural Gas Engine. In: Energies. 13.18, 2020, S. 4905, doi:10.3390/en13184905.
- ↑ Patent US4228128: Exhaust Gas Sensor having porous Metal-impregnated Ceramic Element. Veröffentlicht am 14. Oktober 1980, Erfinder: Michael J. Esper, Wells L. Green, Stanley R. Merchant.
- ↑ John J. Mooney: Emission control, automotive. In: Kirk-Othmer Encyclopedia of Chemical Technology. John Wiley & Sons, 2000, ISBN 978-0-471-48494-3, S. 50.
- ↑ Ronald M. Heck, Robert J. Farrauto, Suresh T. Gulati: Catalytic Air Pollution Control: Commercial Technology. John Wiley & Sons, 2009, ISBN 978-0-470-27503-0, S. 10–13.
- ↑ a b Gerhard Ertl: Reactions at Solid Surfaces. John Wiley & Sons, 2009, ISBN 978-0-470-26101-9, S. 139–149.
- ↑ J. Gao u. a.: Review of thermal management of catalytic converters to decrease engine emissions during cold start and warm up. In: Applied Thermal Engineering. 147, 2019, S. 177–187, doi:10.1016/j.applthermaleng.2018.10.037.
- ↑ Ronald M. Heck, Robert J. Farrauto, Suresh T. Gulati: Catalytic Air Pollution Control: Commercial Technology. John Wiley & Sons, 2009, ISBN 978-0-470-27503-0, S. 184–185.
- ↑ a b Ronald M. Heck, Robert J. Farrauto, Suresh T. Gulati: Catalytic Air Pollution Control: Commercial Technology. John Wiley & Sons, 2009, ISBN 978-0-470-27503-0, S. 110.
- ↑ Benedikt Notter u. a.: HBEFA 4.2. Documentation of updates. Bern, Graz, Heidelberg, Lyon, Göteborg, 2022, S. 19. (online) (PDF; 0,9 MB) auf assets-global.website-files.com
- ↑ a b Douglas M. Beall, Willard A. Cutler: Smog begone! How development of ceramic automotive catalytic substrates and filters helped reduce air pollution. In: American Ceramic Society Bulletin. 99.324, 2020, S. 24–31, ((online) (PDF; 0,6 MB)) auf ceramics.org.
- ↑ 2003 Laureates - National Medal of Technology and Innovation. In: uspto.gov. 15. Oktober 2021, abgerufen am 4. Juni 2025 (englisch).
- ↑ Suresh T. Gulati: Ceramic Converter Technology for Automotive Emissions Control. In: SAE Transactions. 100.4, 1991, S. 529–544, JSTOR:44553620.
- ↑ a b c Christian Bartsch: Der Metallkatalysator als variables System. In: MTZ - Motortechnische Zeitschrift. 65.10, 2004, S. 798–803, doi:10.1007/bf03227219.
- ↑ W. B. Williamson, J. C. Summers, J. F. Skowron: Catalyst Technologies for Future Automotive Emission Systems. In: SAE Transactions. 97.3, 1988, S. 41–51, JSTOR:44471518.
- ↑ J. R. Nicholls, W. J. Quadakkers: Materials Issues Relevant to the Development of Future Metal Foil Automotive Catalytic Converters. In: H. Bode: Materials Aspects in Automotive Catalytic Converters. Wiley-VCH, 2002, ISBN 978-3-527-30491-2, S. 31–48.
- ↑ I. Yakoumis, M. Panou, A. M. Moschovi, D. Panias: Recovery of platinum group metals from spent automotive catalysts: A review. In: Cleaner Engineering and Technology. 3, 2021, S. 100–112, doi:10.1016/j.clet.2021.100112.
- ↑ S. K. Sharma, P. Goyal, S. Maheshwari, A. Chandra: A Technical Review of Automobile Catalytic Converter: Current Status and Perspectives. In: Govind Chandra Mishra (Hrsg.): Strategic Technologies of Complex Environmental Issues – A Sustainable Approach. Excellent Publishing House, Neu-Delhi, 2014, ISBN 978-93-83083-85-5, S. 173.
- ↑ Ronald M. Heck, Robert J. Farrauto, Suresh T. Gulati: Catalytic Air Pollution Control: Commercial Technology. John Wiley & Sons, 2009, ISBN 978-0-470-27503-0, S. 30–31.
- ↑ a b c Ronald M. Heck, Robert J. Farrauto, Suresh T. Gulati: Catalytic Air Pollution Control: Commercial Technology. John Wiley & Sons, 2009, ISBN 978-0-470-27503-0, S. 25–27.
- ↑ S. Letichevsky u. a.: Obtaining CeO2–ZrO2 mixed oxides by coprecipitation: role of preparation conditions. In: Applied Catalysis B: Environmental. 58.3–4, 2005, S. 203–210, doi:10.1016/j.apcatb.2004.10.014.
- ↑ T. Montini, M. Melchionna, M. Monai, P. Fornasiero: Fundamentals and Catalytic Applications of CeO2-Based Materials. In: Chemical Reviews. 116.10, 2016, S. 5987–6041, doi:10.1021/acs.chemrev.5b00603.
- ↑ a b N. Guillén-Hurtado u. a.: Three-Way Catalyst: Past, Present and Future. In: Dyna. 79.175, 2012, S. 114–121, (Online).
- ↑ Egbert S. J. Lox: Automotive Exhaust Treatment. In: G. Ertl, H. Knözinger, J. Weitkamp: Handbook of Heterogeneous Catalysis Environmental Catalysis. Wiley‐VCH, 2008, ISBN 978-3-527-31241-2, S. 2296.
- ↑ D. Maret, Suresh T. Gulati, D.W. Lambert, U. Zink: Systems Durability of a Ceramic Racetrack Converter. In: SAE Transactions. 100, Section 4: Journal of Fuels & Lubricants. 1991, S. 993–1003, JSTOR:44553652.
- ↑ Swapnil Shinde: Calibrated Catalytic Converter. In: International Journal of Engineering and Techniques. 4.3, 2018, S. 151–157, (online (PDF; 0,4 MB) auf oaji.net).
- ↑ a b K. Ramanathan, S. H. Oh: Modeling and analysis of rapid catalyst aging cycles. In: Chemical Engineering Research and Design. 92.2, 2014, S. 350–361, doi:10.1016/j.cherd.2013.06.020.
- ↑ Asif Faiz, Christopher S. Weaver, Michael P. Walsh: Air Pollution from Motor Vehicles. Standard and Technologies for Controlling Emissions. The World Bank, Washington, 1996, ISBN 978-0-8213-3444-7, S. 3–5 (online), (PDF).
- ↑ Robert Bosch GmbH (Hrsg.): Ottomotor-Management: Systeme und Komponenten. 2. Auflage, Vieweg, Braunschweig/Wiesbaden 2003, ISBN 978-3-322-93929-6, S. 19.
- ↑ Robert Bosch GmbH (Hrsg.): Ottomotor-Management: Systeme und Komponenten. 2. Auflage, Vieweg, Braunschweig/Wiesbaden 2003, ISBN 978-3-322-93929-6, S. 102.
- ↑ Klaus Schreiner: Basiswissen Verbrennungsmotor: Fragen - rechnen - verstehen - bestehen. Springer, Wiesbaden 2014, ISBN 978-3-658-06187-6, S. 112.
- ↑ Dieter Klemp, Djuro Mihelčić, Bernhard Mittermaier: Messung und Bewertung von Verkehrsemissionen. Band 21 von Schriften des Forschungszentrums Jülich: Reihe Energie et Umwelt, Forschungszentrum Jülich, 2012, ISBN 978-3-89336-546-3, S. 143 ff.
- ↑ Bundesministerium für Verkehr – Informationen zu aktuellen Abgastests. In: bmv.de. 31. Juli 2024, abgerufen am 14. August 2025.
- ↑ a b H. Shinjoh: Noble Metal Sintering Suppression Technology in Three-way Catalyst: Automotive Three-way Catalysts with the Noble Metal Sintering Suppression Technology Based on the Support Anchoring Effect. In: Catalysis Surveys from Asia. 13.3, 2009, S. 184–190, doi:10.1007/s10563-009-9076-6.
- ↑ a b Ronald M. Heck, Robert J. Farrauto, Suresh T. Gulati: Catalytic Air Pollution Control: Commercial Technology. John Wiley & Sons, 2009, ISBN 978-0-470-27503-0, S. 79–94.
- ↑ S. K. Hoekman, A. Broch: MMT Effects on Gasoline Vehicles: A Literature Review. In: SAE International Journal of Fuels and Lubricants. 9.1, 2016, S. 322–343, doi:10.4271/2016-01-9073.
- ↑ Ronald M. Heck, Robert J. Farrauto, Suresh T. Gulati: Catalytic Air Pollution Control: Commercial Technology. John Wiley & Sons, 2009, ISBN 978-0-470-27503-0, S. 94.
- ↑ I. Chidunchi u. a.: Extraction of platinum group metals from catalytic converters. In: Heliyon. 10.3, 2024, S. e25283, doi:10.1016/j.heliyon.2024.e25283.
- ↑ Ronald M. Heck, Robert J. Farrauto, Suresh T. Gulati: Catalytic Air Pollution Control: Commercial Technology. John Wiley & Sons, 2009, ISBN 978-0-470-27503-0, S. 38.
- ↑ B. Stickle u. a.: Catalytic converter theft: An examination of the elasticity of crime. In: Crime Prevention and Community Safety. 26.2, 2024, S. 139–156, doi:10.1057/s41300-024-00207-6.
- ↑ Archived: HSI integral in takedown of national multi-million-dollar catalytic converter theft ring. In: ice.gov. 24. Januar 2025, abgerufen am 16. April 2025 (englisch).
- ↑ Eleanor Dearman: Bill named after slain Texas deputy becomes law, increasing penalties for catalytic converter thefts. In: police1.com. 7. Juni 2023, abgerufen am 13. Juni 2025 (englisch).
- ↑ Tanya Babbar: Catalytic car converter theft rates are close to zero so far this year, Houston police report. In: houstonchronicle.com. 17. August 2024, abgerufen am 13. Juni 2025 (englisch).
Auf dieser Seite verwendete Medien
Autor/Urheber: LSDSL, Lizenz: CC BY-SA 3.0
Mazda 6 (GJ) mit Emissionsmesssystem von AVL im Stadtverkehr
Autor/Urheber: Mister Pommeroy, Lizenz: CC BY-SA 4.0
Platin- und Palladiumpreise basierend auf Daten des USGS PLATINUM-GROUP METALS STATISTICS
1975 Volvo 245 DL wagon photographed in Washington, D.C., USA.
Autor/Urheber: Mister Pommeroy, Lizenz: CC BY 4.0
Wirkungsweise eines Dual-Bed-Systems zur Abgasreduzierung
Autor/Urheber: Martin Olsson (username 'mnemo' on en/sv wikipedia and commons, martin@minimum.se)., Lizenz: CC BY-SA 3.0
Oxygen sensor spare part for a Volvo 240 car (actually many different types of cars use this particular kind of oxygen sensor).
Carl D. Keith and John J. Mooney
EMISSION TEST AT THE NATIONAL ENVIRONMENTAL RESEARCH CENTER OF EPA: THE FORD ENGINE (BLUE) WITH FORD'S MONOLITH-HONEYCOMBED CATALYTIC CONVERTER (BRASS-COLORED) CHEVROLET ENGINE AT UPPER RIGHT
FTP-75 Fahrzyklus
Autor/Urheber: Galadrid, Lizenz: CC BY-SA 4.0
Honeycomb Automotive Catalyst
Autor/Urheber: Kritsanaviparkporn, E., Baena-Moreno, F. M., & Reina, T. R., Lizenz: CC BY 4.0
Aufbaus eines Drei-Wege-Katalysators (Übersetzung)
Traffic congestion in Los Angeles
President George W. Bush awards the 2003 National Medal of Technology award to Corning Inc., scientists Ronald M. Lewis, left, Irwin Lachman, center, and Rodney D. Bagley, during a ceremony in the East Room, Monday, March 14, 2005.
Motornaher Metall-Katalysator an einem 4-Zylinder-Turbobenziner von FPT
Autor/Urheber: S. Govender, H. Friedrich, Lizenz: CC BY-SA 4.0
Ceramic monoliths
Oxidation catalyst for the conversion of carbon monoxide and hydrocarbons
Kohlenmonoxid, Kohlenstoffmonoxid
Catalytic converters seized in a raid by Homeland Security Investigations on Curtis Cores
OEM Catalytic Converter on a 1996 Dodge Ram B2500 van. Dual inlets, single outlet. old, and about to be replaced.
View of President Richard Nixon signing the Clean Air Act of 1970 at the White House. Looking on are William Ruckelshaus, Administrator of the Environmental Protection Agency (left), and Russell E. Train, Chairman of the Council on Environmental Quality.
Autor/Urheber: Mister Pommeroy, Lizenz: CC BY-SA 4.0
Katalysatorwirkungsgrad, modifiziert nach: Lou, D. et al (2020). Effect of Operating Conditions and TWC Parameters on Emissions Characteristics of a Stoichiometric Natural Gas Engine. Energies, 13(18), 4905. Doi: 10.3390/en13184905
- Scope and content: LOS ANGELES REACTIVE POLLUTANT PROGRAM (LARPP), A UNIQUE MULTI-AGENCY AIR POLLUTION RESEARCH STUDY SPONSORED BY THE COORDINATING RESEARCH COUNCIL, A GOVERNMENT-INDUSTRY RESEARCH GROUP. USED IN THE PROJECT ARE THERMASONDES (WEATHER-TESTING BALLOONS), "TETROONS (AIRBORNE BUOYS USED TO MARK OFF GIVEN SECTIONS OF AIR FOR STUDY), AND EPA HELICOPTERS FOR TRACING AND TAKING SAMPLES. GROUND LEVEL SAMPLES ARE ALSO TAKEN. INFORMATION IS TRANSMITTED BY RADAR. CALIFORNIA AIR RESOURCES BOARD (CARB) VAN AT EAGLE ROCK. VANS CARRY AIR SAMPLING EQUIPMENT AND MUST BE READY TO CHANGE LOCATION QUICKLY ACCORDING TO RADIOED INFORMATION
Chemische Strukturformel von Zn(dtp)2
Rich-Lean-Zyklus beim Betrieb mit Lambda-Sonde
Kraftstoffverbrauch und VOC-Level in Los Angeles
Autor/Urheber: Mister Pommeroy, Lizenz: CC BY 4.0
Schema der Lamda-Regelung