Dimethylsulfoxid
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Dimethylsulfoxid | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C2H6OS | |||||||||||||||||||||
| Kurzbeschreibung | farb- und geruchlose, bittersüß schmeckende, hygroskopische Flüssigkeit[1][2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 78,13 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand | flüssig | |||||||||||||||||||||
| Dichte | 1,10 g·cm−3 (20 °C)[1] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt | 189 °C[1] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| Löslichkeit | mischbar mit Wasser, Alkoholen, Aceton, Chloroform und Benzol, nicht aber mit Alkanen[3] | |||||||||||||||||||||
| Dipolmoment | ||||||||||||||||||||||
| Brechungsindex | 1,4793 (20 °C)[5] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK | Schweiz: 50 ml·m−3 bzw. 160 mg·m−3[6] | |||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||||||||
| ΔHf0 | −204,2 kJ/mol[8] | |||||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Dimethylsulfoxid (Abkürzung DMSO) ist eine organische chemische Verbindung aus der Verbindungsklasse der Sulfoxide. Dimethylsulfoxid bildet eine farb- und geruchlose, bittersüß schmeckende, hygroskopische Flüssigkeit. Verwendet wird diese primär als Lösungsmittel für die Aromatenextraktion, als Abbeizmittel, als Gefrierschutzmittel und als Reaktionsmedium in der organischen Synthese. Weitere Verwendungen gibt es in der Pharmazie, in der Kryokonservierung und in der NMR-Spektroskopie.
Darstellung und Gewinnung
Technisch wird Dimethylsulfoxid aus Dimethylsulfid z. B. durch katalytische Oxidation mit Distickstofftetroxid in Anwesenheit von Sauerstoff hergestellt.[9] Im Labor kann der Thioether Dimethylsulfid mit stöchiometrischen Mengen Wasserstoffperoxid oder verdünnter Salpetersäure oxidiert werden. Das Dimethylsulfoxid kann allerdings weiter zu Dimethylsulfon oxidiert werden:[9]
DMSO fällt daneben als Nebenprodukt bei der Zellstoffherstellung an.[9]
Eigenschaften
Physikalische Eigenschaften
Dimethylsulfoxid ist eine farblose, geruchlose, bittersüß schmeckende, stark hygroskopische Flüssigkeit.[2] Zur Kennzeichnung der Reinheit („pharmazeutische Qualität“) „wird häufig die
herangezogen.“[10] Jede Geruchsnote (ob „faulig“ oder „schwefelartig“[11] oder im unreinen Zustand „leicht an Knoblauch erinnernd“[12]) deutet auf Verunreinigungen mit anderen Schwefelverbindungen hin, meist mit Dimethylsulfid, das nach dem Syntheseprozess (s. o.) verblieben sein kann, sich aber auch bei längerer Lagerung bildet[13]. Zur Herstellung der Reinsubstanz müssen daher geeignete Reinigungsverfahren, wie
oder eine Kombination dieser Verfahren angewendet werden.[10]
Mit einem Schmelzpunkt bei 18 °C kann DMSO nur wenig unterhalb der Raumtemperatur erstarren.[14] Die Schmelzenthalpie beträgt 14,37 kJ·mol−1.[15] Bei Normaldruck siedet die Verbindung bei 189 °C.[16] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 4,49107, B = 1807,002 und C = −60,995 im Temperaturbereich von 325,5 bis 442,1 K[17] bzw. mit A = 5,23039, B = 2239,161 und C = −29,215 im Temperaturbereich von 293 bis 323 K.[18] Es ist in jedem Verhältnis mit Wasser mischbar, weiterhin mit vielen organischen Lösemitteln wie Alkoholen, Carbonsäureestern, Ketonen, und chlorierten Kohlenwasserstoffen. Es gehört der Gruppe nukleophiler, aprotischer, dipolarer Lösemittel an (wie zum Beispiel Dimethylformamid).
- Dampfdruckfunktion
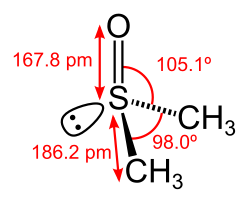
- DMSO-Molekül mit Bindungslängen und -winkeln
Chemische Eigenschaften
Die Verbindung beginnt sich am Normaldrucksiedepunkt bei 189 °C thermisch zu zersetzen, was heftig bis explosionsartig erfolgen kann.[19] Die Zersetzung wird durch Säuren oder Basen katalysiert, so dass diese schon bei wesentlich niedrigeren Temperaturen relevant werden kann.[19] Eine heftige bis explosionsartige Zersetzung erfolgt auch in Gegenwart von Halogenverbindungen, Metallnitraten, Metallperchloraten, Natriumhydrid, Periodsäure und von Fluorierungsmitteln.[19][9]
Dimethylsulfoxid kann mit Natriumhydrid[20] oder Natriumamid[21] unter Bildung eines Methylsulfinylcarbanions (Dimsylanion) deprotoniert werden, welches als sehr starkes nucleophiles Reagenz in der organischen Synthese verwendet wird. Die Reaktionsgemische können sich oberhalb von 70 °C explosionsartig zersetzen. Es besteht auch beim Isolieren des festen Natriumsalzes Explosionsgefahr.[19]
Sicherheitstechnische Kenngrößen
Dimethylsulfoxid bildet oberhalb des Flammpunktes bei 88 °C entzündbare Dampf-Luft-Gemische.[22] Die untere Explosionsgrenze liegt bei 1,8 Vol.‑% (58 g/m³). Eine obere Explosionsgrenze (OEG) kann wegen der thermischen Zersetzung der Substanz nicht bestimmt werden.[22] Die Sauerstoffgrenzkonzentration wurde bei 200 °C mit 3,9 Vol% bestimmt.[23] Mit einer Mindestzündenergie von 0,48 mJ sind Dampf-Luft-Gemische extrem zündfähig.[24] Die Zündtemperatur beträgt 270 °C.[22] Der Stoff fällt somit in die Temperaturklasse T3. Die elektrische Leitfähigkeit ist mit 2·10−7 S·m−1 eher gering.[25]
DMSO-d6

Vollständig deuteriertes DMSO (DMSO-d6) – in dem alle sechs Wasserstoffatome durch Deuterium ausgetauscht sind – wird als Lösungsmittel in der NMR-Spektroskopie benutzt.
Verwendung
DMSO ist ein weitverbreitetes Lösungsmittel in Labor und Technik. So wird es in Spinnlösungen von Polyacrylnitril, als Abbeizmittel, als Lösungsmittel bei der Aromatenextraktion und als Reaktionsmedium bei organischen Synthesen verwendet. Auch viele anorganische Salze haben eine gute Löslichkeit in DMSO.[26]
In der organischen Synthesechemie dient es in der Swern-Oxidation und der Parikh-Doering-Oxidation als Oxidationsmittel. In der Pharmazie dient es als pharmazeutischer Hilfsstoff als Bestandteil von Salben (siehe Pharmakologie).
In der Zellkultur findet DMSO Verwendung in Einfriermedien bei der Kryokonservierung von eukaryotischen Zellen.[27][28] Als Gefrierschutzmittel verhindert es während des Einfrierprozesses die Bildung von Eiskristallen; diese können Zellorganellen zerstören und so zum Absterben der Zellen führen. DMSO hemmt die Kristallbildung etwas besser als Glycerin.
Auch die meisten Substanzbibliotheken verwenden DMSO als Lösungsmittel. Da das Lösungsmittel jedoch nicht komplett inert ist, kann dies zu einer Verschlechterung der Probenreinheit führen.[29]
DMSO als Arzneimittel
Vorgeschichte
Die beiden amerikanischen Wissenschaftler Edward E. Rosenbaum und Stanley W. Jacob entdeckten Anfang der 1960er Jahre die medizinische Verwendung von DMSO.[30] Es sollte bei einer Vielzahl von Krankheiten des Bewegungsapparates sowie außerdem bei Verletzungen eine überraschende Heilwirkung entfalten. Die Datenlage dazu war dünn, „qualitativ und quantitativ bei weitem noch nicht zureichend“[31], sie genügte aber dem Bundesgesundheitsamt, um dem Antrag von fünf westdeutschen Pharmaunternehmen[32] auf Zulassung von DMSO Ende August 1965 stattzugeben.
Mitte September 1965 berichtete dann die Fachpresse über zwei nicht aufgeklärte Todesfälle nach DMSO-Therapie, ein Kausalzusammenhang war jedoch nicht nachzuweisen. Außerdem untersuchte die FDA drei Sterbefälle aufgrund fraglicher allergischer Reaktion auf DMSO.
Zwei Monate später kam aus zwei Laboren in England und den USA gleichzeitig die Nachricht, dass bei monatelang mit DMSO behandelten Tieren eine „Veränderung des Brechungsindex der Augenlinse“ aufgetreten sei.[33] Die FDA reagierte als Erste sofort und konsequent mit einem Verbot aller DMSO-Tests an amerikanischen Kliniken (betroffen gewesen sein sollen etwa 50.000 Probanden). Der FDA-Chefmediziner Dr. Joseph F. Saduk konstatierte: „Weitere Versuche mit Menschen sind nicht mehr zu rechtfertigen“.[34]
Erst vier Tage nach Bekanntwerden dieses Ergebnisses, am 17. November 1965, veranlassten die längst informierten westdeutschen Hersteller einen Lieferstopp des vorher als Wundermittel („Geradezu dramatische Erfolge“ (Schering))[35] angepriesenen Stoffs. Das bedeutete de facto die Marktrücknahme von DMSO. Das deutsche Gesundheitssystem erfuhr von der Misere erst zwei Tage später. DMSO war also in Deutschland weniger als drei Monate als Einzelsubstanz zugelassen.
Die anbietende deutsche Pharmaindustrie war sich keines Versäumnisses bewusst. Jedoch hatte schon Wochen vor dem Lieferstopp die Arzneimittelkommission der amerikanischen Ärzteschaft gewarnt: „Bis jetzt sind weder seine positiven Wirkungen noch seine möglichen Gefahren hinreichend erforscht.“[36]
Aktuelle Rechtssituation
Der freie Handel mit der Substanz ist weiterhin nicht verboten, solange sie nicht als Arzneimittel angeboten wird.
- In Deutschland ist Dimethylsulfoxid als Arzneimittel nicht zugelassen, da die Hersteller laut Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) keine Zulassungsanträge stellen.[37] Daher ist DMSO im Pharmahandel als Einzelsubstanz nicht gelistet, es sind keine Fertigarzneimittel mehr auf dem deutschen Markt.[38]
Nachdem seit der Gesundheitsreform 2004 nicht verschreibungspflichtige Arzneimittel nicht mehr von den Krankenkassen erstattet worden waren, stellte z. B. ein Hersteller wie Merckle seine Produktion von Dolobene Gel ein und nahm die Produkte mit Dimethylsulfoxid im Jahr 2010 vom deutschen Markt.[39][40] Dimethylsulfoxidhaltige Arzneimittel können aber auf Grund einer ärztlichen Verordnung als Rezepturen in der Apotheke zur Herstellung abgegeben werden.[41] In der Gelben Liste wird es als Wirkstoff geführt.[42] DMSO wird (Stand April 2023) bei einzelnen fluoruracilhaltigen Warzenmitteln als pharmazeutischer Hilfsstoff („sonstiger Bestandteil“[43]), nicht als Inhaltsstoff („enthält ...“) aufgeführt. In topischen Antiphlogistica wurde DMSO als Transportvermittler ersetzt durch 2,5-Dimethylisosorbid, z. B. in Dolobene® Ibu Gel.[44]
- In der Schweiz wird folgendermaßen differenziert: „Dimethylsulfoxid ist in der Schweiz als Arzneistoff zugelassen und ausschliesslich in Kombination mit anderen Wirkstoffen im Handel. Es handelt sich um Sprays, Gele und Cremen. Die DMSO-Salbe 50 % wird in Apotheken hergestellt. Der Reinstoff ist in Apotheken und Drogerien erhältlich. Medikamente zur Einnahme sind nicht freigegeben.“[41]
- In Österreich sind antiphlogistische Lokaltherapeutika mit DMSO[45] in Apotheken erhältlich. Gele mit einem DMSO-Gehalt ≥20 %[46] wurden 2004 noch als rezeptpflichtige Medizinprodukte (nicht als Arzneimittel) verkauft.[47]
- In den USA ist DMSO seit 1978 ausschließlich zur Instillation in die Harnblase bei interstitieller Zystitis von der FDA zugelassen.[48][49] Trotz Teilerfolgen bei der Therapie des Hirnödems[50] erteilte die FDA bisher (2022) keine Zulassung für diese Indikation.
Pharmakologie
Dimethylsulfoxid hat entzündungshemmende (antiphlogistische) und schmerzlindernde (analgetische) Eigenschaften.[9][51][52] Es findet daher trotz ungeklärter Nebenwirkungen und hiesiger rechtlicher Beschränkungen therapeutische Verwendung als perkutanes (lat. durch die Haut) Arzneimittel zur Behandlung lokaler Schmerzzustände[53] (beispielsweise bei Sportverletzungen oder rheumatischen Beschwerden). Da DMSO bei Blutergüssen zum schnellen Abschwellen beiträgt, wird es bei Bedarf[53] besonders in Kampfsportarten angewandt.[54] Eine Studie aus Brasilien konnte zeigen, dass DMSO-Gel in Kombination mit therapeutischem Ultraschall gegenüber anderen Behandlungsformen (bzw. keiner Behandlung) signifikant bessere Ergebnisse im Hinblick auf das Abschwellen stumpfer Verletzungen aufweisen.[55]
Seine besondere Fähigkeit ist das leichte Eindringen in Haut und das Passieren von Zellmembranen.[56] Es dringt in die Haut ein „wie ein heißes Messer durch Butter gleitet.“[57] und erreicht auch bis dahin unzugängliche Körperregionen. Schon wenige Minuten nach dem Auftragen auf die Haut riecht der Atem des Patienten nach Knoblauch.[57] Es dient daher als Trägersubstanz bei auf der Haut angewendeten Arzneimitteln (Salben, Gele, Pflaster, Tinkturen) zur Einschleusung der Wirkstoffe wie Schmerzmittel[58] als sogenannter Transportvermittler (auch Penetrationsverstärker oder Schleppersubstanz genannt), d. h., in DMSO gelöste Substanzen werden leicht vom Organismus durch die Haut aufgenommen.[59]
Die guten Penetrations- und Transporteigenschaften von DMSO können sich in Kombinationspräparaten auch negativ auswirken:
Zwei junge Mädchen litten an unerklärlichem Haarausfall. Beide hatten – die eine nur kurzfristig, die andere zwei Jahre lang – einzelne Warzen mit einer Warzentinktur aus Fluorouracil, Salizylsäure und DMSO behandelt. Wegen eines messbaren Serumspiegels von Fluorouracil und nach Ausschluss anderer Ursachen musste man schließlich davon ausgehen, dass das gut resorbierte Zytostatikum Fluorouracil den Haarausfall bewirkt hatte – eine seiner typischen Nebenwirkungen.[60]
Eine unerwünschte Penetration kann auch bei Giften eintreten, die sonst keine oder schwach wirksame Kontaktgifte darstellen, wie Cyanide.[61] Daher müssen Lösungen von als toxisch geltenden Verbindungen sofort, wenn diese auf die Haut gelangen, mit geeigneten Mitteln (z. B. Wasser) abgespült werden.
Alternativmedizin
DMSO wird in der Alternativmedizin vermarktet. Seine Popularität als alternatives Heilmittel soll auf eine 60-Minuten-Dokumentation aus dem Jahr 1980 zurückgehen, in der ein früher Befürworter zu Wort kam.[62] DMSO ist jedoch Bestandteil einiger Produkte, die von der US-amerikanischen Arzneimittelbehörde FDA als gefälschte Krebsmedikamente gelistet sind,[63] und die FDA setzt sich mit den Vertreibern juristisch auseinander.[62] Die Verwendung von DMSO als alternative Behandlung von Krebs ist besonders besorgniserregend, da es nachweislich mit einer Reihe von Chemotherapie-Medikamenten, einschließlich Cisplatin, Carboplatin und Oxaliplatin, interferiert.[64]
Außerhalb der Alternativmedizin gibt es keine Beweise für irgendeine Heilwirkung von DMSO, außer dass es bei Blutergüssen zum schnellen Abschwellen beiträgt[54] und bei Hirnödemen zu therapeutischen Teilerfolgen geführt hat[50].
Vergiftungen und Nebenwirkungen
Auf Nachfrage von MedWatch teilte das Bundesinstitut für Risikobewertung (BfR) mit, dass ihm in Deutschland Vergiftungsfälle im zweistelligen Bereich nach Hautkontakt oder Einnahme von DMSO bekannt seien.[37] Auch wurden auffällige Laborwerte der Leber und Niere nach der Anwendung beobachtet. Es ist ein Fall in Deutschland bekannt, bei dem die orale Verwendung von DMSO zum Tode führte.[65] Da Schäden an Leber, Nieren oder Gehirn nicht ausgeschlossen werden können, wird dringend von der Selbstmedikation mit DMSO abgeraten.[37][66][67]
Bei der Anwendung wird DMSO im Körper zu Dimethylsulfid (DMS) und Dimethylsulfon metabolisiert. Das Ausscheiden von DMS über die Lunge und Haut kann diverse unerwünschte Wirkungen verursachen. Dazu gehören allergische Reaktionen, Rötungen, Juckreiz, Brennen, ein knoblauchartiger Mund- und Körpergeruch sowie Verdauungsstörungen wie Übelkeit, Erbrechen, Durchfall, Verstopfung und Appetitmangel. Weiterhin kann Dimethylsulfoxid die Freisetzung von Histamin erhöhen. Für Kinder, in der Schwangerschaft und Stillzeit gilt die Anwendung als nicht sicher. Erste-Hilfe-Maßnahmen beinhalten, die kontaminierte Kleidung zu entfernen, die in Kontakt gekommenen Körperteile mit viel Wasser zu spülen und, sobald Beschwerden auftreten, zum Arzt zu gehen.[37][68]
Weblinks
- MedWatch: DMSO – Finger weg von Selbstmedikation
- PubMed-Suche mit Stichwort „Dimethyl Sulfoxide“ im Titel (ohne Berücksichtigung des Folgeworts): 2742 Ergebnisse (1962–2023).
Einzelnachweise
- ↑ a b c d e f g h Eintrag zu CAS-Nr. 67-68-5 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 17. April 2018. (JavaScript erforderlich)
- ↑ a b Bruce W. Halstead, Sylvia A. Youngberg: The DMSO Handbook. Golden Quill Publishers, 1981, ISBN 978-0-933904-08-8, S. 29 (englisch).
- ↑ Hans Beyer, Wolfgang Walter: Lehrbuch der Organischen Chemie. 23. Auflage. S. Hirzel Verlag, Stuttgart 1998, ISBN 3-7776-0808-4.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Dipole Moments, S. 9-55.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-210.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 67-68-5 bzw. Dimethylsulfoxid), abgerufen am 2. November 2015.
- ↑ Eintrag zu Dimethyl sulfoxide in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM), abgerufen am 25. März 2021. (Seite nicht mehr abrufbar)
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-22.
- ↑ a b c d e Eintrag zu Dimethylsulfoxid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. Juni 2014.
- ↑ a b Dieter Martin, Hermann Hauthal: Dimethylsulfoxid. Akademie-Verlag, Berlin 1971.
- ↑ Sicherheitsdatenblatt gemäß 1907/2006/EG, Artikel 31 (PDF), auf itwreagents.com
- ↑ GisChem: 01_0-000067-68-5-000000_1_1_95.PDF Dimethylsulfoxid, abgerufen am 28. Juli 2024
- ↑ Dimethylsulfoxid (USP, BP, Ph. Eur.) Pharmaqualität. In: itwreagents.com. Abgerufen am 28. Juli 2024.
- ↑ Thomas B. Douglas: Heats of Formation of Liquid Methyl Sulfoxide and Crystalline Methyl Sulfone at 18 deg. In: J. Am. Chem. Soc. 68, 1946, S. 1072–1076, doi:10.1021/ja01210a046.
- ↑ H. L. Clever, E. F. Westrum, Jr.: Dimethylsulfoxide and dimethylsulfone. Heat capacities, enthalpies of fusion, and thermodynamic properties. In: J. Phys. Chem. 74, 1970, S. 1309–1317, doi:10.1021/j100701a027.
- ↑ B. Kaczmarek, A. Radecki: Vapor-Liquid Equilibria in Binary Systems Containing Ethanol with Tetramethyldisiloxane and Dimethyl Sulfoxide. In: J. Chem. Eng. Data. 34, 1989, S. 195–197, doi:10.1021/je00056a014.
- ↑ G. Jakli, W. A. van Hook: The Vapor Pressures of Dimethyl Sulfoxide and Hexadeuterodimethyl Sulfoxide from about 313 to 453 K. In: J. Chem. Thermodyn. 4, 1972, S. 857–864, doi:10.1016/0021-9614(72)90007-9.
- ↑ Thomas B. Douglas: Vapor Pressure of Methyl Sulfoxide from 20 to 50°. Calculation of the Heat of Vaporization. In: J. Am. Chem. Soc. 70, 1948, S. 2001–2002, doi:10.1021/ja01186a005.
- ↑ a b c d Roth/Weller: Gefährliche Chemische Reaktionen. ecomed Sicherheit, Verlagsgruppe Hüthig Jehle Rehm, Landsberg/Lech, 31. Ergänzungslieferung 8/2000.
- ↑ I. Iwai, J. Ide: 2,3-Diphenyl-1,3-Butadiene In: Organic Syntheses. 50, 1970, S. 62, doi:10.15227/orgsyn.050.0062; Coll. Vol. 6, 1988, S. 531 (PDF).
- ↑ E. M. Kaiser, R. D. Beard, C. R. Hauser: Preparation and reactions of the mono- and dialkali salts of dimethyl sulfone, dimethyl sulfoxide, and related compounds. In: J. Organomet. Chem. 59, 1973, S. 53. doi:10.1016/S0022-328X(00)95020-4.
- ↑ a b c Elisabeth Brandes, Wolfgang Möller: Sicherheitstechnische Kenngrößen. Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft, Bremerhaven 2003, ISBN 3-89701-745-8.
- ↑ Paul M. Osterberg, Jeffry K. Niemeier, Christopher J. Welch, Joel M. Hawkins, Joseph R. Martinelli, Thomas E. Johnson, Thatcher W. Root, Shannon S. Stahl: Experimental Limiting Oxygen Concentrations for Nine Organic Solvents at Temperatures and Pressures Relevant to Aerobic Oxidations in the Pharmaceutical Industry. In: Org. Process Res. Dev. 19, 2015, S. 1537–1542. doi:10.1021/op500328f
- ↑ Hsu-Fang Chen, Chan-Cheng Chen: A quantitative structure activity relationship model for predicting minimum ignition energy of organic substance in J. Loss Prev. Proc. Ind. 67 (2020) 104227, doi:10.1016/j.jlp.2020.104227.
- ↑ Technische Regel für Gefahrstoffe TRGS 727, BG RCI Merkblatt T033 Vermeidung von Zündgefahren infolge elektrostatischer Aufladungen, Stand August 2016, Jedermann-Verlag Heidelberg, ISBN 978-3-86825-103-6.
- ↑ Dimethyl Sulfoxide (DMSO) Solubility Data. (PDF) Gaylord Chemical Company, Bulletin 102, Juni 2014, S. 14.
- ↑ David H. Yawn: Cryopreservation. In: Britannica Online. Abgerufen am 14. Mai 2009.
- ↑ X. Yao, S. Matosevic: Cryopreservation of NK and T Cells Without DMSO for Adoptive Cell-Based Immunotherapy. In: BioDrugs : clinical immunotherapeutics, biopharmaceuticals and gene therapy. Band 35, Nummer 5, September 2021, S. 529–545, doi:10.1007/s40259-021-00494-7, PMID 34427899.
- ↑ Derek Lowe: The Miracle Solvent. In: In the Pipeline (Blog). 20. Mai 2008 (englisch, sciencemag.org).
- ↑ Der Spiegel 48/1965 (23. November 1965). Digitalisat
- ↑ Dimethyl Sulfoxide in Musculoskeletal Disorders. In: JAMA. 26. April 1965, abgerufen am 14. April 2023.
- ↑ Schering AG (Berlin), Squibb/von Heyden AG (München), Mack (Illertissen), Sharp & Dohme GmbH (München), Grünenthal
- ↑ Spätere Pressemitteilung von Schering, zit. n. Der Spiegel.
- ↑ Zit. n. Der Spiegel.
- ↑ Zit. n. Der Spiegel.
- ↑ zit. n. Der Spiegel.
- ↑ a b c d Carolin Sage: DMSO – Finger weg von Selbstmedikation. In: MedWatch. 2. Juni 2023, abgerufen am 6. Januar 2024 (deutsch).
- ↑ Firmennamen von dimethylsulfoxidhaltigen Externa, die während der Zulassungsphase legal in Deutschland verkauft wurden:
- Infiltrina
- Dolicur
- Hyadur
- Somipront u. a. (s. Rote Liste 1965)
- ↑ Gesundheitsreform: Rezeptpflichtiges Medizinprodukt statt Arzneimittel? 11. Januar 2004, abgerufen am 5. Januar 2024.
- ↑ DrugBase: Dolobene Gel: Rückruf aller Chargen und Packungsgrößen. Abgerufen am 5. Januar 2024.
- ↑ a b Dr. Annina Bergner: Dimethylsulfoxid – kein neues Wundermittel. In: www.ptaheute.de. Deutscher Apotheker Verlag Dr. Roland Schmiedel GmbH & Co. KG, 15. Oktober 2019, abgerufen am 5. Januar 2024.
- ↑ Gelbe Liste Online: Dimethylsulfoxid - Wirkstoff & Medikamente | Gelbe Liste. Abgerufen am 5. Januar 2024.
- ↑ wie Ethanol, Ethylacetat, Pyroxylin etc.
- ↑ Rote Liste. Abgerufen am 5. Januar 2024.
- ↑ z. B. Dolobene® ratiopharm Gel
- ↑ z. B. Dolobene® pur
- ↑ Gesundheitsreform: Rezeptpflichtiges Medizinprodukt statt Arzneimittel? In: deutsche-apotheker-zeitung.de. DAZ.online, 2004, abgerufen am 28. Juli 2024.
- ↑ Maria Karim et al.: Dimethyl sulfoxide (DMSO): a solvent that may solve selected cutaneous clinical challenges. Archives of Dermatological Research 2022. doi:10.1007/s00403-022-02494-1
- ↑ Dolobene Pur drug & pharmaceuticals. Available Forms, Doses, Prices. In: sdrugs.com. Abgerufen am 28. Juli 2024 (englisch).
- ↑ a b A. Kulah, M. Akar, L. Baykut: Dimethyl sulfoxide in the management of patient with brain swelling and increased intracranial pressure after severe closed head injury. Neurochirurgia (Stuttg), November 1990; 33(6):177–80. doi:10.1055/s-2008-1053579
- ↑ Shing-Hwa Huang, Chih-Hsiung Wu, Shyi-Jou Chen, Huey-Kang Sytwu, Gu-Jiun Lin: Immunomodulatory effects and potential clinical applications of dimethyl sulfoxide. In: Immunobiology. Band 225, Nr. 3, Mai 2020, S. 151906, doi:10.1016/j.imbio.2020.151906.
- ↑ In Lösung bringen. 6. Oktober 2016, abgerufen am 5. Januar 2024.
- ↑ a b In Deutschland nicht zugelassen
- ↑ a b Arnd Krüger: DMSO. In: Leistungssport. 43, 3, 2013, S. 28.
- ↑ Paulo C. L. Silveira, Eduardo G. Victor, Débora Schefer, Luciano A. Silva, Emilio L. Streck, Marcos M. Paula, Ricardo A. Pinho: Effects of therapeutic pulsed ultrasound and dimethylsulfoxide (DMSO) phonophoresis on parameters of oxidative stress in traumatized muscle. In: Ultrasound in Medicine & Biology. Band 36, Nr. 1, 2010, S. 44–50, doi:10.1016/j.ultrasmedbio.2009.09.001, PMID 19900747.
- ↑ Dimethylsulfoxid (USP, BP, Ph. Eur.) Pharmaqualität. In: itwreagents.com. Abgerufen am 28. Juli 2024.
- ↑ a b TIME 17. September 1965. html-Datei
- ↑ K. Marren: Dimethyl sulfoxide: an effective penetration enhancer for topical administration of NSAIDs. In: The Physician and sportsmedicine. Band 39, Nummer 3, September 2011, S. 75–82, doi:10.3810/psm.2011.09.1923, PMID 22030943.
- ↑ S. Briançon: DMSO als a penetration enhancer. In: Howard I. Maibach, Nina Dragicevic (Hrsg.): Percutaneous Penetration Enhancers Drug Penetration Into/Through the Skin – Methodology and General Considerations. ISBN 978-3-662-53270-6. S. 236.
- ↑ arzneimittelbrief 31, 106–107 (2000)
- ↑ Dimethylsulfoxid (USP, BP, Ph. Eur.) Pharmaqualität. In: itwreagents.com. Abgerufen am 28. Juli 2024.
- ↑ a b William T. Jarvis: DMSO. National Council Against Health Fraud, 24. November 2001.
- ↑ 187 Fake Cancer "Cures" Consumers Should Avoid. In: FDA. Archiviert vom am 23. Juli 2017.
- ↑ M. D. Hall, K. A. Telma, K. E. Chang, T. D. Lee, J. P. Madigan, J. R. Lloyd, I. S. Goldlust, J. D. Hoeschele, M. M. Gottesman: Say no to DMSO: dimethylsulfoxide inactivates cisplatin, carboplatin, and other platinum complexes. In: Cancer Research. Band 74, Nummer 14, Juli 2014, S. 3913–3922, doi:10.1158/0008-5472.CAN-14-0247, PMID 24812268, PMC 4153432 (freier Volltext).
- ↑ Glaser, Nina et al.: Fatal outcome after ingestion of dimethyl sulfoxide as a miracle cure. In: Clinical Toxicology. Band 55, Nr. 5, 28. Mai 2017, S. 371–544, doi:10.1080/15563650.2017.1309792.
- ↑ Dimethyl sulfoxide overdose. In: Reactions Weekly. Band 1652, Nr. 1, 1. Mai 2017, S. 126–126, doi:10.1007/s40278-017-30263-2.
- ↑ Bennedikte Kollerup Madsen, Maria Hilscher, Dennis Zetner, Jacob Rosenberg: Adverse reactions of dimethyl sulfoxide in humans: a systematic review. In: F1000Research. Band 7, 2018, S. 1746, doi:10.12688/f1000research.16642.2, PMID 31489176, PMC 6707402 (freier Volltext).
- ↑ DMSO Archive. In: MedWatch. Abgerufen am 11. August 2024 (deutsch).
Auf dieser Seite verwendete Medien
Displayed structural formula of deuterated DMSO (deuterated dimethyl sulfoxide). Created using ACD/ChemSketch 10.0 and Inkscape.
Autor/Urheber: Steffen 962, Lizenz: CC0
Dampfdruckfunktion von Dimethylsulfoxid
Darstellung von Dimethylsulfon
Struktur von Dimethylsulfoxid
Estructura molecular del dimetil sulfóxido