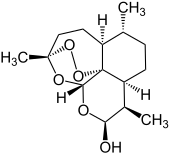
Dihydroartemisinin
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Artenimol[1] | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C15H24O5 | |||||||||||||||||||||
| Kurzbeschreibung | weißer Feststoff[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | P01BE05 | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 284,35 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand | fest[3] | |||||||||||||||||||||
| Schmelzpunkt | 164–165 °C[3] | |||||||||||||||||||||
| Löslichkeit | praktisch unlöslich in Wasser[4] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Dihydroartemisinin (genauer: β-Dihydroartemisinin, internationaler Freiname Artenimol) ist ein Arzneistoff zur Behandlung von Malaria. Es ist ein halbsynthetischer Abkömmling (Derivat) des natürlich vorkommenden Artemisinin und ist auch ein häufiges Zwischenprodukt in der Herstellung anderer Malariamittel auf Artemisinin-Basis.[5] Dihydroartemisinin ist der aktive Metabolit aller Artemisinin-Derivate (Artesunat, Artemether usw.). Es wird in Kombination mit Piperaquin angewendet und hat sich therapeutisch als gleichwertig mit der Kombination Artemether/Lumefantrin erwiesen.[6] Dihydroartemisinin ist seit 2017 auf der Liste der unentbehrlichen Arzneimittel der Weltgesundheitsorganisation aufgeführt.
Medizinische Anwendung
Dihydroartemisinin wird zur Behandlung von Malaria eingesetzt, in der Regel als Kombinationspräparat mit Piperaquin.[7]
Eine systematische Übersichtsarbeit zu den durchgeführten randomisierten kontrollierten Studien zeigte, dass sowohl die Kombination Dihydroartemisinin/Piperaquin als auch die Kombination Artemether/Lumefantrin bei der Behandlung von Malaria sehr wirksam sind. Mit Dihydroartemisinin/Piperaquin werden jedoch etwas mehr Patienten geheilt als mit Artemether/Lumefantrin, und es beugt auch nach der Behandlung länger weiteren Malariainfektionen vor. Dihydroartemisinin/Piperaquin und Artemether/Lumefantrin haben wahrscheinlich ähnliche Nebenwirkungen. Die Studien wurden alle in Afrika durchgeführt. Studien in Asien ergaben, dass Dihydroartemisinin/Piperaquin bei der Behandlung von Malaria genauso wirksam war wie Artesunat plus Mefloquin. Artesunat plus Mefloquin verursacht wahrscheinlich mehr Übelkeit, Erbrechen, Schwindel und Schlaflosigkeit als Dihydroartemisinin-Piperaquin.[8]
Pharmakologie
Der vorgeschlagene Wirkmechanismus von Artemisinin beinhaltet die Spaltung von Endoperoxid-Brücken durch Eisen, wodurch freie Radikale (hypervalente Eisen-Oxo-Spezies, Epoxide, Aldehyde und Dicarbonylverbindungen) entstehen, die biologische Makromoleküle schädigen und oxidativen Stress in den Zellen des Parasiten verursachen.[9] Malaria wird durch Apicomplexa verursacht, in erster Linie durch Plasmodium falciparum, die sich größtenteils in roten Blutkörperchen aufhält und selbst eisenreiche Häm-Gruppen (in Form von Hämozoin) enthält.[10] Im Jahr 2015 wurde gezeigt, dass Artemisinin an eine Vielzahl von Targets bindet, was darauf hindeutet, dass es vielseitig wirkt.[11] Jüngste Forschungen zum Wirkmechanismus haben ergeben, dass Artemisinin durch häm-aktivierte radikalische Alkylierung außerdem ein breites Spektrum von Proteinen im Proteom menschlicher Krebszellen angreift.[11]
Chemie
Dihydroartemisinin hat eine nur geringe Löslichkeit in Wasser von weniger als 0,1 g/L. Die therapeutische Verwendung erfordert daher eine Verbesserung der Verfügbarkeit, etwa durch den Zusatz von Lösungsvermittlern wie Macrogolglycerolricinoleat (Cremophor EL), wodurch zusätzliche unerwünschte Wirkungen entstehen können.[12]
Das Lacton Artemisinin konnte mit milden Hydrid-Reduktionsmitteln wie Natriumborhydrid, Kaliumborhydrid und Lithiumborhydrid selektiv zum Lactol Dihydroartemisinin reduziert werden, mit einer Ausbeute von über 90 %. Es handelt sich um eine neuartige Reduktion, da Lactone normalerweise nicht mit Natriumborhydrid unter den gleichen Reaktionsbedingungen (0–5 ˚C in Methanol) reduziert werden können. Die Reduktion mit Lithiumaluminiumhydrid führt zu einigen umgelagerten Produkten. Überraschenderweise wurde das Lacton reduziert, aber die Peroxygruppe blieb erhalten. Das Lacton von Desoxyartemisinin widerstand jedoch der Reduktion mit Natriumborhydrid und konnte nur mit Diisobutylaluminiumhydrid zu dem Lactol Desoxydihydroartimisinin reduziert werden. Diese Ergebnisse zeigen, dass die Peroxygruppe die Reduktion des Lactons mit Natriumborhydrid zu einem Lactol unterstützt, nicht aber zu dem Alkohol, der das Überreduktionsprodukt ist. Es gibt keine eindeutigen Beweise für diesen Reduktionsprozess.
Einzelnachweise
- ↑ INN Recommended List 43, World Health Organisation (WHO), 9. März 2000.
- ↑ Eintrag zu Dihydroartemisinin bei TCI Europe, abgerufen am 1. März 2022.
- ↑ a b c d Datenblatt Dihydroartemisinin, analytical standard, mixture of α and β isomers bei Sigma-Aldrich, abgerufen am 26. Februar 2022 (PDF).
- ↑ Muhammad Tayyab Ansari, Kevin T. Batty, Ijaz Iqbal, Vivian Bruce Sunderland: Improving the solubility and bioavailability of dihydroartemisinin by solid dispersions and inclusion complexes. In: Archives of Pharmacal Research. Band 34, Nr. 5, 2011, S. 757, doi:10.1007/s12272-011-0509-1.
- ↑ Soon Hyung Woo, Michael H. Parker, Poonsakdi Ploypradith, John Northrop, Gary H. Posner: Direct conversion of pyranose anomeric OH→F→R in the artemisinin family of antimalarial trioxanes. In: Tetrahedron Letters. Band 39, Nr. 12, 19. März 1998, S. 1533–1536, doi:10.1016/S0040-4039(98)00132-4.
- ↑ Emmanuel Arinaitwe, Taylor G. Sandison, Humphrey Wanzira, Abel Kakuru, Jaco Homsy: Artemether-lumefantrine versus dihydroartemisinin-piperaquine for falciparum malaria: a longitudinal, randomized trial in young Ugandan children. In: Clinical Infectious Diseases: An Official Publication of the Infectious Diseases Society of America. Band 49, Nr. 11, 1. Dezember 2009, S. 1629–1637, doi:10.1086/647946, PMID 19877969.
- ↑ Leann Tilley, Judith Straimer, Nina F. Gnädig, Stuart A. Ralph, David A. Fidock: Artemisinin Action and Resistance in Plasmodium falciparum. In: Trends in Parasitology. Band 32, Nr. 9, September 2016, S. 682–696, doi:10.1016/j.pt.2016.05.010, PMID 27289273, PMC 5007624 (freier Volltext).
- ↑ Babalwa Zani, Michael Gathu, Sarah Donegan, Piero L. Olliaro, David Sinclair: Dihydroartemisinin-piperaquine for treating uncomplicated Plasmodium falciparum malaria. In: The Cochrane Database of Systematic Reviews. Nr. 1, 20. Januar 2014, S. CD010927, doi:10.1002/14651858.CD010927, PMID 24443033, PMC 4470355 (freier Volltext).
- ↑ J. N. Cumming, P. Ploypradith, G. H. Posner: Antimalarial activity of artemisinin (qinghaosu) and related trioxanes: mechanism(s) of action. In: Advances in Pharmacology (San Diego, Calif.). Band 37, 1997, S. 253–297, doi:10.1016/s1054-3589(08)60952-7, PMID 8891104.
- ↑ Gary H. Posner, Paul M. O’Neill: Knowledge of the proposed chemical mechanism of action and cytochrome p450 metabolism of antimalarial trioxanes like artemisinin allows rational design of new antimalarial peroxides. In: Accounts of Chemical Research. Band 37, Nr. 6, Juni 2004, S. 397–404, doi:10.1021/ar020227u, PMID 15196049.
- ↑ a b Yiqing Zhou, Weichao Li, Youli Xiao: Profiling of Multiple Targets of Artemisinin Activated by Hemin in Cancer Cell Proteome. In: ACS chemical biology. Band 11, Nr. 4, 15. April 2016, S. 882–888, doi:10.1021/acschembio.5b01043, PMID 26854499.
- ↑ Kefeng Liu, Lin Dai, Chunxiao Li, Jing Liu, Luying Wang: Self-assembled targeted nanoparticles based on transferrin-modified eight-arm-polyethylene glycol-dihydroartemisinin conjugate. In: Scientific Reports. Band 6, 5. Juli 2016, S. 29461, doi:10.1038/srep29461, PMID 27377918, PMC 4932499 (freier Volltext).
Auf dieser Seite verwendete Medien
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
Dihydroartemisinin


