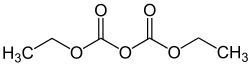
Diethyldicarbonat
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Diethyldicarbonat | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C6H10O5 | |||||||||||||||
| Kurzbeschreibung | farblose Flüssigkeit mit fruchtigem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 162,14 g·mol−1 | |||||||||||||||
| Aggregatzustand | flüssig | |||||||||||||||
| Dichte | 1,12 g·cm−3 bei 25 °C[2] | |||||||||||||||
| Siedepunkt | ||||||||||||||||
| Löslichkeit | langsame Zersetzung in Wasser[1] | |||||||||||||||
| Brechungsindex | 1,3960 (20 °C)[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Diethyldicarbonat, auch Diethylpyrocarbonat (DEPC), ist ein Ester der Pyrokohlensäure (Pyrocarbonat, Dicarbonat).
Verwendung
Diethyldicarbonat wird in der Biochemie und Molekularbiologie zur Inaktivierung von Ribonukleasen (RNasen) verwendet.[5] Bei der Herstellung RNase-freien Wassers wird diesem 0,1 % Diethyldicarbonat zugesetzt. Nach der Inkubation bei Raumtemperatur wird es anschließend autoklaviert. Unverbrauchtes Diethyldicarbonat hydrolysiert bei der Autoklavierung zu Ethanol und Kohlenstoffdioxid. Alternativ können manche fertigen Lösungen mit 0,05 % Diethyldicarbonat angesetzt werden und im Anschluss an eine 12 h Inkubation bei Raumtemperatur autoklaviert werden, wodurch auch mögliche RNase-Kontaminationen aus den Reagenzien inaktiviert werden, nicht aber in Anwesenheit von TRIS oder Thiolen.[6] RNase-freies Wasser wird bei der RNA-Reinigung und bei nachfolgenden Experimenten mit RNA verwendet.
Bis 1973 wurde Diethyldicarbonat in der Getränkeindustrie zur Kaltpasteurisation von Fruchtsäften, Wein und Bier verwendet (Kaltentkeimung). Diethyldicarbonat kann in wässrig-saurer Lösung und in Anwesenheit von Ammoniumionen (NH4+) Ethylurethan bilden, das von der IARC in die Kategorie 2A („wahrscheinlich krebserzeugend für den Menschen“) eingestuft ist.[7] Aus diesem Grund wurde 1973 der Zusatz von Diethyldicarbonat in Getränken verboten. Als Folgewirkstoff wird Dimethyldicarbonat eingesetzt.[8]
Einzelnachweise
- ↑ a b c d Eintrag zu Diethyldicarbonat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 19. November 2022. (JavaScript erforderlich)
- ↑ a b Datenblatt Diethyl pyrocarbonate bei Sigma-Aldrich, abgerufen am 25. März 2011 (PDF).
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-166.
- ↑ Eintrag zu Diethyl pyrocarbonate in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM), abgerufen am 17. August 2021. (Seite nicht mehr abrufbar)
- ↑ Summers, W.C. (1970): A simple method for extraction of RNA from E. coli utilizing diethyl pyrocarbonate. In: Anal. Biochem. 33(2):459–463. PMID 4910776.
- ↑ Gerard Meurant: RNA Methodologies. Academic Press, 2012, ISBN 978-0-323-13779-9. S. 47–112.
- ↑ D. W. Lachenmeier, M. C. Lima, I. C. Nóbrega, J. A. Pereira, F. Kerr-Corrêa, F. Kanteres, J. Rehm: Cancer risk assessment of ethyl carbamate in alcoholic beverages from Brazil with special consideration to the spirits cachaça and tiquira. In: BMC Cancer. Band 10, Juni 2010, S. 266, doi:10.1186/1471-2407-10-266, PMID 20529350, PMC 2892455 (freier Volltext) (Review).
- ↑ Eintrag zu Urethan. In: Römpp Online. Georg Thieme Verlag, abgerufen am 10. März 2014.
Auf dieser Seite verwendete Medien
Strukturformel von Diethyldicarbonat

