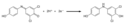2,6-Dichlorphenolindophenol-Natrium
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 2,6-Dichlorphenolindophenol-Natrium | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C12H6Cl2NNaO2 | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 268,1 g·mol−1 | ||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||
| Dichte | 320 kg·m−3 (Schüttdichte Natriumsalz)[2] | ||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
2,6-Dichlorphenol-indophenol-natrium (Natriumsalz von 2,6-Dichlorphenol-indophenol[4]) ist ein Indophenol-Farbstoff. Nach dem deutschen Chemiker Josef Tillmans wird das Salz auch Tillmans-Reagenz oder Tillmans-Blau genannt.
Eigenschaften
Das Natriumsalz von Dichlorphenol-indophenol ist ein dunkelgrüner Feststoff. Wässrige Lösungen des Salzes sind tiefblau. In sauren Lösungen nimmt der Farbstoff eine rote Farbe an.[1] Dichlorphenol-indophenol selber ist in Wasser nicht löslich und kann z. B. durch Eingeben in eine erwärmte Natriumcarbonatlösung in die lösliche Form (Natriumsalz) überführt werden.
Dichlorphenol-indophenol ist ein Oxidationsmittel und kann als Redoxindikator verwendet werden. Der Farbumschlag erfolgt durch eine Redoxreaktion: In der oxidierten Chinonimin-Form ist Dichlorphenol-indophenol blau bzw. rot, in der reduzierten Aminodiphenol-Form farblos (ein Leuko-Farbstoff). Die Überführung in die Leukoform kann man mit Reduktionsmitteln erreichen: Gibt man zu der blauen Lösung von Dichlorphenol-indophenol z. B. Natriumdithionit, so verfärbt sich die Lösung ins Gelbliche. Dieser Vorgang ist mit einem Oxidationsmittel (z. B. Wasserstoffperoxid) wieder umkehrbar. Auch beim längeren Stehen der Lösung mit der Leukoform an der Luft wird diese durch Oxidation mit dem Luftsauerstoff wieder blau. Diese reversiblen Reaktionen entsprechen dem Verfahren bei der Küpenfärberei (Textilfärbung).
Verwendung

Eine Anwendung ist die quantitative Bestimmung von Ascorbinsäure (Vitamin C).[5] Die Ascorbinsäure wird dabei oxidiert und im Gegenzug wird die farbige Dichlorphenol-indophenol-Lösung reduziert und damit entfärbt.[6] Auch Cholinesterase kann so bestimmt werden. Der Verbrauch des Reagens in Redoxreaktionen kann photometrisch bestimmt werden. Dichlorphenol-indophenol kann als Hill-Reagens oder als Redox-Indikator für die Polarographie verwendet werden.[7][8][9] In der Dünnschichtchromatographie dient es als Reagenz für organische Säuren und reduzierende Verbindungen.[1]
Einzelnachweise
- ↑ a b c d Eintrag zu 2,6-Dichlorindophenol-natrium. In: Römpp Online. Georg Thieme Verlag, abgerufen am 27. Juli 2014.
- ↑ a b Eintrag zu 2,6-Dichlorphenolindophenol, Natriumsalz, Dihydrat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 26. Januar 2016. (JavaScript erforderlich)
- ↑ a b Datenblatt Sodium 2,6-dichloroindophenolate hydrate, ACS reagent bei Sigma-Aldrich, abgerufen am 7. Dezember 2019 (PDF).
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 2,6-Dichlorphenolindophenol: CAS-Nr.: 956-48-9, EG-Nr.: 213-479-8, ECHA-InfoCard: 100.012.254, PubChem: 13726, ChemSpider: 10661857, Wikidata: Q420284.
- ↑ S. Ebel und H. J. Roth (Herausgeber): Lexikon der Pharmazie, Georg Thieme Verlag, 1987, S. 643, ISBN 3-13-672201-9.
- ↑ Zur Redoxtitration der Ascorbinsäure mit Tillmans' Reagenz.
- ↑ Aloysius Wild, Volker Schmitt: Biochemische und physiologische Versuche mit Pflanzen für Studium und Unterricht im Fach Biologie. Springer-Verlag, 2012, ISBN 978-3-8274-2819-6, S. 433 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Georg Arends, Heinrich Zörnig, Hermann Hager, Georg Frerichs, Walther Kern: Hagers Handbuch der pharmazeutischen Praxis Für Apotheker, Arzneimittelhersteller, Drogisten, Ärzte u. Medizinalbeamte. Springer-Verlag, 1958, ISBN 978-3-662-36329-4, S. 104 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Lutz Nover, Elmar W. Weiler: Allgemeine und molekulare Botanik. Georg Thieme Verlag, 2008, ISBN 3-13-152791-9, S. 256 (eingeschränkte Vorschau in der Google-Buchsuche).
Auf dieser Seite verwendete Medien
Reaction scheme for the reduction of DCPIP
Z-Schema der Lichtreaktion mit Angriffspunkten der Photosystem-II-Hemmer. DPC=Diphenylcarbazid, DCPIP=2,6-Dichlorphenolindophenol, DBMIB=Dibromthymochinon
Tillmans-Reagenz, Natriumsalz von 2,6-Dichlorphenol-indophenol