Dichloracetaldehyd
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Dichloracetaldehyd | |||||||||||||||
| Andere Namen | 2,2-Dichloracetaldehyd | |||||||||||||||
| Summenformel | C2H2Cl2O | |||||||||||||||
| Kurzbeschreibung | farblose Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 112,94 g·mol−1 | |||||||||||||||
| Aggregatzustand | flüssig[1] | |||||||||||||||
| Dichte | 1,4 g/ml[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | 88 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit | leicht in Wasser (140 g·l−1 bei 20 °C)[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Dichloracetaldehyd ist eine chemische Verbindung aus der Gruppe der Aldehyde. Er ist neben dem Monochloracetaldehyd und Trichloracetaldehyd einer der drei möglichen chlorierten Acetaldehyde.
Gewinnung und Darstellung
Dichloracetaldehyd kann durch Chlorierung von Acetaldehyd oder Paraldehyd gewonnen werden. Die Hypochlorierung von 1,2-Dichlorethylen mittels Chlor und Wasser liefert reinen Dichloracetaldehyd.[2][3]
Eigenschaften
Dichloracetaldehyd ist eine leicht flüchtige, Flüssigkeit, die in Wasser unter Hydratbildung leicht löslich ist. In Wasser wird ein auch als Monohydrat bezeichnetes Diol, chemisch 2,2-Dichlor-1,1-ethandiol, gebildet.[2] Diese Verbindung bildet farblose Kristalle, die zwischen 35 und 50 °C schmelzen und bei 85 bis 95 °C sieden.[2]
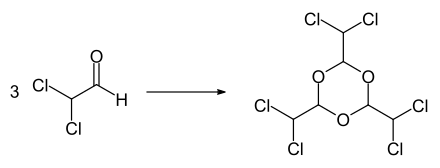
Die Verbindung zersetzt sich bei Erhitzung.[1] In Gegenwart von Lewis-Säuren wie Antimontrichlorid, Eisen(III)-chlorid, Aluminiumtrichlorid, Zinn(IV)-chlorid oder Bortrifluorid kann das Trimere Hexachlorparaldehyd (2,4,6-Tris(dichlormethyl)-1,3,5-trioxan) erhalten werden.[2] Das Trimer bildet farblose Kristalle, die bei 131–132 °C schmelzen. Am Siedepunkt bei 210–220 °C erfolgt eine langsame Rückbildung von Dichloracetaldehyd.[2]
Verwendung
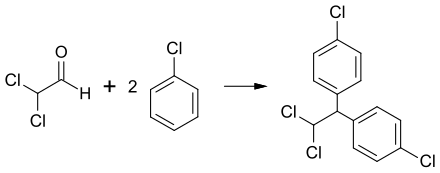
Dichloracetaldehyd wird zur Produktion von anderen chemischen Verbindungen wie Mitotan verwendet.[4] Die Kondensation mit Chlorbenzol ergibt p,p′-Dichlor-1,1-diphenyl-2,2-dichlorethan, welches früher als Insektizid verwendet wurde.[2]
Sicherheitshinweise
Die Dämpfe von Dichloracetaldehyd können mit Luft ein explosionsfähiges Gemisch (Flammpunkt 60 °C) bilden.[1]
Einzelnachweise
- ↑ a b c d e f g h i j Eintrag zu Dichloracetaldehyd in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- ↑ a b c d e f Jira, R.; Kopp, E.; McKusick, B.C.; Röderer, G.; Bosch, A.; Fleischmann, G.: Chloroacetaldehydes in Ullmann's Encyclopedia of Industrial Chemistry, 2012 Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, doi:10.1002/14356007.a06_527.pub2.
- ↑ Eintrag zu Dichloroacetaldehyde in der Hazardous Substances Data Bank (via PubChem), abgerufen am 21. April 2015.
- ↑ Wiley-VCH: Ullmann's Fine Chemicals, 3 Volume Set:. John Wiley & Sons, 2014, ISBN 978-3-527-68359-8, S. 133 (eingeschränkte Vorschau in der Google-Buchsuche).
Auf dieser Seite verwendete Medien
Global harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS): Piktogramm für giftige / toxische Chemikalien
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Globales Harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS) Piktogramm für gesundheitsgefährdende Stoffe.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
Strukturformel von Dichloracetaldehyd
Bildung der Dichloracetaldehyd-Monohydrat
Bildung von Hexachlorparaldehyd aus Dichloracetaldehyd
Synthesis of Dichlorodiphenyldichloroethane