Cytochrom c
| Cytochrom c | ||
|---|---|---|
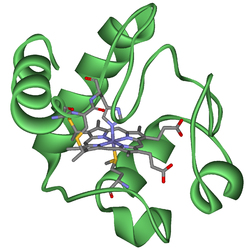 | ||
| Bändermodell des Cytochrom c mit der prosthetischen Gruppe Häm c als Stäbchenmodell. | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 104 Aminosäuren | |
| Kofaktor | Häm | |
| Bezeichner | ||
| Gen-Name | CYCS | |
| Externe IDs | ||
| Vorkommen | ||
| Übergeordnetes Taxon | Lebewesen[1] | |
Cytochrom c ist ein kleines Protein aus der Familie der Cytochrome, das in den Mitochondrien bei der oxidativen Phosphorylierung (Energiegewinnung) eine entscheidende Rolle als Elektronencarrier (Elektronentransporter) spielt. Orthologe des Cytochrom c kommen in allen Lebewesen als Mono- und Multimere vor. Beim Menschen sind Mutationen im CYCS-Gen mögliche Ursache für Cytochrom c-Mangel und familiäre Thrombozytopenie.[2]
Struktur
Die Primärstruktur des humanen Cytochrom c besteht aus 104 Aminosäuren. Das Cytochrom c besitzt als prosthetische Gruppe ein Häm c, das über zwei Thioether-Brücken an zwei Cystein-Reste im Protein gebunden ist. Das zentrale Eisen(II)-Ion (Fe2+) ist oktaedrisch komplexiert über koordinative Bindungen zu den vier Stickstoff-Atomen (äquatorial) der Pyrrole im Porphyrin und axial zu einem Stickstoff-Atom eines Histidin-Restes und zu einem Schwefel-Atom eines Methionin-Restes im Protein.[2]
Die Häm-Gruppe ist außerdem für die rote Farbe des Cytochrom c verantwortlich. Für Cytochrom c wurde auch eine molten-Globule-Struktur beschrieben.
Funktion
Das Enzym Cytochrom-c-Reduktase (Komplex III der Atmungskette) oxidiert über den Q-Zyklus ein Molekül Coenzym Q (CoQ) in der inneren Membran der Mitochondrien und reduziert dabei zwei Moleküle Cytochrom c, die sich im Intermembranraum befinden. Das Enzym Cytochrom-c-Oxidase (Komplex IV der Atmungskette) oxidiert vier Moleküle Cytochrom c und reduziert dabei ein Molekül Sauerstoff zu zwei Molekülen Wasser.
Bei Beschädigung der Mitochondrien wird Cytochrom c durch die äußere Membran hindurch ins Zytosol abgegeben, wo es über eine Signalkaskade den programmierten Zelltod (Apoptose) auslöst.
Da Cytochrom c in praktisch allen Lebewesen vorkommt und sich seine Primärstruktur zwischen ähnlichen Arten nur in wenigen Aminosäuren unterscheidet, ist es ein wichtiges Mittel zur taxonomischen Einteilung der Lebewesen und ein Indiz für die evolutionäre Entwicklung der Arten. Wichtige Grundlagenarbeiten hierfür wurden von Walter M. Fitch publiziert.[3]
Siehe auch
Enzymkomplexe der Atmungskette:
- Komplex V, auch ATP-Synthase
- Komplex IV, auch Cytochrom-c-Oxidase
- Komplex II, auch Succinat-Dehydrogenase
- Komplex III, auch Cytochrom-c-Reduktase
- Komplex I, auch NADH-Dehydrogenase
Einzelnachweise
- ↑ Homologiegruppe bei OMA
- ↑ a b UniProt P99999
- ↑ Walter M. Fitch: The molecular evolution of cytochrome c in eukaryotes. In: Journal of Molecular Evolution, Band 8, Nr. 1, 1976, S. 13–40, doi:10.1007/BF01738880
Literatur
- I. Bertini et al. (2006): Cytochrome c: occurrence and functions. In: Chemical Reviews. Bd. 106, S. 90–115. PMID 16402772.
Auf dieser Seite verwendete Medien
Struktur des Proteins Cytochrom c mit der prosthetischen Gruppe Häm c
Häm c


