Cystathionin-β-Synthase
| Cystathionin-β-Synthase | ||
|---|---|---|
 | ||
| Tertiärstruktur der humanen Cystathionin-β-Synthase nach PDB 1JBQ | ||
| Andere Namen |
| |
Vorhandene Strukturdaten: 1JBQ, 1M54, 4COO, 4L0D, 4L27, 4L28, 4L3V, 4PCU, 4UUU | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 551 Aminosäuren, 60587 Da (Isoform 1) 565 Aminosäuren, 61863 Da (Isoform 2) | |
| Sekundär- bis Quartärstruktur | Homodimer | |
| Kofaktor | Pyridoxalphosphat, Häm | |
| Isoformen | 2 | |
| Bezeichner | ||
| Gen-Namen | CBS HIP4 | |
| Externe IDs |
| |
| Enzymklassifikation | ||
| EC, Kategorie | 4.2.1.22, Lyase | |
| Reaktionsart | Transsulfurierung | |
| Substrat | Homocystein, Serin | |
| Produkte | Cystathionin, Wasser | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 875 | 12411 |
| Ensembl | ENSG00000160200 | ENSMUSG00000024039 |
| UniProt | P35520 | Q91WT9 |
| Refseq (mRNA) | NM_000071 | NM_001271353 |
| Refseq (Protein) | NP_000062 | NP_001258282 |
| Genlocus | Chr 21: 6.44 – 6.47 Mb | Chr 17: 31.61 – 31.64 Mb |
| PubMed-Suche | 875 | 12411 |
Die Cystathionin-β-Synthase (CBS) ist ein Enzym aus der Gruppe der Lyasen, das an der Übertragung von Schwefelhaltigen Molekülen (Transsulfurierung) im Aminosäurestoffwechsel beteiligt ist.
Eigenschaften
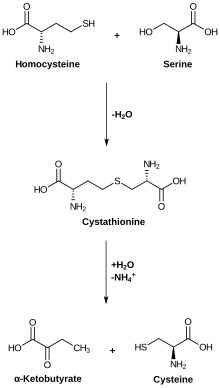
Die Cystathionin-β-Synthase katalysiert die Kopplung von Homocystein an Serin, wodurch unter Abgang eines Wassermoleküls Cystathionin entsteht.[1] Als Cofaktor wird Pyridoxalphosphat (PLP) und Häm verwendet.[1] Die Cystathionin-β-Synthase wird durch S-Adenosylmethionin allosterisch aktiviert.[1] Sie enthält an Proteindomänen ein aktives Zentrum und zwei CBS-Domänen. Eine eingeschränkte Funktion der CBS führt zu Cysteinurie und Homocysteinurie und einem erhöhten Risiko für Herz-Kreislauf-Erkrankungen.[1] Mutationen im Gen CBS sind mit Homocysteinurie assoziiert.[2] In Tieren wird die CBS hauptsächlich in der Leber gebildet.[3] Die Mutation T833C ist mit einem erhöhten Risiko für einen Schlaganfall assoziiert.[4] Die Genexpression der CBS wird durch den Transkriptionsfaktor Farnesoid-X-Rezeptor eingeleitet.[1] In manchen Tumorzellen wird die CBS überexprimiert.[5]
Die Cystathionin-β-Synthase gehört zu den L-Serin-Hydrolyasen. Ursprünglich war 1961 eine Methylcystein-Synthase mit der EC-Nummer EC 4.2.1.23 klassifiziert worden. Dabei handelte es sich jedoch um eine Nebenreaktion der Cystathionin-β-Synthase, weshalb die EC-Nummer 1972 gelöscht wurde.[6]
Einzelnachweise
- ↑ a b c d e B. Renga: Hydrogen sulfide generation in mammals: the molecular biology of cystathionine-β- synthase (CBS) and cystathionine-γ-lyase (CSE). In: Inflammation & allergy drug targets. Band 10, Nummer 2, April 2011, S. 85–91, PMID 21275900.
- ↑ Janosík M, Kery V, Gaustadnes M, Maclean KN, Kraus JP: Regulation of human cystathionine beta-synthase by S-adenosyl-L-methionine: evidence for two catalytically active conformations involving an autoinhibitory domain in the C-terminal region. In: Biochemistry. 40, Nr. 35, September 2001, S. 10625–33. doi:10.1021/bi010711p. PMID 11524006.
- ↑ M. Dziegelewska, S. Holtze, C. Vole, U. Wachter, U. Menzel, M. Morhart, M. Groth, K. Szafranski, A. Sahm, C. Sponholz, P. Dammann, K. Huse, T. Hildebrandt, M. Platzer: Low sulfide levels and a high degree of cystathionine β-synthase (CBS) activation by S-adenosylmethionine (SAM) in the long-lived naked mole-rat. In: Redox biology. [elektronische Veröffentlichung vor dem Druck] Januar 2016, doi:10.1016/j.redox.2016.01.008, PMID 26803480.
- ↑ R. Ding, S. Lin, D. Chen: The association of cystathionine β synthase (CBS) T833C polymorphism and the risk of stroke: a meta-analysis. In: Journal of the neurological sciences. Band 312, Nummer 1–2, Januar 2012, S. 26–30, doi:10.1016/j.jns.2011.08.029, PMID 21917271.
- ↑ M. R. Hellmich, C. Coletta, C. Chao, C. Szabo: The therapeutic potential of cystathionine β-synthetase/hydrogen sulfide inhibition in cancer. In: Antioxidants & redox signaling. Band 22, Nummer 5, Februar 2015, S. 424–448, doi:10.1089/ars.2014.5933, PMID 24730679, PMC 4307161 (freier Volltext).
- ↑ IUBMB: EC 4.2.1.23
Auf dieser Seite verwendete Medien
protein structure image
Biosynthese von Cystein aus Homocystein und Serin über Cystathion als Zwischenprodukt.