Cyclopropan
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Cyclopropan | |||||||||||||||||||||
| Andere Namen | Trimethylen | |||||||||||||||||||||
| Summenformel | C3H6 | |||||||||||||||||||||
| Kurzbeschreibung | farbloses Gas mit petroletherähnlichem Geruch [1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 42,08 g·mol−1 [1] | |||||||||||||||||||||
| Aggregatzustand | gasförmig | |||||||||||||||||||||
| Dichte | ||||||||||||||||||||||
| Schmelzpunkt | −127,62 °C [1] | |||||||||||||||||||||
| Siedepunkt | −32,9 °C [1] | |||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Dipolmoment | 0[2] | |||||||||||||||||||||
| Brechungsindex | 1,3799 (−42 °C)[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK | nicht festgelegt [1] | |||||||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||||||||
| ΔHf0 | 53,3 kJ/mol[5] | |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Cyclopropan ist ein farbloses, gasförmiges Cycloalkan, das erste Glied in dieser Verbindungsklasse.
Entdeckung
Beim Versuch, das Verfahren der Wurtz-Reaktion (Wurtzsche Synthese) auf α,ω-Dihalogenalkane auszudehnen, entdeckte August Freund in Lemberg im Jahre 1882 einen Kohlenwasserstoff mit der Summenformel C3H6, den er Trimethylen nannte.[6]

Gewinnung und Darstellung
Gustavson fand 1887 eine einfachere, ungefährlichere Synthese, indem er zur Enthalogenierung anstelle des bis dahin üblichen Natriummetalls Zinkstaub in wasserhaltigem Ethanol verwendete.[7] Die Herstellung nach diesem Reaktionsprinzip dürfte auch heute noch die günstigste sein; sie wurde optimiert und auch mit 1,3-Dichlorpropan oder dem leicht zugänglichen 1-Brom-3-chlorpropan realisiert.[8]
Eigenschaften
Physikalische Eigenschaften

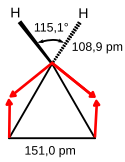
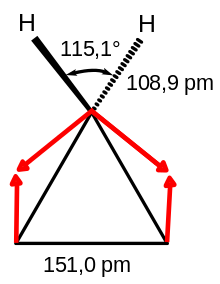
Das Molekül gehört zu der Symmetriegruppe D3h. Eine Strukturbestimmung durch Elektronenbeugung ergab einen Abstand der C-Atome von 151,0 pm. Für die C–H-Bindungslänge wurde ein Wert von 108,9 pm ermittelt, und für den H-C-H-Winkel 115,1°.[9]
Die drei Kohlenstoffatome des Cyclopropans müssen notwendigerweise in einer Ebene liegen. Im klassischen, also nicht-quantenchemischen Baeyer-Modell ist daher eine hohe Winkelspannung zu erwarten, außerdem Torsionsspannung (Pitzer-Spannung) durch die ekliptische Position der Wasserstoffatome. Für die Spannungsenergie werden typischerweise 117 kJ/mol (28 kcal/mol) angegeben[10]. Die Strukturdaten zeigen jedoch, dass beim Cyclopropan besondere Bindungsverhältnisse vorliegen müssen. Einfache Modelle, wie das Baeyer-Modell, sind daher nicht angebracht.
Mit dem Konzept streng lokalisierter Sigma-Bindungen kann Cyclopropan nicht verstanden werden. In dem kleinen Molekül treten Wechselwirkungen der Elektronen auf, welche in den größeren Cycloalkanen keine Rolle spielen. Daher weicht Cyclopropan in den physikalischen und chemischen Eigenschaften stark von anderen Cycloalkanen ab.
Quantenchemische Rechnungen nach ab-initio-Verfahren (siehe Artikel Chemoinformatik) haben ergeben, dass die Elektronenpopulation hohe Werte außerhalb der Kanten des hypothetischen Dreiecks haben, also der Geraden, durch welche man sich die Zentren der C-Atomkerne verbunden denken kann.[11]
Der Physikochemiker Theodor Förster zeigte vermutlich als erster auf, dass beim Cyclopropan die „Valenzrichtung“ von der „Bindungsrichtung“, d. h. der C–C-Bindung in der klassischen Formel, abweicht.[12]
Charles Coulson und W. E. Moffitt entwickelten dieses Orbital-Modell, das später nach ihnen benannt wurde, weiter.[13][14]
Die Valenzorbitale eines sp3-hybridisierten Kohlenstoffatoms bilden Winkel von 109,4° und besitzen 25 % s-Charakter sowie 75 % p-Charakter. Zwei davon werden für die Bindungen zu den Wasserstoffatomen benutzt. Beim Cyclopropan müssten die restlichen Orbitale dreier CH2-Fragmente kombiniert werden. Der Bereich der Überlappung ist dann aber klein und liegt nicht in der Verbindungslinie der C-Atome.

Die Überlappung wird stärker, wenn man Hybridorbitale mit höherem p-Anteil benutzt. Als Optimum ergab sich ein Orbital, welches nur 17 % s-Charakter für die C–C-Bindung, dagegen 33 % s-Charakter für die C–H-Bindungen besitzt, also als sp5-Orbital bezeichnet werden könnte.[15]
Dies führt zum Bild „gebogener“ C–C-Bindungen (engl. bent bonds),[13] die man salopp auch als „Bananenbindungen“ bezeichnet hat. Die Valenzwinkel (Innenwinkel) der C–C–C-Bindungen betragen 104°.

Das Modell erklärt, warum die C–C-Bindungen kürzer sind als beim Cyclohexan und bei geradkettigen gesättigten Kohlenwasserstoffen (Alkanen) und trotzdem schwächer. Der höhere s-Charakter der C–H-Bindungen wirkt sich in der Kraftkonstante der C–H-Bindung (Infrarot- und Ramanspektrum), der Chemischen Verschiebung und Kopplungskonstanten in NMR-Spektren, und der erhöhten C-H-Acidität des Kohlenwasserstoffs aus.
Ein zweites Orbitalmodell wurde von Arthur Donald Walsh entwickelt.[16] Das Walsh-Modell geht von sp2-Hybridorbitalen für die CH2-Gruppe aus; die „gebogenen“ Bindungen entstehen dann durch Überlappung reiner p-Orbitale.
Cyclische Delokalisation der sechs Elektronen der drei CC-σ-Bindungen des Cyclopropans wurde von Michael J. S. Dewar als Erklärung für die gegenüber Cyclobutan vergleichsweise geringe Spannungsenergie („nur“ 115,6 vs. 109,7 kJ/mol, Referenz Cyclohexan mit Esp = 0 kJ/mol[10]) herangezogen (Stabilisierung durch σ-Aromatizität,[17][18] vgl. die cyclische Delokalisation der sechs π-Elektronen im Benzol als Paradebeispiel für Aromatizität). Die Annahme eines diamagnetischen Ringstroms im Cyclopropan wird neben der verringerten Spannungsenergie belegt durch in Abschirmung der Cyclopropan-Protonen im NMR sowie durch seine ungewöhnlichen magnetischen Eigenschaften (hohe diamagnetische Suszeptibilität, hohe Anisotropie der magnetischen Suszeptibilität). Neuere Untersuchungen zum Ausmaß der Stabilisierung von Cyclopropan durch σ-Aromatizität schreiben dem Effekt einen Wert von 11,3 kcal mol−1 (entspr. ca. 47,3 kJ/mol) zu.[19]
Chemische Eigenschaften
Im Vergleich mit höheren Cycloalkanen zeigt Cyclopropan ein besonderes Reaktivitätsmuster: häufig wird eine C–C-Bindung gebrochen. Assoziationsreaktionen sind charakteristisch. Erklärungen wurden unter anderem mit den Konzepten „Spannungsenergie“ und „Walsh-Modell“ gegeben.
Beim Erhitzen von Cyclopropan, welches mit Deuteriumatomen markiert wurde, beobachtete man eine „geometrische Isomerisierung“: cis-1,2-Dideuteriocyclopropan bildet in einer Gleichgewichtsreaktion trans-1,2-Dideuteriocyclopropan.[20][21]

Die Deuteriumatome ändern also ihre Lage (griechisch topos), daher kann man diesen Prozess als Topomerisierung des Moleküls bezeichnen. Ein konzertierter Mechanismus wurde diskutiert.
Bei ca. 500 °C wird Cyclopropan zu Propen umgewandelt. Diese Konstitutionsisomerisierung, untersucht im Bereich von 469,6 bis 518,6 °C, benötigt eine Aktivierungsenergie von ca. 65 kcal mol−1. Als Zwischenstufe wurde ein „Trimethylen-Diradikal“ (Propan-1,3-diyl) postuliert.[22]
An einem Palladiumkatalysator reagiert Cyclopropan mit Wasserstoff zu Propan. Mit Bromwasserstoff (HBr) reagiert es zu 1-Brompropan, was ebenfalls den „olefinischen Charakter“ zeigt. Chlorgas reagiert ebenfalls unter Addition zu 1,3-Dichlorpropan.[23]
Verwendung
Im Jahr 1929 publizierten George Herbert William Lucas (* 1894) und Velyien Ewart Henderson (1877–1944)[24] ihre pharmakologischen Studien zu Cyclopropan (Die kanadischen Forscher hatten 1928 die narkotischen Eigenschaften des Gases als Wirkung auf das Zentralnervensystem entdeckt[25]).[26] Am Menschen angewandt wurde es erstmalig 1930 von Waters und Mitarbeitern[27] von der Universität Wisconsin. In den 1940er Jahren wurde es von den Kanadiern Griffith und Johnson mit Curare kombiniert. In der Vergangenheit wurde Cyclopropan bis etwa 1970 vor allem in Amerika, England und Skandinavien[28] in einer 15–30%igen Mischung mit Sauerstoff als Narkosemittel[29] wegen guter Steuerbarkeit und guter muskelerschlaffender Wirkung vor allem in der Thoraxchirurgie und oberen Abdominalchirurgie angewendet, wovon man heute wegen der Nachteile (Explosivität der Dämpfe, schlechte Steuerbarkeit der Narkose, Kardio- und Hepatotoxizität) absieht.
Sicherheitshinweise
Cyclopropan bildet wie alle niederen Kohlenwasserstoffe mit Luft leicht entzündliche Gemische. Der Explosionsbereich liegt zwischen 2,4 Vol.‑% (40 g/m3) als untere Explosionsgrenze (UEG) und 10,4 Vol.‑% (385 g/m3) als obere Explosionsgrenze (OEG).[30] Die Grenzspaltweite wurde mit 0,91 mm bestimmt.[30] Es resultiert damit eine Zuordnung in die Explosionsgruppe IIA.[30] Mit einer Mindestzündenergie von 0,17 mJ sind Dampf-Luft-Gemische extrem zündfähig.[31] Die Zündtemperatur beträgt 495 °C.[30] Der Stoff fällt somit in die Temperaturklasse T1.
Derivate und Substituenten
Zahlreiche Derivate sind durch chemische Synthese herstellbar, z. B. mit Alkylgruppe als Rest.[32] Sie werden in der Erdölindustrie, der Krebsforschung und anderen wissenschaftlichen Gebieten untersucht.
Die Biosynthese wird durch Cyclopropan-Synthase katalysiert, sodass Mykolsäuren entstehen, die ein wesentlicher Faktor dafür sind, dass Tuberkulose nur schwer mit hydrophoben Antibiotika behandelt werden kann. Das Enzym selbst ist eine Methyltransferase, die mittels S-Adenosylmethionin cis- oder trans-Cyclopropan-Ringe in die dort ungesättigte Fettsäure einbaut.[33]
Weblinks
- Zur Molekülstruktur des Cyclopropans (Webarchiv)
Einzelnachweise
- ↑ a b c d e f g h i j Eintrag zu Cyclopropan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Permittivity (Dielectric Constant) of Gases, S. 6-188.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-132.
- ↑ Eintrag zu Cyclopropane im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-24.
- ↑ August Freund: Über Trimethylen. In: Monatshefte für Chemie und verwandte Teile anderer Wissenschaften. Band 3, Nr. 1, 1882, S. 625–635. doi:10.1007/BF01516828
- ↑ G. Gustavson: Ueber eine neue Darstellungsmethode des Trimethylens. In: Journal für praktische Chemie. Bd. 36 (1887), S. 300–303. doi:10.1002/prac.18870360127
- ↑ D. Wendisch: Carbocyclische Dreiringverbindungen. In: Eugen Müller (Hrsg.): Methoden der Organischen Chemie (Houbel-Weyl). Bd. IV/3, Thieme, Stuttgart 1971, S. 34–36.
- ↑ O. Bastiansen, F. N. Fritsch, K. Hedberg: Least-squares refinement of molecular structures from gaseous electron-diffraction sector-microphotometer data. III. Refinement of cyclopropane. In: Acta Cryst. 17, (1964), S. 538–543. doi:10.1107/S0365110X64001268
- ↑ a b S. W. Benson, Themochemical Kinetics, S. 273, J. Wiley & Sons, New York, London, Sydney, Toronto 1976
- ↑ Grafische Darstellung siehe z. B. bei Martin Klessinger: Elektronenstruktur organischer Moleküle. Verlag Chemie, Weinheim u. a. 1982, ISBN 3-527-25925-2, S. 264–266.
- ↑ Th. Förster: Die gegenseitige Beeinflussung der Valenzen im Kohlenstoffatom. In: Zeitschrift für Physikalische Chemie. Abteilung B, Bd. 43 (1939), S. 58–78.
- ↑ a b C. A. Coulson, W. E. Moffitt: Strain in Non-Tetrahedral Carbon Atoms. In: Journal of Chemical Physics. Bd. 15, (1951), S. 151.
- ↑ C.A. Coulson, W.E. Moffitt: The properties of certain strained hydrocarbons. In: Philosophical Magazine Series. 7, Bd. 40 (1949), Nr. 300, S. 1–35. doi:10.1080/14786444908561208
- ↑ L. Klasinc, Z. Maksić, M. Randić: Bent bonds in cycloalkanes. In: J. Chem. Soc. A. 1966, S. 755–757. doi:10.1039/J19660000755
- ↑ A. D. Walsh: The structures of ethylene oxide, cyclopropane, and related molecules. In: Transactions of the Faraday Society. 45, (1949), S. 179–190, doi:10.1039/TF9494500179
- ↑ M. J. Dewar. Chemical Implicatons of σ Conjugation. In: J. Am. Chem. Soc., 1984, 106, S. 669–682.
- ↑ D. Cremer.Pros and Cons of σ-Aromaticity. In: Tetrahedron, 1988, 44 (2), S. 7427–7454.
- ↑ Kai Exner and Paul von Ragué Schleyer. Theoretical Bond Energies: A Critical Evaluation. In: J. Phys. Chem. A, 2001, 105 (13), S. 3407–3416. doi:10.1021/jp004193o.
- ↑ B. S.Rabinovitch, E. W. Schlag, K. Wiberg: Geometrical and Structural Unimolecular Isomerization of Sym‐Cyclopropane‐d2.In: Journal of Chemical Physics. 28 (1958), S. 504.
- ↑ E. W. Schlag, B. S. Rabinovitch: Kinetics of the Thermal Unimolecular Isomerization Reactions of Cyclopropane-d2. In: Journal of the American Chemical Society. 82 (1960), Nr. 23, S. 5996–6000. doi:10.1021/ja01508a008
- ↑ Thomas Seal Chambers, G. B. Kistiakowsky: Kinetics of the Thermal Isomerization of Cyclopropane. In: Journal of the American Chemical Society. Band 56, 1934, Nr. 2, S. 399–405. doi:10.1021/ja01317a036
- ↑ G. Gustavson: Ueber die Einwirkung des Chlors auf Trimethylen. In: Journal für praktische Chemie. Band 42, 1890, S. 495–500. doi:10.1002/prac.18900420144
- ↑ G. H. W. Lucas, Velyien E. Henderson: A new anaesthetic gas: Cyclopropan. A preliminary report. In: Canadian medical Association Journal. Band 21, 1929, S. 173 ff.
- ↑ H. Orth, I. Kis: Schmerzbekämpfung und Narkose. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 1–32, hier: S. 26.
- ↑ Paul Diepgen, Heinz Goerke: Aschoff/Diepgen/Goerke: Kurze Übersichtstabelle zur Geschichte der Medizin. 7., neubearbeitete Auflage. Springer, Berlin/Göttingen/Heidelberg 1960, S. 66.
- ↑ R. M. Waters, E. R. Schmidt: Cyclopropane anaesthesia. In: Journal of the American Medical Association. Band 103, 1934, S. 975.
- ↑ H. Orth, I. Kis: Schmerzbekämpfung und Narkose. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 1–32, hier: S. 14, 23 und 26.
- ↑ Vgl. auch B. Haid: Die Cyclopropannarkose. In: Der Anaesthesist. Band 2, 1953, S. 128 ff.
- ↑ a b c d E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen – Band 1: Brennbare Flüssigkeiten und Gase, Wirtschaftsverlag NW – Verlag für neue Wissenschaft GmbH, Bremerhaven 2003.
- ↑ Technische Regel für Betriebssicherheit – TRBS 2153, BG RCI Merkblatt T033 Vermeidung von Zündgefahren infolge elektrostatischer Aufladungen, Stand April 2009, Jedermann-Verlag Heidelberg.
- ↑ Geoffrey C. Bond: Metal-Catalysed Reactions of Hydrocarbons. Springer Science & Business Media, 2006, ISBN 978-0-387-26111-9, S. 487 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Tanya Parish: Mycobacterium. Horizon Scientific Press, 2009, ISBN 978-1-904455-40-0, S. 24 (eingeschränkte Vorschau in der Google-Buchsuche).
Auf dieser Seite verwendete Medien
Autor/Urheber: Antimoni, Lizenz: CC BY-SA 3.0
The bended covalent bonds of Cyclopropane.
(c) V8rik in der Wikipedia auf Englisch, CC BY-SA 3.0
Addition Of HBr to Cyclopropane
Cyclopropan
Autor/Urheber: Durfo, Lizenz: CC0
Stereochemical isotopomerization of 1,2-dideuteriocyclopropane
Autor/Urheber: Durfo, Lizenz: CC BY 3.0
Geometry of the cyclopropanone molecule, schematically. The direction (approximately) of the valence, drawn in red, differs from the connection line of the carbon atoms (not shown).
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for gases under pressure
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
Autor/Urheber: V8rik in der Wikipedia auf Englisch, Lizenz: CC BY-SA 3.0
Coulson_Moffit_Model, cyclopropane bent bonds