Cyclooctatetraen
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Cyclooctatetraen | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C8H8 | |||||||||||||||
| Kurzbeschreibung | gelbe Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 104,15 g·mol−1 | |||||||||||||||
| Aggregatzustand | flüssig | |||||||||||||||
| Dichte | 0,93 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | 142–143 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Brechungsindex | 1,5381 (20 °C)[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Cyclooctatetraen (COT) ist eine organisch-chemische Verbindung aus der Gruppe der cyclischen Kohlenwasserstoffe. Die Verbindung mit der Summenformel C8H8 besitzt vier konjugierte C=C-Doppelbindungen.
Im Gegensatz zu Benzol (C6H6) zählt COT nicht zu den aromatischen Kohlenwasserstoffen, da es aufgrund der Anzahl seiner π-Elektronen nicht der Hückel-Regel entspricht und auch nicht planar ist, sondern Wannenform aufweist.
Somit ist Cyclooctatetraen weder ein Aromat, noch ein Antiaromat.[4] Durch die fehlende aromatische Stabilisierung ist es eher den gewöhnlichen Polyenen vergleichbar, allerdings aufgrund der durch die Ringspannung verursachten Bindungswinkeldeformation von erhöhter Reaktivität.
Das wannenförmige COT-Molekül kann als Chelatligand – ähnlich wie 1,5-Cyclooctadien (COD) – Metallkomplexe bilden. Durch die Aufnahme von zwei Elektronen, z. B. durch Übertragung von einem Metall, wird aus dem COT das planare, aromatische Cyclooctatetraenyl-Anion C8H82− mit zehn π-Elektronen und erfüllt damit die Hückel-Regel. Ein bekanntes Beispiel für einen Komplex mit planaren Cyclooctatetraenyl-Liganden ist das Uranocen.
Vorkommen
COT wurde in Tabakrauch nachgewiesen.[5]
Darstellung
- COT wurde erstmals 1905 von Richard Willstätter aus Pseudopelletierin synthetisiert.[6]
- Die gängigste Synthese von COT erfolgt nach einem katalytischen Verfahren von Walter Reppe durch Cyclotetramerisierung von Ethin.[7]
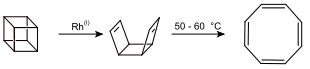
- Eine weitere Synthese geht vom Cuban aus. In Gegenwart von Rhodiumkatalysatoren wird zunächst das syn-Tricyclooctadien gebildet, welches anschließend thermisch bei 50–60 °C zum Cyclooctatetraen umgewandelt werden kann.[8]
Eigenschaften
Durch Erhitzen von Cyclooctatetraen 1 auf 100 °C erhält man ein Gemisch der beiden dimeren C16H16-Verbindungen 2 und 3. Das Dimer 2 (Schmelzpunkt 53 °C) entsteht durch eine Diels-Alder-Reaktion zweier Moleküle Cyclooctatetraen (1). Diese Reaktion ist bei hoher Temperatur teilweise reversibel. In einem zweiten Schritt lagert sich 2 in das Dimer 3 (Schmelzpunkt 76 °C) um.[9]
Aus der pentacyclischen Verbindung 3, die ein Homotropiliden-Strukturelement aufweist, erhält man durch UV-Bestrahlung unter Abspaltung von Benzol 5 den C10H10-Kohlenwasserstoff Bullvalen 4.[10]
Cyclooctatetraen findet Verwendung bei der Synthese von Korksäure und Cyclooctan.[11]
Einzelnachweise
- ↑ a b c d e f Datenblatt Cyclooctatetraen bei Sigma-Aldrich, abgerufen am 12. Oktober 2023 (PDF).
- ↑ a b Datenblatt 1,3,5,7-Cyclooctatetraene, stabilized bei Fisher Scientific, abgerufen am 22. Dezember 2023 (PDF).
- ↑ a b David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-130.
- ↑ Frank-Gerrit Klärner: Wie antiaromatisch ist planares Cyclooctatetraen? In: Angewandte Chemie. Band 113, Nr. 21, 2001, S. 4099–4103, doi:10.1002/1521-3757(20011105)113:21<4099::AID-ANGE4099>3.0.CO;2-1.
- ↑ Alan Rodgman, Thomas A. Perfetti: The Chemical Components of Tobacco and Tobacco Smoke, Second Edition. Taylor & Francis, 2013, ISBN 978-1-4665-1548-2, S. 2107 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Richard Willstätter, Ernst Waser: Über Cyclo-octatetraen. In: Berichte der deutschen chemischen Gesellschaft. Band 44, Nr. 3, 1911, S. 3423–3445, doi:10.1002/cber.191104403216.
- ↑ Walter Reppe, Otto Schlichting, Karl Klager, Tim Toepel: Cyclisierende Polymerisation von Acetylen I. Über Cyclooctatetraen. In: Justus Liebigs Annalen der Chemie. Band 560, Nr. 1, 1948, S. 1–92, doi:10.1002/jlac.19485600102.
- ↑ L. Cessar, P.E. Eaton, J. Halpern: Catalysis of symmetry-restricted reactions by transition metal compounds. Valence isomerization of cubane, In J. Am. Chem. Soc. 92, 1972, S. 3515–3518. doi:10.1021/ja00714a075.
- ↑ Gerhard Schröder: Die Eigenschaften zweier dimerer Cyclooctatetraene vom Schmp. 53 und 76. In: Chemische Berichte. Band 97, Nr. 11, November 1964, S. 3131, doi:10.1002/cber.19640971124.
- ↑ Gerhard Schröder: Synthese und Eigenschaften von Tricyclo[ 3.3.2.04.6]decatrien-(2.7.9)2.3)(Bullvalen). In: Chemische Berichte. Band 97, Nr. 11, November 1964, S. 3140, doi:10.1002/cber.19640971125.
- ↑ Eintrag zu Cyclooctatetraen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 27. September 2019.
Auf dieser Seite verwendete Medien
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
Globales Harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS) Piktogramm für gesundheitsgefährdende Stoffe.
Struktur von Cyclooctatetraen
synthesis of bullvalene from cyclooctatetraene
dreidimensionale Gerüstformel von (all)-Z-Cyclooctatetraen (COT)
Reaktion von Cuban zum Cyclooctatetraen