Cyanursäure
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
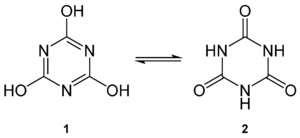 | ||||||||||||||||
| Cyanursäure (1) und die tautomere Form Isocyanursäure (2) | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Cyanursäure | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C3H3N3O3 | |||||||||||||||
| Kurzbeschreibung | weißer, kristalliner Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 129,08 g·mol−1 | |||||||||||||||
| Aggregatzustand | fest | |||||||||||||||
| Dichte | 1,75 g·cm−3 (25 °C, wasserfrei)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit | schwer in Wasser (2 g·l−1 bei 20 °C)[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||

Cyanursäure (1,3,5-Triazin-2,4,6-triol) und Isocyanursäure (1,3,5-Triazin-2,4,6-trion) sind zueinander tautomere chemische Verbindungen der Summenformel C3H3N3O3. Cyanursäure bildet farblose Kristalle, die pro Mol Cyanursäure 2 Mol Kristallwasser enthalten, das an trockener Luft entweicht. Die Verbindung zählt zu den Heterocyclen; Cyanursäure hat aromatischen Charakter.
Gewinnung und Darstellung
Cyanursäure lässt sich durch Hydrolyse von Cyanurchlorid, Zersetzung von Melamin durch Säuren oder durch Erhitzen von Biuret oder Harnstoff auf 200–300 °C gewinnen. Im technischen Maßstab wird Cyanursäure durch Pyrolyse von Harnstoff gewonnen. Die Umsetzung beginnt bei ca. 175 °C.[4]
Im Labor kann Cyanursäure durch die Reaktion von Natriumdichlorisocyanurat mit Salzsäure hergestellt werden. Aus der heißen Reaktionslösung kristallisiert die Cyanursäure aus.[5]

Eigenschaften
Cyanursäure und Isocyanursäure sind das Trimerisierungsprodukt der Cyansäure und liegen im Gleichgewicht vor, was bedeutet, dass eine Form in die andere übergehen kann. Daher können Cyanursäure und Isocyanursäure nur in ihren Derivaten unterschieden werden.
In Wasser ist die Verbindung wenig löslich, wobei der pH-Wert der gesättigten Lösung zwischen 3,8 und 4 liegt.
Bei Erwärmung kann Cyanursäure in einer heftigen Reaktion zu drei Teilen Cyansäure zerfallen.
Verwendung
Insbesondere wird Cyanursäure als Ausgangsstoff für die Trichlorisocyanursäuresynthese verwendet. Diese ist ein wichtiges Desinfektionsmittel und wird auch zur Chlorung von Schwimmbädern benutzt. Problematisch ist dabei die Anreicherung der Cyanursäure im Wasser, da dadurch die Wirksamkeit des Chlors vermindert wird. Bei höheren Konzentrationen der Cyanursäure im Badewasser (ab etwa 40 mg/l) muss die Dosierung von chlorbasierten Desinfektionsmitteln daher erhöht werden, um gleichbleibende Keimtötung zu erzielen.
Cyanursäure findet aber auch bei der Herstellung von Lackhilfsmitteln und als Ausgangsstoff für die Cyansäuregewinnung im Labormaßstab Verwendung.
Isocyanursäure wird als Ausgangsstoff für Herstellung von Triglycidylisocyanurat verwendet, einem Härter für Pulverlacke.
Weblinks
- Beschreibung von Chemical land 21 (englisch)
Einzelnachweise
- ↑ a b c d Eintrag zu Cyanursäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 13. Mai 2017. (JavaScript erforderlich)
- ↑ a b Datenblatt Cyanuric acid bei Sigma-Aldrich, abgerufen am 13. Mai 2017 (PDF).
- ↑ Datenblatt Cyanursäure bei Merck, abgerufen am 19. Januar 2011.
- ↑ Klaus Huthmacher, Dieter Most: Cyanuric Acid and Cyanuric Chloride. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2005. doi:10.1002/14356007.a08_191
- ↑ Science made alive: Chemistry/Experiments. Abgerufen am 22. August 2023.
Auf dieser Seite verwendete Medien
Autor/Urheber: DaChemist66, Lizenz: CC BY-SA 4.0
Dry, white Cyanuric acid crystals in petri dish.
Autor/Urheber: DaChemist66, Lizenz: CC BY-SA 4.0
Kristalle von Cyanursäure nachdem sie erst erhitzt und danach abgekühlt wurden lassen.
Cyanursäure


