Citrullin
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Strukturformel von L-(+)-Citrullin, dem natürlich vorkommenden Enantiomer | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Citrullin | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C6H13N3O3 | |||||||||||||||||||||
| Kurzbeschreibung | weißer kristalliner Feststoff[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | A05BA50 | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 175,19 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand | fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit | gut in Wasser (200 g·l−1 bei 20 °C)[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
L-(+)-Citrullin ist eine nicht-proteinogene α-Aminosäure, die von Pflanzen und Tieren produziert wird. Citrullin ist nach der Wassermelone (Citrullus lanatus) benannt, in der es konzentriert enthalten ist. Es kommt entsprechend auch in anderen Kürbisgewächsen gehäuft vor.[4][5]
Citrullin ist ein Homologes von L-Homocitrullin,[6] das sich von L-Lysin durch Carbamoylierung ableitet.
Enantiomere
Citrullin besitzt ein Stereozentrum, somit existieren zwei chirale Enantiomere.
Wenn in diesem Artikel oder in der wissenschaftlichen Literatur der Begriff „Citrullin“ ohne jeden Zusatz gebraucht wird, ist stets L-(+)-Citrullin gemeint.
| Enantiomere von Citrullin | ||
| Name | L-(+)-Citrullin | D-(–)-Citrullin |
| Andere Namen | (S)-Citrullin | (R)-Citrullin |
| Strukturformel | 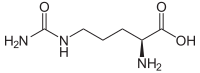 |  |
| CAS-Nummer | 372-75-8 | 13594-51-9 |
| 627-77-0 (Racemat) | ||
| EG-Nummer | 206-759-6 | – |
| 211-012-2 (Racemat) | ||
| ECHA-Infocard | 100.006.145 | – |
| 100.010.012 (Racemat) | ||
| PubChem | 9750 | 637599 |
| 833 (Racemat) | ||
| DrugBank | DB00155 | − |
| − (Racemat) | ||
| Wikidata | Q408641 | Q27077003 |
| Q27102910 (Racemat) | ||
Vorkommen
Es ist ein Zwischenprodukt des Harnstoffzyklus. Es entsteht normalerweise aus L-Ornithin und Carbamoylphosphat unter Abspaltung seines Phosphatrestes durch die Ornithin-Carbamoyl-Transferase. Es reagiert dann unter Spaltung von Adenosintriphosphat weiter mit L-Aspartat (Anion der Asparaginsäure) zu L-Argininosuccinat (Enzym: Argininosuccinat-Synthetase). Aspartat entsteht durch Transaminierung von Oxalacetat und schleust so eine der zwei für den produzierten Harnstoff benötigten Aminogruppen in den Harnstoffzyklus ein. Die andere stammt vom Carbamoylphosphat.
Physiologie
Citrullin wird vom Menschen vermehrt mit dem Urin ausgeschieden, wenn er unter sogenanntem nitrosativen Stress leidet. Nitrosativer Stress ist eine endogene Belastung im Körper des Menschen durch das Stickstoffmonoxid-Radikal. Im Harnstoffzyklus reagiert dann vermehrt Arginin mit Sauerstoff. Diese Reaktion wird enzymatisch durch NO-Synthasen katalysiert. Über das Zwischenprodukt N-Hydroxyarginin entstehen Citrullin und Stickstoffmonoxid.[7] Daher wird Citrullin als Marker für nitrosativen Stress in der medizinischen Diagnostik benutzt.[8]
Citrullinierung
Als Citrullinierung wird die enzymatische Umwandlung von Arginin in Citrullin bezeichnet. Peptidylarginin-Deiminasen (PAD) katalysieren diese posttranslationale Modifikation, die an bestimmten Proteinen und Peptiden stattfindet. Diese citrullinierten Proteine bzw. Peptide können vom Immunsystem als körperfremd angesehen und durch Antikörper angegriffen werden.[9] Citrullinierte Peptide spielen bei der Pathogenese der rheumatoiden Arthritis eine wichtige Rolle.[10][11]
Weblinks
Einzelnachweise
- ↑ Eintrag zu CITRULLINE in der CosIng-Datenbank der EU-Kommission, abgerufen am 22. Oktober 2021.
- ↑ a b c Eintrag zu L(+)-Citrulline bei Thermo Fisher Scientific, abgerufen am 13. Oktober 2023.
- ↑ a b Datenblatt L-Citrulline, ≥98% (TLC) bei Sigma-Aldrich, abgerufen am 13. Februar 2013 (PDF).
- ↑ M. Wada: Über Citrullin, eine neue Aminosäure im Preßsaft der Wassermelone, Citrullus vulgaris schrad. In: Biochemische Zeitschrift. 1930, 224, S. 420–429.
- ↑ G. Klein (Herausgeber, Autor) Handbuch der Pflanzenanalyse, vierter Band / erste Hälfte, spezielle Analyse, dritter Teil, organische Stoffe III – besondere Methoden – Tabellen, 1933, 840, Springer-Verlag, 2. Juli 2013. S. 61–62.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu L-Homocitrullin: CAS-Nr.: 1190-49-4, EG-Nr.: 214-722-0, ECHA-InfoCard: 100.013.384, PubChem: 65072, ChemSpider: 58582, Wikidata: Q18207833.
- ↑ Rassow, Hauser, Netzker, Deutzmann: Biochemie, 3. Auflage, Thieme-Verlagsgruppe, ISBN 978-3-13-125353-8, S. 633.
- ↑ Bodo Kuklinski: Das HWS-Trauma, Aurum Verlag, 2006.
- ↑ P. Migliorini, F. Pratesi u. a.: The immune response to citrullinated antigens in autoimmune diseases. In: Autoimmunity Reviews. Band 4, Nummer 8, November 2005, S. 561–564, doi:10.1016/j.autrev.2005.04.007, PMID 16214096 (Review).
- ↑ R. Yamada, A. Suzuki u. a.: Citrullinated proteins in rheumatoid arthritis. In: Frontiers in bioscience : a journal and virtual library. Band 10, Januar 2005, S. 54–64, PMID 15574347 (Review).
- ↑ T. Gazitt, C. Lood, K. B. Elkon: Citrullination in Rheumatoid Arthritis-A Process Promoted by Neutrophil Lysis? In: Rambam Maimonides medical journal. Band 7, Nummer 4, Oktober 2016, S. , doi:10.5041/RMMJ.10254, PMID 27824546, PMC 5101001 (freier Volltext) (Review).
Auf dieser Seite verwendete Medien
Strukturformel
Struktur von L-Citrullin

