Cinnolin
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Cinnolin | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C8H6N2 | |||||||||||||||
| Kurzbeschreibung | farblose Nadeln[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 130,15 g·mol−1 | |||||||||||||||
| Aggregatzustand | fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
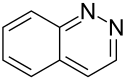
Cinnolin ist eine organische Verbindung, die zu den Heterocyclen (genauer: Heteroaromaten und Diazanaphthalinen) zählt. Die Verbindung besteht aus einem Benzolring, an dem ein Pyridazinring anelliert ist. Cinnolin ist isomer zu Chinazolin, Chinoxalin und Phthalazin.
Herstellung
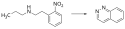
Die Synthese von Cinnolin gelingt über die Elektrolyse von (2-Nitrophenethyl)propylamin. Die Reaktion wird hierbei in einem gepufferten Gemisch aus Methanol und Wasser umgesetzt und liefert Cinnolin in mäßiger Ausbeute:[4]
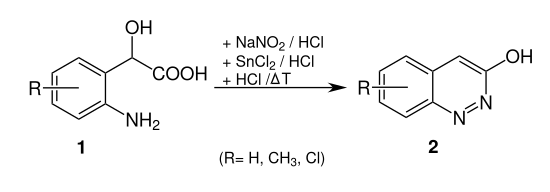
Cinnolin-Derivate kann man auch mittels der Neber-Bössel-Synthese herstellen. Dabei wird z. B. 2-(2-Aminophenyl)-2-hydroxyessigsäure (1, R = H) zu 3-Hydroxylcinnolin (2, R = H) umgesetzt:[5]
Die Borsche-Koelsch-Cinnolinsynthese ausgehend von ortho-Aminoarylketonen eröffnet einen weiteren Zugang zu Cinnolinen.[6]
Derivate
Cinnolin ist die Ausgangsstruktur für viele Derivate.[7]
- Cinnolin-Hydrochlorid C8H6N2·HCl, CAS-Nummer: 5949-24-6
- Cinnolin-4-carbonsäure C9H6N2O2, CAS-Nummer: 21905-86-2
- 4(1H)-Cinnolinon C8H6N2O, CAS-Nummer: 18514-84-6
- Benzo[c]cinnolin C12H8N2, CAS-Nummer: 34524-78-2
- Cinoxacin (ein Antibiotikum)
Einzelnachweise
- ↑ M. Busch, A. Rast: Ueber das Cinnolin., Chem. Ber., 1897, 30, S. 521–527 (doi:10.1002/cber.189703001103).
- ↑ a b J. S. Morley: Cinnolines. Part XX VII. The Preparation and Nitration of Cinnoline., J. Chem. Soc., 1951, S. 1971–1975.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ B. A. Frontana-Uribe, C. Moinet, L. Toupet, Eur. J. Org. Chem. 1999, 2, 419–430.
- ↑ Zerong Wang: Comprehensive Organic Name Reactions and Reagents, Volume 2. John Wiley, Hoboken (N.J.) 2009, ISBN 978-0-470-28662-3, S. 2022–2024.
- ↑ Zerong Wang (Hrsg.): Comprehensive Organic Name Reactions and Reagents. John Wiley & Sons, Hoboken, New Jersey 2010, ISBN 978-0-470-63885-9, Borsche-Koelsch Cinnoline Synthesis, S. 474–477, doi:10.1002/9780470638859.conrr104.
- ↑ Cinnolin-Derivate bei Chemicalland21.
Auf dieser Seite verwendete Medien
Struktur von Cinnolin
Autor/Urheber: TristanOL, Lizenz: CC BY-SA 4.0
Übersichtsreaktion der Neber-Bössel-Synthese
Reaktionsschema zur Darstellung von Cinnolin.