Chytridiomykose
Die Chytridiomykose ist eine Pilzerkrankung (Mykose) bei Amphibien. Erreger sind der Chytridpilz (Batrachochytrium dendrobatidis) und Batrachochytrium salamandrivorans. Ende 1998 wurde sie erstmals im Zusammenhang mit dem weltweiten Amphibiensterben (Global Amphibian Decline) diskutiert,[1] als monokausale Ursache ist dies allerdings umstritten.[2][3]
Krankheitsentstehung
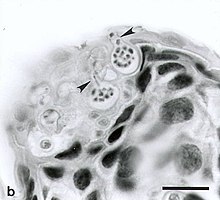
Die Pathogenese ist noch nicht vollständig geklärt. Wahrscheinlich ist es eine starke Beeinträchtigung der biologischen Funktionen der äußeren Haut, des Gas-, Flüssigkeits- und Mineralstoffwechsels sowie der Produktion und Freisetzung von Hautsekreten, so dass die Schutzfunktion nicht mehr gegeben ist.
Die Entwicklung der Sporangien ist Zeichen der Zellreifung des Erregers. Durch eine hyperplastische Reaktion infolge erhöhtem Umsatz epidermaler Zellen und vorzeitiger Verhornung und Zelltod infizierter Zellen kann eine Hyperkeratose entstehen.[4]
Als begünstigend für eine Chytridiomyceten-Infektion wird eine Beeinträchtigung des Abwehrsystems durch verschiedene, meist umweltbedingte Stressfaktoren oder Primärerkrankungen angesehen. Das könnten unter anderem sein:
- Nicht optimale Klima- und Umweltbedingungen (Luftfeuchtigkeit, Frischluft, Temperatur, Lichtqualität und Lichtquantität)
- Stress durch schnelle klimatische Veränderungen
- Unausgewogene und einseitige Ernährung
- Stress durch eine falsch zusammengesetzte Lebensgemeinschaft im Terrarium
- Plötzlicher Umstieg von Trockenzeit auf Regenzeit
- Plötzliche Veränderungen im Lebensraum des Frosches, z. B. ein Umbau der Einrichtung oder ein Umsetzen des Tieres.
- Stresssituationen für das Tier z. B. nicht sachgerechter Transport, Unterernährung etc.
- Primärerkrankungen (z. B. Würmer, Pseudomonaden etc.)
Vorkommen
Die Erkrankung stammt vermutlich aus Afrika und konnte retrospektiv erstmals bei einem Krallenfrosch-Exemplar aus dem Jahre 1938 nachgewiesen werden. Die Chytridiomykose war dann eine stabile Endemie in Südafrika und wurde vermutlich durch den Handel mit Krallenfröschen weltweit verbreitet.[5] Rund 500 Amphibienarten in über 60 Ländern sind von der Krankheit betroffen.[6]
Nachdem der Erreger bei frei lebenden und in menschlicher Obhut gehaltenen Amphibien in Australien, Nord-, Mittel- und Südamerika bekannt geworden ist, werden erstmals Infektionen beschrieben, die bei Terrarientieren in Deutschland und den Niederlanden nachgewiesen wurden. Importierte Pfeilgiftfrösche (D. auratus, D. pumilio) aus Costa Rica und Phyllobates vittatus aus Französisch-Guayana starben aufgrund einer Chytridiomykose innerhalb einer Woche nach Ankunft in Europa. Batrachochytrium wurde ebenfalls bei Fröschen isoliert, die nachweislich aus Terrariennachzuchten (Deutschland, Belgien) stammten. Durch den Befall und die Erkrankung von Tieren, welche nachweislich aus Terrariennachzuchten stammten, steht weiterhin zu vermuten, dass der Erreger bei Amphibien, die in menschlicher Obhut gehalten werden, latent ubiquitär vorhanden ist. Geringe Erregermengen konnten auch bei gesunden Fröschen und Kaulquappen nachgewiesen werden, ohne dass es zum Ausbruch einer Erkrankung kam.
Auch bei fast allen Amphibienarten Europas wurde der Erreger inzwischen nachgewiesen. Untersuchungen zwischen 2003 und 2010 ergaben eine Prävalenz von 7,5 Prozent bei rund 3000 getesteten Individuen in Deutschland. Anders als in Australien und Amerika scheint die Infektion bei europäischen Amphibien aber nur relativ selten zum Ausbruch zu kommen und meist keinen dramatischen Verlauf zu nehmen.[7]
Die Pilzart Batrachochytrium salamandrivorans befällt in Nordwesteuropa – vorwiegend in den Niederlanden – Feuersalamander, die trotz ihrer Hautgifte betroffen sind. In den Niederlanden kam es seit 2010 zu einem Bestandseinbruch von bis zu 96 %. Die Pilzinfektion führt vielfach schon nach sieben Tagen zum Tod der Lurche.[8][9]
Symptome
Die Chytridiomykose äußert sich in Appetitlosigkeit bis Verweigerung der Nahrungsaufnahme, Apathie, eingeschränkter Bewegung, Ataxien, verlängertem Aufenthalt im Wasser und schließlich dem Tod des Tieres.
Hautveränderungen treten nur bei einem Teil der Fälle auf. Die Haut erscheint dann stumpf, gerötet, mit weißlichen Belägen und Verdunklung der Hautfarbe und der Zeichnungsmuster.
Diagnostik
Der Erregernachweis ist nach dem Eintritt des Todes und anhand von Bioptaten sehr einfach, hierbei wird eine histologische Untersuchung nach Hämatoxylin-Eosin-Färbung durchgeführt.
Schwieriger ist die Diagnose nach Abklatsch- oder Abkratzproben mittels PCR.[10] Damit ist besonders der Nachweis bei massivem Befall möglich. Der Befund sollte hierbei aber nur als positiv gelten, wenn gleichzeitig Sporangien nachgewiesen werden.
Inzwischen wurde eine akkurate Methode entwickelt, um den Pilz sowohl qualitativ als auch quantitativ mittels Real time PCR nachzuweisen.[11]
Therapie
Erkrankte oder infektionsgefährdete Tiere mit Antimykotikum z. B. Itraconazol als 10-minütiges Bad täglich über 7–10 Tage behandeln. Terrarien müssen gründlich gereinigt und desinfiziert werden (z. B. mit Benzalkoniumchlorid oder anderen fungiziden Desinfektionsmitteln, durch Hitze, Trockenheit oder 70 % Ethanol).[12]
Ebenso hat sich Chloramphenicol, ein Breitbandantibiotikum, als effektives Mittel zur Therapie selbst stark befallener Tiere herausgestellt, wie neuseeländische Wissenschaftler bei Untersuchungen an Litoria ewingii und Litoria raniformis nachweisen konnten.[13]
Batrachochytrium dendrobatitis überdauert keine Austrocknung. Um eine Ausbreitung dieses Pilzes zu vermeiden, muss mit Wasser in Kontakt kommendes Material, wie Wassersport- oder Angelgerät, komplett getrocknet werden. Ebenso stellt der Handel mit Tieren und Pflanzen aus betroffenen Gewässern sowie deren Verbringung und der folgende Kontakt mit lokaler Fauna ein großes Risiko für B. dendrobatitis-freie Regionen und deren Amphibien dar.
Literatur
- F. Mutschmann u. a.: Chytridiomykose bei Amphibien – erstmaliger Nachweis in Europa. In: Berl Munch Tierarztl Wochenschr. 2000 Oct;113(10), S. 380–383. PMID 11084755 (PDF ( vom 29. September 2007 im Internet Archive))
Einzelnachweise
- ↑ Berger u. a.: Chytridiomycosis causes amphibian mortality associated with population declines in the rain forests of Australia and Central America. In: Proc Natl Acad Sci U S A. 1998 Jul 21;95(15), S. 9031–9036. PMID 9671799.
- ↑ I. Di Rosa u. a.: Ecology: the proximate cause of frog declines? In: Nature. 2007 May 31;447(7144), S. E4–E5, PMID 17538572.
- ↑ R. A. Alford u. a.: Ecology: Global warming and amphibian losses. In: Nature. 2007 May 31;447(7144), S. E3–E4, PMID 17538571.
- ↑ L. Berger u. a.: Life cycle stages of the amphibian chytrid Batrachochytrium dendrobatidis. In: Dis Aquat Organ. 2005 Dec 30;68(1), S. 51–63. PMID 16465834.
- ↑ C. Weldon u. a.: Origin of the amphibian chytrid fungus. In: Emerg Infect Dis. 2004 Dec;10(12), S. 2100–2105. PMID 15663845.
- ↑ Pilzkrankheit sorgt für Massensterben bei Fröschen. In: tagesanzeiger.ch. 12. April 2019, abgerufen am 26. April 2019.
- ↑ Torsten Ohst, Yvonne Gräser, Frank Mutschmann, Jörg Plötner: Neue Erkenntnisse zur Gefährdung europäischer Amphibien durch den Hautpilz Batrachochytrium dendrobatidis. In: Zeitschrift für Feldherpetologie. 18, Laurenti-Verlag, Bielefeld 2011, S. 1–17.
- ↑ Daniel Lingenhöhl: Aggressiver Pilz bedroht Feuersalamander. Meldung bei Spektrum.de vom 2. September 2013.
- ↑ An Martel, Annemarieke Spitzen-van der Sluijs, Mark Blooi u. a.: Batrachochytrium salamandrivorans sp. nov. causes lethal chytridiomycosis in amphibians. In: Proc. Natl. Acad. Sci. 2013. doi:10.1073/pnas.1307356110 (freier Volltextzugriff).
- ↑ R. W. Retallick u. a.: A non-lethal technique for detecting the chytrid fungus Batrachochytrium dendrobatidis on tadpoles. In: Dis Aquat Organ. 2006 Sep 14;72(1), S. 77–85. PMID 17067076.
- ↑ D. G. Boyle u. a.: Rapid quantitative detection of chytridiomycosis (Batrachochytrium dendrobatidis) in amphibian samples using real-time Taqman PCR assay. In: Dis Aquat Organ. 2004 Aug 1;60(2), S. 141–148.
- ↑ M. L. Johnson u. a.: Fungicidal effects of chemical disinfectants, UV light, desiccation and heat on the amphibian chytrid Batrachochytrium dendrobatidis. In: Dis Aquat Organ. 2003 Dec 29;57(3), S. 255–260. PMID 14960039.
- ↑ S. Young, R. Speare, L. Berger, L. F. Skerratt: Chloramphenicol with fluid and electrolyte therapy cures terminally ill green tree frogs (Litoria caerulea) with chytridiomycosis. In: Journal of Zoo and Wildlife Medicine. Band 43, Nummer 2, Juni 2012, S. 330–337, doi:10.1638/2011-0231.1, PMID 22779237.
Weblinks
Auf dieser Seite verwendete Medien
Chytridiomycosis. Ventral skin of upper hind limb of Atelopus varius from western Panama. Two sporangia (spore-containing bodies of Batrachochytrium sp.) containing numerous zoospores are visible within cells of the stratum corneum. Each flask-shaped sporangium has a single characteristic discharge tube (arrow) at the skin surface. Exiting zoospores are visible in the discharge tubes of both sporangia. Hyperkeratosis is minimal in this acute infection. Tissues were fixed in neutral-buffered 10% formalin, paraffin-embedded, sectioned at 6 µm thick and stained with hematoxylin and eosin. Bar = 35 µm.
