Chronic Wasting Disease

Die Chronic Wasting Disease (CWD; englisch chronic wasting disease, deutsch wörtlich Chronische Auszehrungskrankheit) ist eine ansteckende Erkrankung des zentralen Nervensystems bei Hirschen, die zu den spongiformen Enzephalopathien gerechnet wird. Sie ähnelt der Bovinen spongiformen Enzephalopathie (BSE) des Rindes und der Creutzfeldt-Jakob-Krankheit beim Menschen.
Geschichte
Die Chronic Wasting Disease wurde erstmals in den späten 1960er Jahren in einer Herde von Maultierhirschen in Colorado als Syndrom beschrieben. In den späten 1970er Jahren wurde festgestellt, dass es sich dabei um eine spongiforme Enzephalopathie ähnlich der schon lange bekannten Scrapie des Schafs handelt. Umgangssprachlich wird die Krankheit, aufgrund des an Zombies erinnernden Verhaltens erkrankter Tiere, auch mit dem reißerischen Namen Zombie-Krankheit bezeichnet.[1][2]
Verbreitung
Chronic Wasting Disease kommt im westlichen Teil Nordamerikas natürlich vor. Sie befällt wild lebende Maultierhirsche, Weißwedelhirsche und Wapitis in Wyoming, Colorado, Nebraska, South Dakota und Wisconsin. Bei in Gefangenschaft lebenden Hirschherden wurde die Krankheit auch in anderen westlichen Staaten der USA sowie im westlichen Kanada festgestellt. Die Prävalenz kann in befallenen Herden in Gefangenschaft bis zu 100 % betragen; in freier Wildbahn werden Prävalenzen von unter einem bis über 30 Prozent gefunden.
Der erste bekannte europäische Fall war ein weibliches Rentier aus der Nordfjella-Population in Südnorwegen, bei der der Erreger 2016 nachgewiesen wurde.[3][4] Auch in Finnland ist CWD aufgetreten.[5] In Südkorea ist die Krankheit in einer Herde aus Kanada importierter Wapitihirsche aufgetreten.[6]
Erreger
Wie bei den anderen transmissiblen spongiformen Enzephalopathien handelt es sich beim Erreger vermutlich um ein abnorm gefaltetes Prion, das allerdings bisher nicht isoliert werden konnte. Die Übertragung erfolgt von Tier zu Tier; eine Übertragung vom Muttertier auf die Nachkommen kann vorkommen, hat aber für die Übertragung keine große Bedeutung. Experimentell lässt sich CWD durch Injektion von infektiösem Material direkt ins Gehirn auch auf Rinder, Schafe, Ziegen, Frettchen, Nerze, Mäuse, Goldhamster und Totenkopfaffen übertragen.
Die natürliche Infektion erfolgt mutmaßlich auf oralem Weg; das veränderte Protein wird sodann vermutlich durch die Peyer-Plaques des darmassoziierten Immunsystems aufgenommen und wandert wohl über den Nervus vagus ins Gehirn, wo es akkumuliert und nach und nach zur Ausbildung der spongiformen Hirnveränderungen führt.
Es ist unbekannt, auf welchem Weg ein infiziertes Tier das infektiöse Agens wieder ausscheidet, jedoch scheint eine Ausscheidung über den Kot wahrscheinlich. Da Prionen in der Umwelt sehr widerstandsfähig sind, ist es möglich, dass die Akkumulation in der Umwelt – gerade bei Gehegehaltung – eine wichtige Rolle bei der Übertragung spielt. In freier Wildbahn spielen wahrscheinlich auch die Kadaver verendeter Hirsche eine Rolle bei der Übertragung.
Symptome
An CWD erkrankte Hirsche sind normalerweise älter als 16 Monate. Die ersten Symptome sind diskrete, zuerst kaum wahrnehmbare Verhaltensänderungen, gefolgt von Gewichtsverlust. Sie fallen in Gefangenschaft oft dem Pflegepersonal auf. Bei Fortschreiten der Erkrankung kommt es zu Apathie, Somnolenz, Verlust der natürlichen Scheu, zwanghaftem Gehen, vermehrtem Durst und bei Berührung erhöhter Erregbarkeit. Dazu kommen oft Probleme bei der Bewegungskoordination, die sich in Ataxie und Kopf-Tremor äußern. Sekundär kann es aufgrund der Schäden am Nervensystem auch zu einer Aspirationspneumonie kommen, da die Krankheit den Schluckvorgang stört. Während des ganzen Verlaufs der Krankheit kommt es außerdem zu einer progressiven Gewichtsabnahme, die für CWD namensgebend war.
Diagnose

Die Diagnose erfolgt durch eine mikroskopische Untersuchung von Gewebeproben aus dem Gehirn, in denen die charakteristischen schwammartigen Veränderungen des Nervengewebes nachgewiesen werden können. Es existieren auch Routinetests auf der Basis eines ELISA, der auf Nerven- und Lymphgewebe basieren kann.[7] Bei Maultier- und Weisswedelhirschen akkumuliert das Agens in den Retropharyngeallymphknoten, noch bevor es das Gehirn erreicht, so dass dieses Gewebe für einen Test am wichtigsten ist. Im Hirn eignet sich das hintere Ende des vierten Hirnventrikels am besten für den Erregernachweis. Neuere diagnostische Entwicklungen verwenden auch Speichelproben für Tests ante mortem.[8]
Differentialdiagnostisch sollten Tollwut, Hirnabszesse, Meningitis, Enzephalitis, Mangelernährung, Peritonitis und Zahnprobleme in Betracht gezogen werden.
CWD ist sowohl in Nordamerika als auch in Europa eine meldepflichtige Tierseuche.
Behandlung und Vorbeugung
Es existiert keine wirksame Behandlung der Chronic Wasting Disease. Betroffene Tiere müssen gekeult werden. Die Vorbeugung geschieht in Gefangenschaft über entsprechendes Herdenmanagement, das vom kanadischen und US-amerikanischen Veterinäramt koordiniert wird, die für Hirschherden auch entsprechende Zertifikate vergeben. Zum Erreichen der höchsten Zertifikation benötigt eine Herde mindestens fünf Jahre.
Dekontamination
Das Agens ist in der Umwelt sehr stabil. Es wird auch durch die meisten ansonsten zur Desinfektion eingesetzten Mittel – einschließlich Alkohol, Formalin, Wasserstoffperoxid, Ethylenoxid, Chlordioxid, Kaliumpermanganat und phenolische Desinfektionsmittel – nicht unter allen Umständen inaktiviert. Überaus beständig zeigt es sich ebenso gegenüber Hitze wie UV- und ionisierender Strahlung; selbst nach 8 h in kochendem Wasser kann es noch infektiös sein. Zu den wirksamen Dekontaminationstechniken für Oberflächen zählt die mehrstündige Einwirkung stark basischer Lösungen (1-2 M NaOH) und solcher mit mindestens 2 % aktivem Chlor (z. B. Javelwasser).[9][10]
Sichere Verfahren für die Dekontamination von Räumen, Gebäuden oder Freiflächen sind bisher nicht bekannt. Infizierte Kadaver sollten in einer dazu eingerichteten Anlage verbrannt werden.
In freier Wildbahn gestaltet sich die Kontrolle der CWD daher extrem schwierig. Entsprechende Programme benutzen ein ausgeprägtes Monitoring-und-Surveillance-System, Jagdverbote, Populationsverkleinerungen sowie Einfangen betroffener Tiere.
Gefahr für den Menschen
Das Risiko für den Menschen scheint minimal zu sein. CWD ist seit mindestens 30 Jahren in Hirschpopulationen verbreitet, die regelmäßig bejagt werden. Trotzdem wurde bisher kein einziger Fall der Erkrankung beim Menschen diagnostiziert. Als Vorsichtsmaßnahmen werden empfohlen, in den Enzootiegebieten keine offensichtlich kranken Tiere zum Verzehr zu schießen, beim Ausweiden Latexhandschuhe zu tragen, Kontakt mit Nerven- und Lymphgewebe zu vermeiden, alle zum Zerlegen der Beute verwendeten Messer und anderen Geräte in 50 % Javelwasser zu desinfizieren und das Tier auf CWD testen zu lassen. Aus den Ergebnissen epidemiologischer Studien werden diese Sicherheitsmaßnahmen bestätigt.[11]
Einzelnachweise
- ↑ Volker Blasek: Zombie-Krankheit breitet sich rasant aus – Erste Infekte auch in Europa bereits bestätigt. In: heilpraxis.de. 19. Februar 2019, abgerufen am 19. Februar 2019.
- ↑ (red): Tödliche "Zombie"-Krankheit ausgebrochen - Auch Menschen gefährdet. In: Westdeutsche Zeitung. 18. Februar 2019, abgerufen am 19. Februar 2019.
- ↑ Erster Fall von Chronic Wasting Disease in Europa bestätigt! In: Jägermagazin. Jahr Top Spezial Verlag, abgerufen am 19. April 2016.
- ↑ S. L. Benestad, G. Mitchell, M. Simmons, B. Ytrehus, T. Vikøren: First case of chronic wasting disease in Europe in a Norwegian free-ranging reindeer. In: Vet Res. 47(1), 15. Sep 2016, S. 88. PMID 27641251
- ↑ Brent Race, Katie Williams, Christina D. Orrú, Andrew G. Hughson, Lori Lubke, Bruce Chesebro: Lack of Transmission of Chronic Wasting Disease to Cynomolgus Macaques. In: Julie K. Pfeiffer (Hrsg.): Journal of Virology. American Society for Microbiology, 25. April 2018, doi:10.1128/JVI.00550-18 (englisch, Journal of Virology [abgerufen am 17. Februar 2019]).
- ↑ Y. H. Lee, H. J. Sohn, M. J. Kim, H. J. Kim, W. Y. Lee, E. I. Yun, D. S. Tark, I. S. Cho, A. Balachandran: Strain characterization of the Korean CWD cases in 2001 and 2004. In: J Vet Med Sci. 75(1), 31. Jan 2013, S. 95–98. PMID 22972463
- ↑ T. Blasche, E. V. Schenck, A. Balachandran, M. W. Miller, J. Langenberg, K. Frölich, F. Steinbach: Rapid detection of CWD PrP: comparison of tests designed for the detection of BSE or scrapie. In: Transbound Emerg Dis. 59(5), Okt 2012, S. 405–415. PMID 22212828
- ↑ D. M. Henderson, M. Manca, N. J. Haley, N. D. Denkers, A. V. Nalls, C. K. Mathiason, B. Caughey, E. A. Hoover: Rapid antemortem detection of CWD prions in deer saliva. In: PLoS One. 8(9), 11. Sep 2013, S. e74377. PMID 24040235
- ↑ Chronic Wasting Disease (PDF; 560 kB) der Canadian Food Inspection Agency.
- ↑ vergleiche Literaturberichte zu CHEMICAL INACTIVATION for Prion Protein bzw. PHYSICAL SUSCEPTIBILITY for Prion Protein.
- ↑ L. Waddell, J. Greig, M. Mascarenhas, A. Otten, T. Corrin, K. Hierlihy: Current evidence on the transmissibility of chronic wasting disease prions to humans-A systematic review. Review. In: Transbound Emerg Dis. 30. Jan 2017. PMID 28139079
Literatur
- Chronic Wasting Disease. In: The Merck Veterinary Manual. 9. Auflage. Whitehouse Station, NJ, USA, 2005, ISBN 0-911910-50-6, S. 993 ff.
Weblinks
- Chronic wasting disease (CWD) in cervids (European Food Safety Authority Journal; englisch)
- Chronic Wasting Disease Alliance (englisch)
Auf dieser Seite verwendete Medien
Map of chronic wasting disease, showing captive facilities, both current and depopulated, and free-ranging deer (current and before 2000)
Autor/Urheber: Joel C. Watts, Aru Balachandran, David Westaway, Lizenz: CC BY 2.5
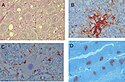
Pathology in CWD-Infected Animals
(A) Histologic lesions of CWD in the dorsal motor nuclei of the vagus nerve within the medulla oblongata of a CWD-affected elk. Note spongiform change, intraneuronal vacuoles, and mild gliosis (hematoxylin and eosin stain, 1003 magnification).
(B) PrP amyloid deposit stained by immunohistochemistry (brown) and surrounded by vacuoles (original magnification 1803).
(C) Perineuronal and extracellular deposits of abnormal PrP (PrPCWD, analogous to PrPSc) in a CWD-affected mule deer (original magnification1803).
(D) PrPCWD deposits in the germinal centres of lymphoid follicles in the tonsils of a mule deer (immunohistochemistry, original magnification 503). PLoS Pathogens DOI:10.1371/journal.ppat.0020026.g002