Chemokin

Chemokine (Name abgeleitet aus chemotaktische Zytokine) sind eine Gruppe der Zytokine, also kleine Signalproteine, die bei Zellen eine Wanderungsbewegung (Chemotaxis) auslösen. Die Zellen bewegen sich dabei entlang eines Konzentrationsgradienten zum Ort der höchsten Chemokinkonzentration. Chemokine spielen eine zentrale Rolle bei der Migration von Immunzellen im Gewebe und bei deren Auswanderung aus dem Blut. Manche Chemokine wirken zusätzlich aktivierend auf Immunzellen, und einige sind an der Organentwicklung und der Angiogenese beteiligt. Die ungefähr 50 unterschiedlichen Chemokine werden von Immunzellen und vielen Gewebezellen produziert. Ihre Wirkung entfalten sie nach Bindung an Chemokinrezeptoren, die im Immunsystem weit verbreitet sind. Ohne die von Chemokinen ausgelöste Zellwanderung könnte das Immunsystem nicht funktionieren.
Struktur und Nomenklatur

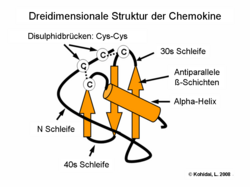
Chemokine sind kleine Proteine, die aus ca. 75–125 Aminosäuren bestehen und eine Molmasse von 8 bis 14 kDa aufweisen. Die Aminosäuresequenz ist innerhalb der Chemokinfamilie unterschiedlich konserviert, die Homologie kann weniger als 20 % oder auch mehr als 90 % betragen. Die räumliche Faltung oder Tertiärstruktur hingegen ist streng konserviert: der Amino-Terminus ist ungeordnet, der Hauptkörper wird durch ein dreisträngiges antiparalleles β-Faltblatt gebildet, und der Carboxy-Terminus endet mit einer α-Helix.[1] Ein weiteres konserviertes Merkmal der Chemokine ist eine Gruppe von Cysteinresten, die eine oder zwei Disulfidbrücken ausbilden können.
Aus der Anzahl und Position der Cysteinreste am Amino-Terminus leitet sich die systematische Nomenklatur der Chemokine ab.[2] Vier Unterfamilien lassen sich so unterscheiden: Bei den CC-Chemokinen folgen die ersten beiden Cysteine direkt aufeinander, bei den CXC-Chemokinen sind sie durch eine Aminosäure voneinander getrennt, und bei den CX3C-Chemokinen durch drei Aminosäuren. Bei diesen Chemokinfamilien werden immer zwei Disulfidbrücken gebildet. Im Gegensatz dazu gibt es bei der C-Familie nur ein konserviertes Cystein am Amino-Terminus, und es wird auch nur eine Disulfidbrücke ausgebildet. Die systematischen Namen der einzelnen Chemokine setzen sich aus der Bezeichnung der Familie (CC, CXC, CX3C, XC), dem Buchstaben L für Ligand (das R am Ende ist der Rezeptor) und einer fortlaufenden Nummerierung zusammen. Daneben werden aber noch häufig die Bezeichnungen verwendet, die ihnen bei der Erstbeschreibung gegeben wurde.
Funktion
Die Hauptfunktion der Chemokine besteht in der Auslösung von Chemotaxis bei Immunzellen. Es lassen sich inflammatorische (oder induzierbare) und homöostatische (oder konstitutive) Chemokine unterscheiden. Die meisten Chemokine sind inflammatorische Zytokine: Ihre Produktion wird z. B. durch eine Verletzung, Infektion oder Entzündung ausgelöst, und ihre Freisetzung lockt Immunzellen an. Sie wirken also wie ein Alarmsignal. Die homöostatischen Chemokine im Gegensatz dazu werden ständig produziert und sind an der Organisation von lymphoiden Organen und der Überwachung von gesundem Gewebe beteiligt. Zu dieser Gruppe gehören CCL18, CCL19, CCL21, CXCL12, CXCL13 und CXCL14. Eine andere Gruppe von Chemokinen kann nicht eindeutig einer der beiden Kategorien zugeordnet werden; dies sind CCL1, CCL17, CCL20, CCL22, CCL25, CXCL9, CXCL10, CXCL11 und CXCL16.
Die Funktion der Chemokine ist nicht zwingend an Formen gebunden, die frei löslich in der Gewebeflüssigkeit oder im Blut schwimmen. Konzentrationsgradienten werden auch durch eine feste Bindung an Gewebestrukturen ausgebildet. Chemokine besitzen viele basische Aminosäuren und sind daher positiv geladen; dies ermöglicht eine feste Bindung an die negativ geladenen Zuckermoleküle (Glykosaminoglykane), die auf der Oberfläche von Zellen und bei Glyko-Proteinen der extrazellulären Matrix weit verbreitet sind. Einige Chemokine wie CCL2, CCL3 und CCL5 verlieren ihre Funktion im Körper, wenn eine Bindung an Glykosaminoglykane nicht mehr möglich ist. Der genaue Zusammenhang zwischen Bindung an Gewebestrukturen und Funktion wird allerdings noch nicht verstanden.
Familien
 | |||
| CC Chemokine | |||
| Name | Gene | Andere Name(n) | Uniprot |
|---|---|---|---|
| CCL1 | Scya1 | I-309, TCA-3 | P22362 |
| CCL2 | Scya2 | MCP-1 | P13500 |
| CCL3 | Scya3 | MIP-1α | P10147 |
| CCL4 | Scya4 | MIP-1β | P13236 |
| CCL5 | Scya5 | RANTES | P13501 |
| CCL6 | Scya6 | C10, MRP-2 | P27784 |
| CCL7 | Scya7 | MARC, MCP-3 | P80098 |
| CCL8 | Scya8 | MCP-2 | P80075 |
| CCL9/CCL10 | Scya9 | MRP-2, CCF18, MIP-1γ | P51670 |
| CCL11 | Scya11 | Eotaxin | P51671 |
| CCL12 | Scya12 | MCP-5 | Q62401 |
| CCL13 | Scya13 | MCP-4, NCC-1, Ckβ10 | Q99616 |
| CCL14 | Scya14 | HCC-1, MCIF, Ckβ1, NCC-2, CCL | Q16627 |
| CCL15 | Scya15 | Leukotactin-1, MIP-5, HCC-2, NCC-3 | Q16663 |
| CCL16 | Scya16 | LEC, NCC-4, LMC, Ckβ12 | O15467 |
| CCL17 | Scya17 | TARC, dendrokine, ABCD-2 | Q92583 |
| CCL18 | Scya18 | PARC, DC-CK1, AMAC-1, Ckβ7, MIP-4 | P55774 |
| CCL19 | Scya19 | ELC, Exodus-3, Ckβ11 | Q99731 |
| CCL20 | Scya20 | LARC, Exodus-1, Ckβ4 | P78556 |
| CCL21 | Scya21 | SLC, 6Ckine, Exodus-2, Ckβ9, TCA-4 | O00585 |
| CCL22 | Scya22 | MDC, DC/β-CK | O00626 |
| CCL23 | Scya23 | MPIF-1, Ckβ8, MIP-3, MPIF-1 | P55773 |
| CCL24 | Scya24 | Eotaxin-2, MPIF-2, Ckβ6 | O00175 |
| CCL25 | Scya25 | TECK, Ckβ15 | O15444 |
| CCL26 | Scya26 | Eotaxin-3, MIP-4α, IMAC, TSC-1 | Q9Y258 |
| CCL27 | Scya27 | CTACK, ILC, Eskine, PESKY, skinkine | Q9Y4X3 |
| CCL28 | Scya28 | MEC | Q9NRJ3 |
| CXC Chemokine | |||
| Name | Gene | Andere Name(n) | Uniprot |
| CXCL1 | Scyb1 | Gro-α, GRO1, NAP-3 | P09341 |
| CXCL2 | Scyb2 | Gro-β, GRO2, MIP-2α | P19875 |
| CXCL3 | Scyb3 | Gro-γ, GRO3, MIP-2β | P19876 |
| CXCL4 | Scyb4 | PF-4 | P02776 |
| CXCL5 | Scyb5 | ENA-78 | P42830 |
| CXCL6 | Scyb6 | GCP-2 | P80162 |
| CXCL7 | Scyb7 | NAP-2, CTAPIII, β-Ta, PEP | P02775 |
| CXCL8 | Scyb8 | IL-8, NAP-1, MDNCF, GCP-1 | P10145 |
| CXCL9 | Scyb9 | MIG, CRG-10 | Q07325 |
| CXCL10 | Scyb10 | IP-10, CRG-2 | P02778 |
| CXCL11 | Scyb11 | I-TAC, β-R1, IP-9 | O14625 |
| CXCL12 | Scyb12 | SDF-1, PBSF | P48061 |
| CXCL13 | Scyb13 | BCA-1, BLC | O43927 |
| CXCL14 | Scyb14 | BRAK, bolekine | O95715 |
| CXCL15 | Scyb15 | Lungkine, WECHE | Q9WVL7 |
| CXCL16 | Scyb16 | SRPSOX | Q9H2A7 |
| CXCL17 | VCC-1 | DMC, VCC-1 | Q6UXB2 |
| C Chemokine | |||
| Name | Gene | Andere Name(n) | Uniprot |
| XCL1 | Scyc1 | Lymphotactin α, SCM-1α, ATAC | P47992 |
| XCL2 | Scyc2 | Lymphotactin β, SCM-1β | Q9UBD3 |
| CX3C Chemokine | |||
| Name | Gene | Other name(s) | Uniprot |
| CX3CL1 | Scyd1 | Fractalkine, Neurotactin, ABCD-3 | P78423 |
CC-Familie
Beim Menschen hat diese Familie 24 Mitglieder, ihre Wirkung entfalten sie bevorzugt auf Monozyten, Lymphozyten, eosinophile und basophile Granulozyten.
CXC-Familie
Die insgesamt 16 bekannten CXC-Chemokine des Menschen können durch die Ab- oder Anwesenheit weiterer struktureller Merkmale, wie beispielsweise das aus drei Aminosäuren bestehende ELR-Motiv, unterteilt werden. ELR-positive CXC-Chemokine gelten als potente Promotoren der Angiogenese, während ELR-negative CXC-Chemokine zumeist eine antiangiogenetische Wirkung besitzen.[3] Die Rezeptoren für diese Chemokine finden sich oft auf Neutrophilen.
CX3C-Familie
Das 1997 klonierte Chemokin „Fraktalkin“[4] ist das einzige Mitglied dieser Familie. Charakteristisch für Fraktalkin ist ein CX3C-Motiv und die Expression der Chemokindomäne über einen mucinähnlichen, membranverankerten Proteinstrang. Das Gen, das für das CX3C-Chemokin kodiert, ist auf dem Chromosom 16 lokalisiert. Fraktalkin wird membranständig auf aktivierten Endothelzellen exprimiert und kann in die Umgebung sezerniert werden. Sie kommen also als membrangebundene oder lösliche Moleküle vor. Fraktalkine wirken auf T-Lymphozyten und Monozyten. Lösliche Fraktalkine regulieren die Leukozytenmigration. Die membranständige Form vermittelt eine verstärkte Adhärenz der T-Zellen und Monozyten. Somit sind Fraktalkine in der Lage, direkt auf den Schritt der Leukozytenextravasation einzuwirken, bei dem die Zelle vom Rollen am Endothel in eine feste Adhäsion überführt wird, der die anschließende Leukodiapedese ins Gewebe folgt. Außerdem ist die Expression der Fraktalkine im Gehirn beobachtet worden.[5] Sie findet sich auf aktivierten Mikrogliazellen, was darauf schließen lässt, dass es bei Entzündungsprozessen im zentralen Nervensystem eine Rolle spielt. Außerdem wird die Chemotaxis und Aktivierung von neutrophilen Granulozyten im Gehirn von Fraktalkinen beeinflusst.
C-Familie
XCL1 (auch Lymphotactin oder ATAC) wird vor allem von aktivierten CD8 T-Zellen und von NK-Zellen freigesetzt. Beim Menschen gibt es noch ein zweites Gen (XCL2), das bis auf zwei Aminosäuren identisch mit XCL1 ist.
Literatur
- Charles A. Janeway, Paul Travers, Mark Walport: Immunobiology. B&T; 6. Auflage (2005), ISBN 0-8153-4101-6
- S. J. Allen et al.: Chemokine: receptor structure, interactions, and antagonism. In: Annu. Rev. Immunol. Bd. 25, 2007, S. 787–820. PMID 17291188.
Einzelnachweise
- ↑ E. J. Fernandez et al.: Structure, function, and inhibition of chemokines. In: Annu. Rev. Pharmacol. Toxicol. Bd. 42, 2002, S. 469–499. PMID 11807180.
- ↑ A. Zlotnik et al.: Chemokines: a new classification system and their role in immunity. In: Immunity. Bd. 12, Nr. 2, 2000, S. 121–127. PMID 10714678.
- ↑ Strieter RM, Polverini PJ, Kunkel SL, et al.: The functional role of the ELR motif in CXC chemokine-mediated angiogenesis. In: J. Biol. Chem. 270. Jahrgang, Nr. 45, November 1995, S. 27348–57, PMID 7592998.
- ↑ J. F. Bazan, K. B. Bacon u. a.: A new class of membrane-bound chemokine with a CX3C motif. In: Nature. Band 385, Nummer 6617, Februar 1997, S. 640–644, ISSN 0028-0836. doi:10.1038/385640a0. PMID 9024663.
- ↑ Y. Pan, C. Lloyd u. a.: Neurotactin, a membrane-anchored chemokine upregulated in brain inflammation. In: Nature. Band 387, Nummer 6633, Juni 1997, S. 611–617, ISSN 0028-0836. doi:10.1038/42491. PMID 9177350.
Auf dieser Seite verwendete Medien
Solution structure of IL-8 as published in the Protein Data Bank (PDB: 1IL8)