Zervixkarzinom
| Klassifikation nach ICD-10 | |
|---|---|
| C53 | Bösartige Neubildung der Cervix uteri |
| C53.0 | Endozervix |
| C53.1 | Ektozervix |
| C53.8 | Cervix uteri, mehrere Teilbereiche überlappend |
| C53.9 | Cervix uteri, nicht näher bezeichnet |
| ICD-10 online (WHO-Version 2019) | |
| Klassifikation nach ICD-11 | |
|---|---|
| 2C77 | Bösartige Neubildungen der Cervix uteri |
| 2C77.0 | Plattenepithelkarzinom der Cervix uteri |
| 2C77.1 | Adenokarzinom der Cervix uteri |
| 2C77.2 | Adenosquamöses Karzinom der Cervix uteri |
| 2C77.3 | Neuroendokrines Karzinom des Cervix uteri |
| 2C77.Y | Sonstige näher bezeichnete bösartige Neubildungen der Cervix uteri |
| 2C77.Z | Bösartige Neubildungen der Cervix uteri, nicht näher bezeichnet |
| ICD-11: Englisch • Deutsch (Entwurf) | |
Das Zervixkarzinom (lateinisch Carcinoma cervicis uteri), auch Kollumkarzinom (von lateinisch Collum ‚Hals‘) oder Gebärmutterhalskrebs genannt, ist ein bösartiger (maligner) Tumor des Gebärmutterhalses (Cervix uteri). Es ist weltweit der vierthäufigste bösartige Tumor bei Frauen. Histologisch handelt es sich in der Mehrheit der Fälle um ein Plattenepithelkarzinom. Die häufigste Ursache für ein Zervixkarzinom ist eine Infektion mit bestimmten Typen des humanen Papillomvirus (HPV). Das Zervixkarzinom verursacht zunächst keine Schmerzen, nur gelegentlich treten leichte Schmierblutungen auf. Erst wenn der Tumor größer wird und mit Geschwürbildung zerfällt, kommt es zu fleischwasserfarbigem, süßlich riechendem Scheidenausfluss. Im Frühstadium ist die vollständige Entfernung der Veränderung durch eine Konisation ausreichend. Im fortgeschrittenen Stadium wird die Entfernung der ganzen Gebärmutter mit umliegendem Gewebe und manchmal auch weiterer Organe notwendig. Eine Untersuchung zur Früherkennung ist der Pap-Test. Eine Impfung mit einem HPV-Impfstoff verhindert eine Infektion durch die zwei häufigsten Hochrisiko-HPV-Typen und verringert damit das Risiko der Entstehung eines Zervixkarzinoms.[1]
Epidemiologie
Das Zervixkarzinom ist weltweit der vierthäufigste bösartige Tumor bei Frauen und der siebthäufigste insgesamt. Im Jahr 2012 erkrankten weltweit 528.000 Frauen, etwa 266.000 starben daran.[2] In der weltweiten Todesursachenstatistik 2005 der gynäkologischen Malignome steht besonders das in das umgebende Gewebe hineinwuchernde (invasive) Zervixkarzinom damit auf Rang eins, mit einer Sterblichkeit (Letalität) von über 60 Prozent.[3]
Häufigkeit
Die Häufigkeit (Inzidenz) beim Gebärmutterhalskrebs unterscheidet sich weltweit erheblich. Sie lag beispielsweise 2002 in Finnland bei 3,6 und in Kolumbien bei jährlich 45 Neuerkrankungen pro 100.000 Frauen. In Deutschland lag sie 1979 bei noch circa 35, sank 2002 dann auf 13,3 und[4][5] bis 2019 auf 9,2.[6]
Früher der häufigste Genitalkrebs der Frau, konnte durch Früherkennungsuntersuchungen und HPV-Impfungen bis 2008 die Häufigkeit in Mitteleuropa auf zirka 25 Prozent aller Genitalkarzinome gesenkt werden. Entsprechend zeigt die Häufigkeit zervikaler Krebsvorstufen eine steigende Tendenz, sie liegt etwa beim 50- bis 100-fachen der Inzidenz invasiver Zervixkarzinome.[4]
2019 erkrankten in Deutschland circa 4.575 Frauen neu an einem Zervixkarzinom. Nach Stand 2022 sterben jährlich etwa 1.600 daran, 30 Jahre vorher waren es noch mehr als doppelt soviele; die 5-Jahres-Überlebenswahrscheinlichkeit nach der Diagnose eines invasiven Gebärmutterhalstumors liegt bei 65 %.[6]
Erkennungsalter
Das Zervixkarzinom wird am häufigsten im Alter von 45 bis 55 Jahren diagnostiziert, Vorstufen können schon bei 20- bis 30-jährigen Patientinnen auftreten. Das mittlere Alter bei der Erstdiagnose des Zervixkarzinoms sank in den letzten 25 Jahren um 14 Jahre und liegt derzeit bei etwa 52 Jahren.[4][5] In der Altersverteilung findet man einen Gipfel zwischen dem 35. und 54. Lebensjahr sowie einen weiteren Anstieg ab dem 65. Lebensjahr.[4] 2003 zeigte die Erkrankungshäufigkeit eine veränderte Altersverteilung, weil die Diagnose deutlich häufiger bei Frauen in einem Alter zwischen 25 und 35 Jahren gestellt wurde als bei Frauen, die über 65 Jahre alt waren.[5] Die Erkrankung kann auch in der Schwangerschaft auftreten. Die Häufigkeit beträgt hier 1,2 pro 10.000 Schwangerschaften.[3]
Ursachen
Etwa 97 % der Gebärmutterhalskarzinome sind assoziiert mit dem humanen Papillomvirus (HPV). Eine Infektion mit den HP-Viren Typ 16 und Typ 18 liegt dabei am häufigsten vor. (s.S3 Leitlinie Zervixkarzinom von 2014)
Weitere Faktoren wie Rauchen, genitale Infektionen, die Langzeiteinnahme von oralen Kontrazeptiva,[7][8] eine hohe Zahl an vorangegangenen Geburten (hohe Parität) sowie die Suppression des Immunsystems stehen in der Diskussion, bei Hochrisiko-HPV-Infektionen die Krebsentstehung zu fördern.[4][9] Weitere prädisponierende Faktoren sind unter anderem der frühzeitige Beginn des Sexualverkehrs, hohe Promiskuität sowie mangelnde Sexualhygiene beider Partner und niedriger sozialer Status. Genetische Faktoren können ebenfalls einen Risikobeitrag leisten.[10]
Bekannt sind aber auch einige Erkrankungen bei teilweise sehr jungen Frauen ohne erkennbare Risikofaktoren. Eine der ersten wurde bereits 1887 beschrieben.[11] Durch Intrauterinpessare wird das Risiko für Gebärmutterhalskrebs nach einer großen Metaanalyse aus dem Jahr 2011 nicht erhöht, sondern verringert.[12]
HPV-Infektion

Die auch Kondyloma-Viren genannten Erreger wurden früher zur Familie der Papovaviridae gezählt. Es sind kugelförmige, unbehüllte, doppelsträngige DNA-Viren (dsDNA; aus der Gruppe der Papillomaviridae), von denen insgesamt zirka 200 verschiedene Typen bekannt sind. Die meisten davon sind für den Menschen relativ harmlos, können aber unangenehme Feigwarzen im Genitalbereich verursachen. Die Typen 16 und 18 können bei 70 Prozent der Zervixkarzinome, der zervikalen intraepithelialen Neoplasien und den Adenokarzinomen in situ nachgewiesen werden. Außerdem treten sie auch häufig beim Analkarzinom auf. Die Typen 6 und 11 sind für eher gutartige (d. h. nicht metastasierende oder invasiv wachsende) Tumoren wie Genitalwarzen verantwortlich und finden sich auch bei anderen Tumoren, wie z. B. bei Papillomen im Oropharynx. Außer diesen wurden aber bereits noch mindestens 18 weitere HP-Virentypen in Gebärmutterhalstumoren entdeckt. Nach dem heutigen Wissensstand kann nicht ausgeschlossen werden, dass auch andere Typen krankheitserregend (pathogen) sind.
Für alle genannten HP-Virenarten ist im Gegensatz zum Beispiel zu den Influenza-Viren allein der Mensch der Haupt- oder Reservoirwirt. Die Viren haben sich dem menschlichen Organismus angepasst. Eine Schädigung ihres Reservoirwirts hat für sie keinen vorteilhaften Effekt, da sie ja zur eigenen Vermehrung auf diesen angewiesen sind. Die dennoch von diesen Viren beim Reservoirwirt ausgelösten Gebärmutterhalskarzinome sind letztlich nur Nebeneffekte der Infektion.
Die Infektion mit diesen Viren findet meist im Jugendalter durch Kontaktinfektion beziehungsweise Schmierinfektion bei den ersten Sexualkontakten statt. Anschließend können diese Viren jahrelang inaktiv bleiben.
Allerdings ist auch ohne Sexualkontakt eine Infektion möglich, beispielsweise während der Geburt. Hier kann es beim Säugling sehr selten durch die HPV-Typen 6 und 11 zu Wucherungen (Larynxpapillome) am Kehlkopf kommen.[13] Eine Übertragung anderer HPV-Typen auf diesem Weg scheint möglich. Eine Übertragung durch anderen Körperkontakt, wie zwischen Händen und Genitalien, scheint ebenfalls möglich.[14] Andere Übertragungswege, wie über Schwimmbäder oder kontaminierte Toiletten, werden diskutiert, konnten aber bislang nicht nachgewiesen werden.
Wenn es den Viren gelungen ist, in die Basalzellen (in tiefen Zellschichten von Epithelien auf oder in der Nähe der Basalmembran liegende Zellen) des Gebärmutterhalses einzudringen, bringen sie diese dazu, ihr Virenerbgut herzustellen, was sie – wie alle Viren – selbst nicht können. Die Zellen müssen daher auch zur Teilung angeregt bzw. im Teilungszustand gehalten werden, damit sie das Virenerbgut herstellen können. Und genau bei diesem Vorgang treten folgende Fehler auf: Die Erregerviren schalten die Kontrollmoleküle der Gebärmutterhalszellen aus, die gewöhnlich eine Zellteilung begrenzen bzw. bei einem fehlerhaften Teilungsvorgang die Zelle in den programmierten Zelltod (Apoptose) schicken können (p53 und pRB). Die Tumorbildung setzt noch zusätzlich den Einbau des Virusgenoms in das Genom der Wirtszelle voraus. Dieser Vorgang ereignet sich spontan (zufällig), er ist nicht enzymatisch gesteuert. Dies allein genügt in der Regel noch nicht für die Tumorbildung, begünstigt aber weitere Schädigungen, die letztlich zur Tumorbildung führen. Sobald die Tumorzellen die Basalmembran durchbrochen haben, können sie mit dem Blut oder der Lymphflüssigkeit in andere Körperregionen gelangen, sich dort vermehren und dadurch sogenannte Tochtergeschwülste (Metastasen) erzeugen.
Meistens erkennt ein gesundes und abwehrstarkes Immunsystem derartig veränderte Zellen und tötet sie ab. Etwa 70 Prozent der infizierten Patientinnen haben nach zwei Jahren das jeweilige Virus eliminiert.
Allerdings gelingt es den betreffenden Erregern bei manchen Frauen, auf eine noch nicht bekannte Weise das Immunsystem zu überwinden. Bei Hochrisiko-HPV-Typen ist dies bei etwa jeder zehnten Infektion der Fall. Man spricht in solchen Fällen von einer persistierenden Infektion, wenn die Viren länger als 6 bis 18 Monate nachweisbar sind. Eine solche ist nach heutiger Kenntnis Voraussetzung für die virusbedingte Entstehung von Krebs. Sind bei einer Frau 18 Monate nach der Erstdiagnose der HPV-Infektion noch Hochrisikotypen nachweisbar, steigt die Wahrscheinlichkeit, an Gebärmutterhalskrebs zu erkranken, auf das etwa 300-fache.[15] Bei den betreffenden Frauen kann dann innerhalb von 10 bis 20 Jahren nach der Infektion ein Gebärmutterhalskrebs entstehen. Diese Latenzzeit erklärt auch, warum dieser Krebs derzeit besonders bei Frauen im Alter von 35 bis 40 Jahren festgestellt wird und in letzter Zeit eine deutliche Tendenz zum jüngeren Alter zeigt. Es passt zu der in modernen Gesellschaften bestehenden Tendenz zu früherer sexueller Aktivität und der durchschnittlich größeren Zahl von Sexualpartnern.
Rauchen
Rauchen stellt einen unabhängigen Risikofaktor für die Entstehung eines Zervixkarzinoms dar.[16] Hochrisiko-HPV-infizierte Raucherinnen haben ein höheres Erkrankungsrisiko als Hochrisiko-HPV-infizierte Frauen, die nie geraucht haben. Dabei ließ sich insbesondere ein erhöhtes Risiko für Plattenepithelkarzinome nachweisen, nicht für Adenokarzinome. Das Risiko ist offenbar abhängig von der Zahl der pro Tag gerauchten Zigaretten und dem Alter, in dem mit dem Rauchen begonnen wurde, und besteht auch bei ehemaligen Raucherinnen weiter. Krebserregende Abbauprodukte des Tabakrauchs ließen sich in der Gebärmutterhalsschleimhaut nachweisen. HPV-Infektionen bleiben bei Raucherinnen länger bestehen, so dass es hier öfter zu persistierenden Infektionen kommt.[17]
Andere Genitalinfektionen
Es besteht der Verdacht, dass eine zusätzliche Infektion des Genitalbereichs mit anderen sexuell übertragbaren Erregern wie Chlamydien und Herpes simplex 2 zur Krebsentstehung beitragen kann, wenn bereits eine Infektion mit Hochrisiko-HPV besteht.[18][19]
Entstehung
Die Erkrankung entsteht durch Veränderungen von Zellen und schließlich Gewebestrukturen stufenweise aus einer sogenannten Zervikalen intraepithelialen Neoplasie (englisch Cervical Intraepithelial Neoplasia) (CIN I bis III). Dabei gelten die dysplastischen Zellveränderungen bei CIN I und II als rückbildungsfähig. CIN III stellt dagegen eine obligate Präkanzerose dar. Das heißt, mehr als 30 Prozent entwickeln sich innerhalb von fünf Jahren in eine Krebserkrankung. Dabei werden unter CIN III wegen des gleichen biologischen Verhaltens die hochgradige Dysplasie und das Carcinoma in situ (CIS) zusammengefasst.[4]
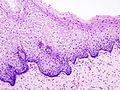
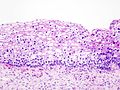
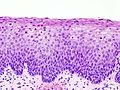
- Zervikale Intraepitheliale Neoplasien im histologischen Bild unter dem Mikroskop
- Normales zervikales Epithel
- CIN I
- CIN II
- CIN III
Krankheitsverlauf/Symptome
Es entwickeln sich nur bei 2 bis 8 Prozent der HPV-infizierten Frauen Zellveränderungen, die ein Vorstadium für eine Krebserkrankung darstellen, oder sogar anschließend ein Karzinom.
Zervixkarzinome bilden sich in der Regel völlig unauffällig und ohne Schmerzen. Nur gelegentlich können mehr oder minder leichte Schmierblutungen auf ein solches Geschehen hinweisen. Erst wenn der Tumor größer wird und unter Geschwürbildung zerfällt, kommt es zu fleischwasserfarbigem, süßlich riechendem Scheidenausfluss, unregelmäßigen Blutungen und Kontaktblutungen beim Geschlechtsverkehr.
Unbehandelt wächst der Tumor in Harnblase, Mastdarm und andere Strukturen des kleinen Beckens wie die Harnleiter ein, beschädigt oder zerstört diese gar und führt dadurch zu Folgeerscheinungen, wie einer Stauung der Nieren oder Lymphödemen der Beine. Außerdem kann es zu Metastasen in anderen Körperregionen kommen, weil sich Tumorzellen über die Lymphgefäße (lymphogen) und den Blutkreislauf (hämatogen) im Körper verteilen und an einem anderen Ort ansiedeln und vermehren können.[20]
Eine Schwangerschaft beeinflusst den Krankheitsverlauf nicht. Auch für die Kinder besteht keine direkte Gefahr. Jedoch kann es bei einer natürlichen Geburt des Kindes zu Wucherungen am Kehlkopf kommen.[3]
Untersuchungsmethoden
Die Diagnose eines Zervixkarzinoms kann nur durch histologische Untersuchung von Gewebestücken gestellt werden. Diese werden entweder durch eine gezielte Probenentnahme aus einem bei der Kolposkopie auffälligen Bereich am Muttermund, eine Konisation nach wiederholt auffälligem Pap-Test oder eine Ausschabung bei Verdacht auf eine im Gebärmutterhalskanal befindliche Veränderung gewonnen.
Bei nachgewiesenem Karzinom sind zur Stadienbestimmung eine Röntgenuntersuchung der Lunge, eine Sonografie durch die Scheide, eine Sonografie beider Nieren und der Leber, eine Zystoskopie und Rektoskopie zum Ausschluss oder Nachweis eines Tumoreinbruchs in Harnblase oder Enddarm notwendig.
Ab dem Stadium FIGO IB2 wird zur Feststellung der Tumorausdehnung eine Kernspintomographie (MRT) empfohlen, da diese in Ergänzung zur Tastuntersuchung geeignet ist, die Größe des Tumors im kleinen Becken, die Beziehung zu den Nachbarorganen und die Eindringtiefe zu bestimmen.[4]
Pathologie
Die Mehrheit aller invasiven Zervixkarzinome sind Plattenepithelkarzinome (80 Prozent), gefolgt von den Adenokarzinomen (5–15 Prozent). Bevorzugter Entstehungsort ist die sogenannte Transformationszone, in welcher das Plattenepithel der Portio auf das Zylinderepithel des Zervix trifft.[21] Andere Tumorformen, wie Adenokankroide, adenosquamöse und mukoepidermoide Karzinome, sind selten. Als Besonderheit treten, ebenfalls selten, sogenannte Gartnergangkarzinome auf. Sie gehen vom Gartnerschen Gang, einem kleinen Teil des rückgebildeten Wolffschen Ganges, aus. Da sich dieser Tumortyp in der Tiefe entwickelt und erst im Verlauf in den Gebärmutterhalskanal durchbricht, hilft die übliche Früherkennung hier nicht.[20] Sarkome der Gebärmutter können sehr selten auch die Zervix befallen.[22] Eine Sonderstellung nehmen dabei die Müllerschen Mischtumoren ein, bei denen karzinomatöse und sarkomatöse Komponenten im gleichen Tumor auftreten. Auch sie befallen eher den Gebärmutterkörper als die Zervix.[23]
Die Tumortypisierung erfolgt nach der WHO-Klassifikation, die Stadieneinteilung vor einer Operation klinisch nach der FIGO-Klassifikation. Nach einer operativen Behandlung erfolgt die Stadieneinteilung nach der pTNM-Klassifikation, welche eine histologische Beurteilung durch einen Pathologen einschließt und in der Stadienbezeichnung durch ein vorangestelltes kleines p angezeigt wird.[4] Der Differenzierungsgrad des Krebsgewebes wird nach der UICC (Union Internationale Contre le Cancer) beurteilt.[23]


| TNM | FIGO | Kriterien |
|---|---|---|
| TX | Primärtumor kann nicht beurteilt werden | |
| T0 | Kein Anhalt für einen Tumor | |
| Tis | („Carcinoma in situ“) | Kein Durchbruch durch die Basalmembran ins gesunde Gewebe, entspricht einer CIN 3 |
| T1 | I | Zervixkarzinom begrenzt auf den Gebärmutterhals |
| 1a | IA | Nur mikroskopisch sichtbar, Stromainvasion bis einschließlich 5 mm (TNM unter 7 mm horizontale Ausdehnung, in FIGO-Klassifikation nicht mehr definiert) |
| 1a1 | IA1 | Nur mikroskopisch sichtbar, Stromainvasion bis einschließlich 3 mm (TNM unter 7 mm horizontale Ausdehnung, in FIGO-Klassifikation nicht mehr definiert) |
| 1a2 | IA2 | Nur mikroskopisch sichtbar, Stromainvasion mehr als 3 bis einschließlich 5 mm (TNM unter 7 mm horizontale Ausdehnung, in FIGO-Klassifikation nicht mehr definiert), sogenanntes Mikrokarzinom |
| 1b | IB | Klinisch erkennbare Läsionen, begrenzt auf die Cervix uteri oder subklinische Läsionen mit größeren Maßen als Stadium IA |
| 1b1 | IB1/2 | Klinisch erkennbare Läsionen, kleiner als 4 cm (die FIGO-Klassifikation unterscheidet seit 2019 zwischen Tumoren < 2 cm [FIGO IB1] und solchen 2 cm bis < 4 cm [FIGO IB2]) |
| 1b2 | IB3 | Klinisch erkennbare Läsionen, mindestens 4 cm |
| T2 | II | Zervixkarzinom, das die Gebärmuttergrenze überschritten hat, aber weder die Beckenwand noch das untere Drittel der Vagina erreicht |
| 2a | IIA | Infiltration der Scheide, ohne Infiltration des Parametriums |
| 2a1 | IIA1 | Infiltration der Scheide, ohne Infiltration des Parametriums, klinisch sichtbar, nicht größer als 4 cm |
| 2a2 | IIA2 | Infiltration der Scheide, ohne Infiltration des Parametriums, klinisch sichtbar, größer als 4 cm |
| 2b | IIB | Mit Befall des Parametriums |
| T3 | III | Befall des unteren Drittels der Vagina und/oder der Beckenwand und/oder Nierenstauung und/oder Nierenausfall |
| 3a | IIIA | Befall des unteren Drittels der Vagina, kein Befall der Beckenwand |
| 3b | IIIB | Befall der Beckenwand und/oder Hydronephrose oder Nierenausfall |
| T4 | IV | Befall der Blase, des Enddarmes, Fernmetastasierung |
| 4 | IVA | Tumor infiltriert die Schleimhaut von Blase oder Rektum und/oder Überschreitung des kleinen Beckens |
| 4 | IVB | Fernmetastasen oder keine Beurteilung der Fernmetastasen |
| Nx | Es kann keine Aussage zu regionären Lymphknotenmetastasen getroffen werden. | |
| N0 | Keine Metastasen in den regionären Lymphknoten. | |
| N1 | Metastasen in den regionären Lymphknoten. | |
| M0 | Keine Fernmetastasen nachweisbar. | |
| M1 | Der Tumor hat Fernmetastasen gebildet. | |
| 1a | Metastasen in anderen Lymphknoten (nicht regionäre, beispielsweise paraaortale, Lymphknoten). | |
| 1b | Metastasen in den Knochen. | |
| 1c | Metastasen in anderen Organen und/oder Strukturen. |
Anmerkungen: Die Klassifikation der UICC und der FIGO wurden für das T- und M-Stadium angeglichen. Die FIGO verwendet kein Stadium 0 (= Tis). Das N-Stadium (Lymphknotenbefall) ist nur in der Klassifikation der UICC (TNM) enthalten.[24] Hierin sind als regionäre Lymphknoten (LK) definiert:
- parazervikale LK
- parametrane LK
- hypogastrische LK an den Arteriae iliacae internae
- LK an den Arteriae ilicae communes
- LK an den Arteriae ilicae externae
- praesakrale LK
- laterale sakrale LK
Paraaortale und inguinale LK (Leisten-LK) sind nach TNM-Klassifikation der UICC nicht regionär. Bei Befall besteht ein Stadium M1.
Die FIGO-Klassifikation von 2019 definiert befallene, regionäre Lymphknoten nunmehr als Stadium IIIC. Im Gegensatz zur TNM-Klassifikation der UICC werden hierbei paraortale Lymphknoten bis zur linken Vena ranalis als regionäre Lymphknoten und nicht als Fernmetastasen gewertet. Dabei definieren befallene pelvine Lymphknoten das Stadium IIIC1 und befallene paraortale Lymphknoten das Stadium IIIC2.
| Plattenepithelkarzinome („Squamous lesion“) | Adenokarzinome („Glandular lesions“) | Spezielle Erscheinungsformen („Other epithelial lesion“) |
|---|---|---|
|
Spezielle Varianten der Adenokarzinome:
Mischtypen |
Neuroendokrine Karzinome:
Undifferenzierte kleinzellige „nonendokrine“ Karzinome |
Behandlung

Die Therapie des Zervixkarzinoms und seiner Vorstufen richtet sich nach dem jeweiligen Stadium:
Behandlung der Krebsvorstufen
Eine Zervikale intraepitheliale Neoplasie (CIN) I kann über maximal 24 Monate im Abstand von sechs Monaten regelmäßig zytologisch und kolposkopisch beobachtet werden, wenn die Veränderungen im äußeren Bereich der Portio gut zu kontrollieren sind. Dabei können sich die Veränderungen zurückbilden oder weiterentwickeln. Voraussetzung dafür ist die sichere Diagnose durch Probeentnahme und histologische Untersuchung. CIN I im Inneren des Gebärmutterhalses (intrazervikaler Sitz, nicht gut beobachtbar) sollten bald mit einer Konisation behandelt werden. Eine Verlaufskontrolle und damit eine Verschiebung der Behandlung ist auch bei der CIN II und III in einer Schwangerschaft möglich, um die Lebensfähigkeit des Kindes abzuwarten.[3] Außerhalb einer Schwangerschaft sollte bei einer CIN II, die über zwölf Monate bestehen bleibt, und bei der CIN III eine Operation durchgeführt werden.[4]
Beim Carcinoma in situ ist nach vollständiger Entfernung der Veränderung durch eine Konisation oder – im Falle einer abgeschlossenen Familienplanung – nach kompletter Gebärmutterentfernung (Hysterektomie) keine weitere Behandlung nötig. Bei unvollständiger Entfernung besteht die Möglichkeit einer erneuten Konisation. Eine Konisation kann bei strenger Indikationsstellung auch in der Schwangerschaft durchgeführt werden. Bei einem Carcinoma in situ mit vollständiger Entfernung der Veränderungen durch die Konisation kann die Schwangerschaft ausgetragen werden, das Risiko einer Frühgeburt ist dann erhöht. Eine normale Geburt ist möglich. Sechs Wochen nach der Geburt sollte dann eine erneute kolposkopische und zytologische Kontrolle erfolgen.[3]
Behandlung des Gebärmutterhalskrebses
Im Stadium FIGO IA1 kann, wie bei den Krebsvorstufen, eine Konisation ausreichend sein, wenn der Tumor vollständig entfernt wurde und noch Kinderwunsch besteht, wobei dabei das Risiko für eine Zervixinsuffizienz oder auch eine Zervixstenose in der Schwangerschaft erhöht ist. Ohne Kinderwunsch sollte eine einfache Gebärmutterentfernung erfolgen. Bei Lymphgefäßeinbrüchen ist eine zusätzliche pelvine Lymphknotenentfernung angezeigt.
In den Stadien IA2, IB, IIA, IIB ist eine erweiterte Hysterektomie (radikale Hysterektomie) und systematische pelvine, stadienabhängig gegebenenfalls eine paraaortale Lymphonodektomie (Entfernung aller an der Aorta gelegenen Lymphknoten) angezeigt. Hier kommt bislang die Wertheim-Meigs-Operation als Standardtherapie zum Einsatz. Bei Plattenepithelkarzinomen können bei jungen Frauen die Eierstöcke erhalten bleiben. Liegt ein Adenokarzinom vor, wird wegen einer höheren Metastasierungswahrscheinlichkeit in die Eierstöcke eine Entfernung auch bei jungen Frauen empfohlen. Je nach histologischem Befund ist nach der Operation eine Strahlentherapie oder Radiochemotherapie nötig.
Die Klassifikation nach Piver, oder auch Rutledge-Piver, unterscheidet fünf Grade der Radikalität einer Hysterektomie beim Gebärmutterhalskrebs. Sie wurde nach den amerikanischen Gynäkologen M. Steven Piver und Felix Rutledge benannt.[28]
| Piver-Stadium | Bezeichnung | Ausdehnung des Eingriffs |
|---|---|---|
| I | extrafasziale Hysterektomie |
|
| II | modifiziertradikale Hysterektomie |
Letztlich handelt es sich um eine extrafasziale Hysterektomie mit Resektion der Parametrien medial der Ureteren. |
| III | „klassische“ radikale Hysterektomie |
|
| IV | erweiterte radikale Hysterektomie | wie Piver III, jedoch mit
|
| V | – | wie Piver IV, jedoch zusätzlich
|
Als Alternativen stehen heute an Zentren die Totale mesometriale Resektion (TMMR) mit einer nervenschonenden Präparationstechnik (gezieltes Freilegen) in anatomisch-embryonalen Entwicklungsgrenzen und Verzicht auf eine anschließende Bestrahlung bei dennoch gleichen bzw. sogar besseren Überlebensdaten,[29][30] die laparoskopisch assistierte vaginale radikale Hysterektomie (LAVRH) mit nervenschonender vaginaler Radikaloperation und laparoskopischer Lymphknotenentfernung[31] sowie die laparoskopische radikale Hysterektomie (LRH) mit vollständiger laparoskopischer Präparation zur Verfügung.[32]
Bei noch bestehendem Kinderwunsch kann in den Stadien IA2 und IB1 mit Tumoren < 2 cm über eine radikale Trachelektomie nach Dargent mit Lymphonodektomie und damit ein Erhalt der Fruchtbarkeit nachgedacht werden, wenn es sich um ein Plattenepithelkarzinom handelt, die Lymphknoten tumorfrei sind und keine weiteren Risikofaktoren vorliegen.[33] Diese Verfahren stellen derzeit keine Routine dar, sie können jedoch sowohl durch Schonung der für die Harnblasen- und Darmentleerung verantwortlichen Nerven, wie eine Vermeidung einer Nachbestrahlung nach der Operation bei der TMMR, oder dem Erhalt der Fruchtbarkeit bei der Trachelektomie, den Patientinnen Vorteile bieten.[4]
In den Stadien III und IV ist eine primäre kombinierte Strahlentherapie oder besser eine simultane Radiochemotherapie erforderlich.[3] Bei einem zentralen Tumorsitz mit Blasen- und/oder Rektuminfiltration ist auch im Stadium IV eine Operation in Form einer Exenteration möglich, wenn die Beckenwand tumorfrei ist.[4]
Behandlung in der Schwangerschaft
Im Stadium IA1 mit vollständiger Entfernung der Veränderungen durch eine Konisation kann die Schwangerschaft, wie bei der CIN III, ausgetragen und das Kind auf vaginalem Weg geboren werden. Sechs Wochen nach der Geburt ist eine kolposkopische und zytologische Kontrolle notwendig.
In den Stadien IB bis IIA sollte bei einer frühen Schwangerschaft die entsprechende chirurgische Behandlung durchgeführt werden und damit die Schwangerschaft abgebrochen werden. Ist die Schwangerschaft bereits weiter fortgeschritten, ist eine baldige Geburt des Kindes mittels Schnittentbindung und anschließender radikaler Hysterektomie mit Lymphknotenentfernung anzuraten.[3]
Behandlung des Rezidivs
Die Behandlung des Zervixkarzinomrezidivs ist abhängig vom Befund und der vorangegangenen Behandlung. Eine Operation beim zentralen, also in Beckenmitte gelegenen Rezidiv ist möglich, meist im Sinne einer radikalen Hysterektomie nach früherer Strahlenbehandlung oder Exenteration nach bereits erfolgter Gebärmutterentfernung. Nicht vorbestrahlte Patientinnen können eine Strahlentherapie erhalten. Die Wertigkeit einer Radiochemotherapie beim Rezidiv ist noch nicht endgültig geklärt. Bei bereits vorbestrahlten Patientinnen mit Beckenwandrezidiv bestehen eingeschränkte kurative Behandlungsansätze in speziellen Therapieverfahren: operativ (Lateral erweiterte endopelvine Resektion, LEER) sowie die intraoperative Radiotherapie (IORT) oder die Kombination von beiden (Combined operative radiotherapy, CORT).[34]
Vorbeugung
Primäre Prävention
Die primäre Prävention besteht in einer Vermeidung von Risikofaktoren, wie genitalen Infektionen, häufigem Partnerwechsel und Rauchen. Seit dem Jahr 2006 besteht die Möglichkeit einer Impfung der Frau gegen einige der krebsauslösenden HP-Viren. Auch die Benutzung von Kondomen sowie die Beschneidung des Mannes führen zu einer Senkung des Infektions- und damit des Krebsrisikos. Anders als bei anderen sexuell übertragbaren Erkrankungen, die einen zusätzlichen Risikofaktor darstellen, bietet das Kondom jedoch keinen sicheren Schutz vor Infektion.[35][36]
Impfung
2006 wurde ein erster HPV-Impfstoff zugelassen, das von Sanofi Pasteur MSD auf Grundlage von Forschungsergebnissen des Deutschen Krebsforschungszentrums und des amerikanischen National Institute of Health entwickelte Gardasil (quadrivalenter Impfstoff = wirksam gegen die vier HPV-Typen 6, 11, 16 und 18). 2007 wurde in der Europäischen Union ein bivalenter Impfstoff (wirksam gegen die zwei HPV-Typen 16 und 18) von der Firma GlaxoSmithKline unter dem Handelsnamen Cervarix zugelassen. 2016 folgte die Zulassung eines 9-valenten Impfstoffes, Gardasil 9, der gegen die HPV-Typen 6, 11, 16, 18, 31, 33, 45, 52, und 58 gerichtet ist.
Die Hochrisiko-HPV-Typen 16 und 18 sind weltweit für etwa 70 % aller Zervixkarzinome bei der Frau verantwortlich. Die Papillomaviren vom Typ 6 und 11 sind primär verantwortlich für die Entstehung von Genitalwarzen (Feigwarzen).
Alle derzeit zugelassenen Impfstoffe beugen der Entwicklung zervikaler intraepithelialer Neoplasien vor. Eine bereits bestehende HPV-Infektion kann nicht behandelt bzw. beseitigt werden. Ebenso wenig können die Folgen einer solchen Infektion, wie beispielsweise Gebärmutterhalskrebs oder dessen Vorstufen, mittels einer Impfung behandelt werden. Die Vorsorgeuntersuchung zur frühzeitigen Erkennung des Gebärmutterhalskrebses (Pap-Test) wird auch für geimpfte Frauen weiterhin empfohlen, da die Impfung nur gegen einen Teil der Papillomaviren wirksam ist.
Nach einer Entscheidung des Gemeinsamen Bundesausschusses von September 2018 übernehmen alle gesetzlichen Krankenkassen in Deutschland die Kosten der Impfung bei Mädchen und Jungen im Alter zwischen 9 und 17 Jahren.[37] Analoges wird auch in Österreich und in der Schweiz gemacht.
Bei Männern bzw. Jungen wird eine Impfung empfohlen, da Krebserkrankungen des Penis, des Anus und des Mundes HPV-bedingt auftreten können; hierbei werden jährlich 600 Anal- und mindestens 250 Peniskarzinome sowie mindestens 750 Karzinome in der Mundhöhle bzw. im Rachen als Neuerkrankungen registriert.[38] Darüber hinaus ist eine Übertragung trotz Kondomnutzung beim Geschlechtsverkehr, bei orogenitalen Sexualpraktiken eine Transmission in die Mundhöhle oder den Oropharynx möglich.[39]
Beschneidung des Mannes
Gemäß aktueller deutscher Leitlinie kann eine Zirkumzision der Weitergabe sexuell übertragbarer Krankheiten nicht vorbeugen.[40] Laut WHO muss jedoch eine umfassende Präventionsstrategie die männliche Beschneidung einschließen.[41]
Sekundäre Prävention (Früherkennung von Krebsvorstufen)
Die Früherkennung des Zervixkarzinoms in Form einer Screening-Untersuchung ist eine sogenannte sekundäre Prävention durch Erkennung von Vorstufen eines Karzinoms durch Abstrichuntersuchungen (Pap-Test). In Deutschland sind die Mindestanforderungen für das Screening gesetzlich durch den Gemeinsamen Bundesausschuss geregelt. Ab dem 20. Lebensjahr steht Frauen die Untersuchung einmal jährlich zu Lasten der Gesetzlichen Krankenversicherung zur Verfügung.[42] Die zytologische Abstrichentnahme erfolgt unter Spiegeleinstellung gezielt, möglichst unter kolposkopischer Kontrolle, von der Portiooberfläche sowie aus dem Zervikalkanal (mit einem Spatel oder einer kleinen Bürste). Ist bei der Spekuloskopie oder Kolposkopie vom makroskopischen Erscheinungsbild der Verdacht einer Veränderung vorhanden, sollte eine engmaschige Wiederholung der Abstrichuntersuchung durchgeführt werden. Bei wiederholt verdächtigen Befunden ist die Diagnostik um eine histologische Probenentnahme zu erweitern.
Bei immunsupprimierten Frauen wird zu zwei Früherkennungsuntersuchungen der Zervix im Jahr, alle zwei Jahre mit zusätzlichem Nachweis von Papillomviren, geraten.[35][43]
Während der Pap-Test bei einmaliger Durchführung etwa die Hälfte der Krebsfälle oder direkten Krebsvorstufen übersieht,[44][45] können mit der Kombination aus Pap-Test und Virusnachweis fast alle Krebsvorstufen erkannt werden.[46] 2017 empfahl die Deutsche Gesellschaft für Gynäkologie und Geburtshilfe daher unter Berücksichtigung neuer Studien in ihrer Leitlinie zum Zervixkarzinom die Durchführung eines HPV-Tests auch bei unauffälligem Pap-Test.[4][47][48] Zum 1. Januar 2020 startete daraufhin in Deutschland das Programm zur Früherkennung des Zervixkarzinoms, das bei Frauen ab 35 Jahren alle drei Jahre einen Kombinationsabstrich (Co-Test) aus Pap- und HPV-Test vorsieht. Bei unauffälligem Ergebnis wird der Co-Test nach drei Jahren wiederholt, jährliche Abstriche sind in diesem Fall nicht vorgesehen. Bei Nachweis eines Hochrisiko-HPV-Typs wird der Test nach einem Jahr wiederholt, bei wiederholtem HPV-Nachweis oder höhergradigen Zellveränderungen im Pap-Abstrich wird eine Kolposkopie mit Entnahme histologischer Proben durchgeführt. Für Frauen zwischen 20 und 34 wird weiterhin jährlich ein Pap-Test durchgeführt, da in dieser Altersgruppe der HPV-Test eine deutlich geringere Aussagekraft hat.[49]
Die Screening-Programme auf Gebärmutterhalskrebs unterscheiden sich in den Mitgliedsländern der Europäischen Union hinsichtlich der empfohlenen Zeitintervalle, der eingeschlossenen Altersgruppen und der Organisation des Screenings.[50]
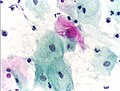
- Zytologische Befunde und histologischer Befund in Papanicolaou-Färbung
- Normale Plattenepithelzellen im Abstrich
- Atypische Zelle im Abstrich (Mitte)
- Plattenepithelkarzinom (histologischer Schnitt)
In Deutschland werden die Befunde nach der Münchner Nomenklatur II klassifiziert, während in englischsprachigen Ländern meist die Bethesda-Klassifikation zum Einsatz kommt.[51][52] Eine international verbindliche Klassifikation gibt es derzeit nicht.[53]
| Münchner Nomenklatur II / Pap | Münchner Nomenklatur II / Zytologischer Befund | Empfehlung | Bethesda-Klassifikation |
|---|---|---|---|
| I | Normales Zellbild | Routine-Kontrolle | Kein Anhalt für intraepitheliale Läsion oder Malignität |
| II | Deutliche entzündliche oder degenerative Veränderungen, unreife Metaplasie, HPV-Zeichen ohne wesentliche Zellkernveränderungen | Kontrolle in 1 Jahr | Kein Anhalt für intraepitheliale Läsion oder Malignität, geringgradige intraepitheliale Läsion (LSIL = Low grade squamous intraepithelial lesion) (bei HPV-Zeichen) |
| IIw/k (kein offizieller Bestandteil der Münchner Nomenklatur II, jedoch häufig angewandt) | Meist unzureichende Abstriche, die für eine Beurteilung nicht ausreichen, sowie Abstriche mit Zellveränderungen, die zwar nicht als definitiv abnorm, aber auch nicht als normal eingestuft werden können | Erneuter Abstrich (Abstrich wiederholen = w, Abstrich kontrollieren = k) | Atypische Plattenepithelzellen unklarer Bedeutung (ASC-US = Atypical squamous cells of undetermined significance), geringgradige intraepitheliale Läsion (bei HPV-Zeichen), atypische Drüsenzellen (AGC = Atypical glandular cells) |
| III | Schwere entzündliche oder degenerative Veränderung, die eine Beurteilung zwischen gut- und bösartig nicht zulässt. Auffällige Drüsenzellen, die eine Beurteilung zwischen gut- und bösartig nicht zulassen, ein Karzinom ist nicht sicher auszuschließen | Je nach klinischem Befund kurzfristige zytologische Kontrolle oder histologische Abklärung | Atypische Plattenepithelzellen unklarer Bedeutung, atypische Plattenepithelzellen – höhergradige intraepitheliale Läsionen (HSIL = High grade squamous intraepithelial lesion) nicht auszuschließen, atypische Drüsenzellen |
| IIID | Zellen einer leichten Dysplasie oder mäßigen Dysplasie | Erneute Abstrichuntersuchung und Kolposkopie in 3 Monaten, bei mehrfach auffälligen Befunden: histologische Klärung | Geringgradige intraepitheliale Läsion: milde Dysplasie, höhergradige intraepitheliale Läsion: mäßige Dysplasie |
| IVa | Hochgradig veränderte Zellen, (schwere) Dysplasie | Erneute Abstrichuntersuchung und Kolposkopie sowie histologische Klärung. | Höhergradige intraepitheliale Läsion: schwere Dysplasie, |
| IVb | Zellen einer schweren Dysplasie oder eines Carcinoma in situ, invasives Karzinom nicht auszuschließen | Erneute Abstrichuntersuchung und Kolposkopie sowie histologische Klärung | Kein Äquivalent |
| V | Zellen eines invasiven Zervixkarzinoms oder eines anderen invasiven Tumors | Histologische Sicherung | Plattenepithelkarzinom, Adenokarzinom, andere bösartige Neubildung |
| 0 | Technisch unbrauchbare Abstriche (z. B. zu wenig Material oder unzureichende Fixierung) | Sofortige Abstrichkontrolle | Kein Äquivalent |
Heilungsaussicht
| FIGO- Stadium | 5-Jahres-Überlebensrate in Deutschland[55] |
|---|---|
| IA | ca. 93 % |
| IB | ca. 92 % |
| IIA | ca. 63 % |
| IIB | ca. 50 % |
| III | ca. 40 % |
| IV | ca. 10 % |
Bei den Krebsvorstufen CIN I und II ist eine vollständige spontane Rückbildung möglich. Nach einer Behandlung des CIN III und Carcinoma in situ ist von einer vollständigen Heilung auszugehen. Allerdings kann es zu einem erneuten Auftreten solcher Veränderungen kommen. Das Risiko dafür scheint erhöht, wenn eine HPV-Infektion nach einer Konisation weiter besteht.[56][57]
Die Prognose des invasiven Zervixkarzinoms ist abhängig von Stadium, Differenzierungsgrad, Lymphknotenbefall, der Tumorart und der Behandlung. Dabei haben Adenokarzinome eine etwas schlechtere Prognose als Plattenepithelkarzinome. Auch eine alleinige Strahlentherapie ist mit einer etwas schlechteren Prognose im Vergleich zur operativen Behandlung verbunden.[27] Insgesamt liegt die 5-Jahres-Überlebensrate in Deutschland bei ca. 69 %, die 10-Jahres-Überlebensrate bei etwa 65 %.[58]
Geschichte
1878 beschrieben der Pathologe Carl Ruge und der Gynäkologe Johann Veit den Gebärmutterhalskrebs erstmals als eigenes Krankheitsbild. Bis dahin hatte man zwischen Gebärmutterhals- und Gebärmutterschleimhautkrebs (Endometriumkarzinom) nicht unterschieden. So hatte der deutsche Frauenarzt Adolf Gusserow 1870 als Erster ein Adenokarzinom (Adenoma malignum) des Gebärmutterhalses beschrieben. Er veröffentlichte die Erkenntnisse in seiner Arbeit Ueber Sarcome des Uterus.[59] Der österreichische Gynäkologe Walther Schauenstein entwickelte 1908 die bis heute gültige These der stufenweisen Pathogenese des Zervixkarzinoms. Seine Arbeit zu histologischen Untersuchungen bei atypischem Plattenepithel an der Portio war eine der ersten Beschreibungen des Oberflächenkarzinoms der Zervix.
Erste Gebärmutterentfernungen bei Krebserkrankungen der Gebärmutter auf vaginalem und abdominalem Weg wurden 1813 von Konrad Johann Martin Langenbeck in Kassel und 1822 von Johann Nepomuk Sauter in Konstanz durchgeführt. Die erste wissenschaftlich fundierte und reproduzierbare einfache Entfernung einer von Krebs befallenen Gebärmutter mittels eines Bauchschnittes führte am 30. Januar 1878 Wilhelm Alexander Freund in Breslau aus.[60][61] Der Eingriff war jedoch damals noch sehr riskant.[62][63] Am 12. August 1879 gelang dem Chirurgen Vincenz Czerny in Heidelberg die Hysterektomie durch die Scheide.[64] Da die Ergebnisse besser waren als bei der Freundschen Operation, wurde in der Folgezeit die vaginale Operation bevorzugt.[65][66]
Karl August Schuchardt führte 1893 in Stettin die erste erweiterte vaginale Gebärmutterentfernung durch, die 1901 von dem Wiener Gynäkologen Friedrich Schauta, später von Walter Stoeckel an der Charité in Berlin und Isidor Alfred Amreich in Wien weiterentwickelt wurde.[67] Der österreichische Gynäkologe Ernst Wertheim entwickelte 1898 eine radikale Operationsmethode über einen Bauchschnitt, die später der Amerikaner Joe Vincent Meigs weiterentwickelte.[68] Zu den Pionieren der Strahlenbehandlung des Zervixkarzinoms mit Radium gehört seit 1911 Albert Döderlein.[69] Erich Burghardt, ein österreichischer Gynäkologe, trug mit seinen Untersuchungen wesentlich zur Verminderung der operativen Radikalität bei Frühstadien des Zervixkarzinoms bei, das heißt zur Verkleinerung der Operation bei gleichen Heilungsergebnissen. Hans Hinselmann, ein deutscher Gynäkologe, entwickelte 1925 mit der Kolposkopie das erste Verfahren zur Früherkennung des Gebärmutterhalskrebses. 1928 erarbeitete der griechische Arzt George Nicolas Papanicolaou mit dem Pap-Test ein weiteres Verfahren zur Frühdiagnostik dieses Tumors. Besondere Verdienste um die Einführung der Zytologie in Verbindung mit der Kolposkopie als Früherkennungsmethode erwarb sich Ernst Navratil, ein österreichischer Gynäkologe. Am 9. Februar 1951 wurden bei einer 31-jährigen Patientin Zervixkarzinomzellen vom Muttermund entnommen, die später in Zellkulturen vermehrt und bis heute zu Forschungszwecken genutzt werden. Die Zellen werden, nach der Patientin Henrietta Lacks, als HeLa-Zellen bezeichnet.[70] 1971 erfolgte die Einführung des Zervixkarzinomscreenings als Programm in der Bundesrepublik Deutschland.[50]
1974 veröffentlichte Harald zur Hausen erste Berichte über eine mögliche Rolle von Papillomviren beim Zervixkarzinom, wofür ihm 2008 der Nobelpreis für Physiologie oder Medizin verliehen wurde.[71] Seit den 1990er Jahren kommt es durch die Einführung neuer Operationstechniken, wie der Trachelektomie oder der Totalen mesometrialen Resektion des Uterus und der Möglichkeit der Lymphknotenentfernung mittels einer Laparoskopie, zu einer stärkeren Individualisierung der operativen Therapie des Zervixkarzinoms mit teilweise bewusst reduzierter, teilweise verbesserter Vollständigkeit (Radikalität) der chirurgischen Karzinomentfernung. Ziel dieser Entwicklung ist, behandlungsbedingte Probleme, wie Blasen- oder Darmentleerungsstörungen durch Nervenschädigungen, oder Folgen einer bislang häufigen Strahlentherapie nach vorangegangener Operation zu vermeiden. In einigen Fällen kann sogar die Erfüllung eines Kinderwunsches ermöglicht werden. 2006 wurde der erste Impfstoff gegen einige Typen von Papillomaviren, der Hauptursache des Gebärmutterhalskrebses, zugelassen.
Literatur
- Harald zur Hausen: Infections causing human cancer. Wiley-VCH, Weinheim 2006, ISBN 3-527-31056-8.
- Manfred Kaufmann, Serban-Dan Costa, Anton Scharl (Hrsg.): Die Gynäkologie. 2., vollständig überarbeitete und aktualisierte Auflage. Springer, Berlin u. a. 2006, ISBN 3-540-25664-4.
- Willibald Pschyrembel, Günter Strauss, Eckhard Petri (Hrsg.): Praktische Gynäkologie. 5., neubearbeitete Auflage. Walter de Gruyter, Berlin u. a. 1991, ISBN 3-11-003735-1.
- Dirk Schadendorf, Wolfgang Queißer (Hrsg.): Krebsfrüherkennung. Allgemeine und spezielle Aspekte der sekundären Prävention maligner Tumoren. Steinkopff, Darmstadt 2003, ISBN 3-7985-1392-9.
- Heinrich Schmidt-Matthiesen, Gunther Bastert, Diethelm Wallwiener (Hrsg.): Gynäkologische Onkologie. Diagnostik, Therapie und Nachsorge – auf der Basis der AGO-Leitlinien. 7., neu bearbeitete und erweiterte Auflage. Schattauer, Stuttgart u. a. 2002, ISBN 3-7945-2182-X.
- Karl-Heinrich Wulf, Heinrich Schmidt-Matthiesen, Hans Georg Bender (Hrsg.): Klinik der Frauenheilkunde und Geburtshilfe. Band 11: Spezielle gynäkologische Onkologie. Teilband 1. 4. Auflage. Urban & Fischer, München 2001, ISBN 3-437-21900-6.
Weblinks
- Manual Zervixkarzinom. ( vom 13. August 2012 im Internet Archive) (PDF; 1,03 MB) Tumorzentrum München
- S3-Leitlinie Diagnostik, Therapie und Nachsorge der Patientin mit Zervixkarzinom der Deutschen Krebsgesellschaft e. V. und der Deutschen Gesellschaft für Gynäkologie und Geburtshilfe. In: AWMF online (Stand 05/2021)
- S3-Leitlinie Impfprävention HPV-assoziierter Neoplasien der Deutschen Krebsgesellschaft, der Deutschen Gesellschaft für Gynäkologie und Geburtshilfe. In: AWMF online (Stand 05/2020)
- Gebärmutterhalskrebs: Das Zervixkarzinom, Krebsinformationsdienst des Deutschen Krebsforschungszentrums (DKFZ), Heidelberg. 16. Juni 2006. Zuletzt abgerufen am 4. September 2014.
- Gebärmutterhalskrebs-Früherkennung: Ein Abstrich bietet Sicherheit – Krebsvorstufen früh erkennen und rechtzeitig behandeln, Krebsinformationsdienst des Deutschen Krebsforschungszentrums (DKFZ), Heidelberg. 11. Mai 2010. Zuletzt abgerufen am 4. September 2014.
- Informationen und Aufklärung über Gebärmutterhalskrebs und HPV der ZERVITA
- Informationen zu Gebärmutterhalskrebs vom Zentrum für Krebsregisterdaten im Robert Koch-Institut
Einzelnachweise
- ↑ F. Marra, K. Cloutier u. a.: Effectiveness and cost effectiveness of human papillomavirus vaccine: a systematic review. In: Pharmacoeconomics. Band 27, Nummer 2, 2009, S. 127–147, ISSN 1170-7690. PMID 19254046. (Review).
- ↑ Cancer Incidence and Mortality Worldwide in 2012 Abgerufen am 22. August 2014.
- ↑ a b c d e f g M. Streich: Das Zervixkarzinom: praxisrelevante Aspekte. Prävention, Diagnostik, Therapie. In: Der Gynäkologe. Band 6, 2005, S, 23–25
- ↑ a b c d e f g h i j k l m 2k-Leitlinie Diagnostik und Therapie des Zervixkarzinoms ( vom 17. September 2008 im Internet Archive) der Deutschen Krebsgesellschaft e. V. und der Deutschen Gesellschaft für Gynäkologie und Geburtshilfe
- ↑ a b c M. W. Beckmann, G. Mehlhorn u. a.: Therapiefortschritte beim primären Zervixkarzinom (PDF; 406 kB). In: Dtsch Arztebl. Band 102, 2005, A-979
- ↑ a b Krebs - Gebärmutterhalskrebs. Abgerufen am 30. Mai 2023.
- ↑ J. S. Smith, J. Green u. a.: Cervical cancer and use of hormonal contraceptives: a systematic review. In: Lancet. Band 361, Nummer 9364, April 2003, S. 1159–1167, ISSN 0140-6736. PMID 12686037. (Review).
- ↑ International Collaboration of Epidemiological Studies of Cervical Cancer: Cervical cancer and hormonal contraceptives: collaborative reanalysis of individual data for 16,573 women with cervical cancer and 35,509 women without cervical cancer from 24 epidemiological studies. In: Lancet. Band 370, Nummer 9599, November 2007, S. 1609–1621, ISSN 1474-547X. doi:10.1016/S0140-6736(07)61684-5. PMID 17993361. (Review).
- ↑ A. Berrington de González, S. Sweetland, J. Green: Comparison of risk factors for squamous cell and adenocarcinomas of the cervix: a meta-analysis. In: British Journal of Cancer. Band 90, Nummer 9, Mai 2004, S. 1787–1791, ISSN 0007-0920. doi:10.1038/sj.bjc.6601764. PMID 15150591. PMC 2409738 (freier Volltext).
- ↑ D. Ramachandran, T. Dörk: Genomic risk factors for cervical cancer. In: Cancers. Band 13, Nummer 20, October 2021, S. 5137. PMID 34680286. (Review).
- ↑ C. T. Eckardt: Ein Fall von Cervixcarcinom bei einer neunzehnjährigen Jungfrau. In: Arch Gynecol Obstet. Band 30, 1887, S. 471–478, doi:10.1007/BF01976292
- ↑ X. Castellsagué, M. Díaz u. a.: Intrauterine device use, cervical infection with human papillomavirus, and risk of cervical cancer: a pooled analysis of 26 epidemiological studies. In: The Lancet Oncology. Band 12, Nummer 11, Oktober 2011, S. 1023–1031, ISSN 1474-5488. doi:10.1016/S1470-2045(11)70223-6. PMID 21917519.
- ↑ M. Hüsler, U. Lauper: Infektprophylaxe in der Schwangerschaft In: Gynäkologie. Band 5, 2006, S. 6–12.
- ↑ C. Sonnex, S. Strauss, J. J. Gray: Detection of human papillomavirus DNA on the fingers of patients with genital warts. In: Sexually transmitted infections. Band 75, Nummer 5, Oktober 1999, S. 317–319, ISSN 1368-4973. PMID 10616355. PMC 1758241 (freier Volltext).
- ↑ M. A. van Ham, J. M. Bakkers u. a.: comparison of two commercial assays for detection of human papillomavirus (HPV) in cervical scrape specimens: validation of the Roche AMPLICOR HPV test as a means to screen for HPV genotypes associated with a higher risk of cervical disorders. In: Journal of Clinical Microbiology. Band 43, Nummer 6, Juni 2005, S. 2662–2667, ISSN 0095-1137. doi:10.1128/JCM.43.6.2662-2667.2005. PMID 15956381. PMC 1151918 (freier Volltext).
- ↑ A. S. Kapeu, T. Luostarinen u. a.: Is smoking an independent risk factor for invasive cervical cancer? A nested case-control study within Nordic biobanks. In: American Journal of Epidemiology. Band 169, Nummer 4, Februar 2009, S. 480–488, ISSN 1476-6256. doi:10.1093/aje/kwn354. PMID 19074773.
- ↑ International Collaboration of Epidemiological Studies of Cervical Cancer, P. Appleby u. a.: Carcinoma of the cervix and tobacco smoking: collaborative reanalysis of individual data on 13,541 women with carcinoma of the cervix and 23,017 women without carcinoma of the cervix from 23 epidemiological studies. In: International Journal of Cancer. Band 118, Nummer 6, März 2006, S. 1481–1495, ISSN 0020-7136. doi:10.1002/ijc.21493. PMID 16206285.
- ↑ W. I. Al-Daraji, J. H. Smith: Infection and cervical neoplasia: facts and fiction. In: International Journal of Clinical and Experimental Pathology. Band 2, Nummer 1, 2009, S. 48–64, ISSN 1936-2625. PMID 18830380. PMC 2491386 (freier Volltext).
- ↑ J. S. Smith, C. Bosetti u. a.: Chlamydia trachomatis and invasive cervical cancer: a pooled analysis of the IARC multicentric case-control study. In: International Journal of Cancer. Band 111, Nummer 3, September 2004, S. 431–439, ISSN 0020-7136. doi:10.1002/ijc.20257. PMID 15221973.
- ↑ a b W. Pschyrembel, G. Strauss, Eckhard Petri: Praktische Gynäkologie. 5. Auflage. Walter de Gruyter Verlag, 1991, 74–152, ISBN 3-11-003735-1.
- ↑ O. Reich: Ist die frühe Kohabitarche ein Risikofaktor des Zervixkarzinoms? In: Gynäkol Geburtshilfliche Rundsch. Band 45, 2005, S. 251–256 doi:10.1159/000087143
- ↑ J. D. Wright, K. Rosenblum u. a.: Cervical sarcomas: an analysis of incidence and outcome. In: Gynecologic oncology. Band 99, Nummer 2, November 2005, S. 348–351, ISSN 0090-8258. doi:10.1016/j.ygyno.2005.06.021. PMID 16051326.
- ↑ a b c H. Schmidt-Matthiesen, G. Bastert, D. Wallwiener: Gynäkologische Onkologie – Diagnostik, Therapie und Nachsorge auf der Basis der AGO-Leitlinien. 10. Auflage. 2002, Schattauer Verlag, 105, ISBN 3-7945-2182-X.
- ↑ a b C. Wittekind (Hrsg.): TNM. Klassifikation maligner Tumoren. Achte Auflage.Wiley-VCH Verlag 2017, ISBN 978-3-527-34280-8.
- ↑ L.-C. Horn, K. Schierle, D. Schmidt, U. Ulrich: Neues TNM/FIGO-Staging-System für das Zervix- und Endometriumkarzinom sowie maligne Müller’sche Mischtumoren (MMMT) des Uterus. In: Geburtsh Frauenheilk. Band 69, 2009, S. 1078–1081, doi:10.1055/s-0029-1240644
- ↑ L.-C. Horn, K. Schierle, D. Schmidt, U. Ulrich, A. Liebmann, C. Wittekind: Aktualisiertes TNM/FIGO-Staging-System für das Zervix- und Endometriumkarzinom sowie maligne Müller’sche Mischtumoren (MMMT) des Uterus. Fakten und Hintergrund. In: Der Pathologe. Band 32, Nummer 3, Mai 2011, S. 239–243, ISSN 1432-1963. doi:10.1007/s00292-010-1273-6. PMID 20084383. (Review).
- ↑ a b H. Schmidt-Matthiesen, H. Kühnle: Präneoplasien und Neoplasien der Cervix uteri. In: K. H. Wulf, H. Schmidt-Matthiesen: Klinik der Frauenheilkunde und Geburtshilfe. Band 11: Spezielle gynäkologische Onkologie I. 3. Auflage. Urban & Schwarzenberg, 1991, ISBN 3-541-15113-7, S. 131–206.
- ↑ M. S. Piver, F. Rutledge, J. P. Smith: Five classes of extended hysterectomy for women with cervical cancer. In: Obstetrics and gynecology. Band 44, Nummer 2, August 1974, S. 265–272, ISSN 0029-7844. PMID 4417035.
- ↑ M. Höckel: Totale mesometriale Resektion: Ein neues Radikalitätsprinzip in der operativen Therapie des Zervixkarzinoms. In: Onkologe. 12, 2006, S. 901–907, doi:10.1007/s00761-006-1110-y
- ↑ M. Höckel, L. C. Horn, N. Manthey, U. D. Braumann, U. Wolf, G. Teichmann, K. Frauenschläger, N. Dornhöfer, J. Einenkel: Resection of the embryologically defined uterovaginal (Müllerian) compartment and pelvic control in patients with cervical cancer: a prospective analysis. In: Lancet Oncol. Band 10, Nr. 7, 2009, S. 683–692. doi:10.1016/S1470-2045(09)70100-7.
- ↑ M. Possover: Technical modification of the nerve-sparing laparoscopy-assisted vaginal radical hysterectomy type 3 for better reproducibility of this procedure. In: Gynecologic oncology. Band 90, Nummer 2, August 2003, S. 245–247, ISSN 0090-8258. PMID 12893183.
- ↑ M. Possover: Options for laparoscopic surgery in cervical carcinomas. In: European Journal of Gynaecological Oncology. Band 24, Nummer 6, 2003, S. 471–472, ISSN 0392-2936. PMID 14658583. (Review).
- ↑ D. Dargent, J. L. Brun u. a.: La trachélectomie élargie (TE). Une alternative à l’hystérectomie radicale dans le traitement des cancers infiltrants dévellopés sur la face externe du col utérine. In: J Obstet Gynecol. Band 2, 1994, S. 285–292.
- ↑ Manual Zervixkarzinom ( vom 27. Oktober 2011 im Internet Archive) (PDF) des Tumorzentrums München, 2004, S. 73–77.
- ↑ a b c 2 + IDA-Leitlinie Prävention, Diagnostik und Therapie der HPV-Infektion und präinvasiver Läsionen des weiblichen Genitale der Deutschen Krebsgesellschaft e. V., der Deutschen Gesellschaft für Gynäkologie und Geburtshilfe, des Berufsverbandes der Frauenärzte, der Deutschen Gesellschaft für Pathologie, der Deutschen Gesellschaft für Urologie, der Deutschen Krebsgesellschaft, Deutsche STD-Gesellschaft und der Frauenselbsthilfe nach Krebs. In: AWMF online (Stand 06/2008)
- ↑ L. E. Manhart, L. A. Koutsky: Do condoms prevent genital HPV infection, external genital warts, or cervical neoplasia? A meta-analysis. In: Sexually Transmitted Diseases. Band 29, Nummer 11, November 2002, S. 725–735, ISSN 0148-5717. PMID 12438912.
- ↑ GBA-Beschluss HPV-Impfung für Jugendliche wird Kassenleistung ( vom 30. Juni 2007 im Internet Archive) GBA-Beschluss HPV-Impfung für Jugendliche wird Kassenleistung
- ↑ Humane Papillomviren. RKI-Ratgeber. In: RKI. 28. Juni 2018, abgerufen am 27. Januar 2022.
- ↑ Antworten auf häufig gestellte Fragen (FAQ) zu Erreger und Impfung. Impfungen A - Z. In: RKI. 22. Oktober 2020, abgerufen am 27. Januar 2022.
- ↑ Maximilian Stehr et al.: Phimose und Paraphimose bei Kindern und Jugendlichen. (PDF) S2k-Leitlinie. Deutsche Gesellschaft für Kinderchirurgie, Dezember 2021, S. 31, abgerufen am 12. Oktober 2023.
- ↑ Global strategy to accelerate the elimination of cervical cancer as a public health problem. (PDF; 2,8 MB) WHO, 17. November 2020, S. 25–26, abgerufen am 23. November 2023 (englisch, ISBN 978-92-4-001410-7).
- ↑ Richtlinien des Bundesausschusses der Ärzte und Krankenkassen über die Früherkennung von Krebserkrankungen („Krebsfrüherkennungs-Richtlinien“). (PDF; 544 kB)
- ↑ K. U. Petry, D. Scheffel u. a.: Cellular immunodeficiency enhances the progression of human papillomavirus-associated cervical lesions. In: International Journal of Cancer. Band 57, Nummer 6, Juni 1994, S. 836–840, ISSN 0020-7136. PMID 7911455.
- ↑ G. Ronco, P. Giorgi-Rossi u. a.: Results at recruitment from a randomized controlled trial comparing human papillomavirus testing alone with conventional cytology as the primary cervical cancer screening test. In: Journal of the National Cancer Institute. Band 100, Nummer 7, April 2008, S. 492–501, ISSN 1460-2105. doi:10.1093/jnci/djn065. PMID 18364502.
- ↑ M. H. Mayrand, E. Duarte-Franco u. a.: Human papillomavirus DNA versus Papanicolaou screening tests for cervical cancer. In: The New England Journal of Medicine. Band 357, Nummer 16, Oktober 2007, S. 1579–1588, ISSN 1533-4406. doi:10.1056/NEJMoa071430. PMID 17942871.
- ↑ K. U. Petry, S. Menton u. a.: Inclusion of HPV testing in routine cervical cancer screening for women above 29 years in Germany: results for 8466 patients. In: British Journal of Cancer. Band 88, Nummer 10, Mai 2003, S. 1570–1577, ISSN 0007-0920. doi:10.1038/sj.bjc.6600918. PMID 12771924. PMC 2377109 (freier Volltext).
- ↑ A. Warpakowski: Zervixkarzinom-Screening: Wann der HPV-Test sinnvoll ist. In: Dtsch Arztebl. Band 105, 2008, A-2541 (PDF; 195 kB)
- ↑ Link zur Leitlinie “Prävention, Diagnostik und Therapie …” (PDF)
- ↑ Richtlinie des Gemeinsamen Bundesausschusses für organisierte Krebsfrüherkennungsprogramme. (PDF) In: kvb.de. Kassenärztliche Vereinigung Bayerns, 1. Juli 2021, abgerufen am 11. Oktober 2022.
- ↑ a b c Frank W, Konta B, Peters-Engel C: PAP-Test zum Screening auf Zervixkarzinom (PDF; 629 kB) DAHTA@DIMDI, 2005.
- ↑ U. Schenck: Befundwiedergabe in der Zytologie: Münchner Nomenklatur II und Bethesda System 1991. In: U. Schenck (Hrsg.): Referateband der 13. Fortbildungstagung für klinische Zytologie München 1995. S. 224–233.
- ↑ a b B. S. Apgar, L. Zoschnick, T. C. Wright:The 2001 Bethesda System terminology. ( des vom 5. September 2008 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. In: American family physician. Band 68, Nummer 10, November 2003, S. 1992–1998, ISSN 0002-838X. PMID 14655809. (Review).
- ↑ a b Arbeitsgruppe «Guideline Zervixabstrich»: Guideline zum Vorgehen bei suspektemund positivem zytologischen Abstrichder Cervix Uteri. (PDF) Abgerufen am 8. Oktober 2019.
- ↑ Empfehlungen der ZERVITA – Informationen und Aufklärung über Gebärmutterhalskrebs und HPV ( vom 31. Januar 2012 im Internet Archive) (PDF; 5 kB)
- ↑ Überleben C53: Zervixkarzinom ( vom 31. Januar 2012 im Internet Archive) (PDF; 143 kB) des Tumorregisters München (2007)
- ↑ K. Bodner, B. Bodner-Adler u. a.: Is therapeutic conization sufficient to eliminate a high-risk HPV infection of the uterine cervix? A clinicopathological analysis. In: Anticancer Research. Band 22, Nummer 6B, 2002 Nov-Dec, S. 3733–3736, ISSN 0250-7005. PMID 12552985.
- ↑ Y. Nagai, T. Maehama u. a.: Persistence of human papillomavirus infection after therapeutic conization for CIN 3: is it an alarm for disease recurrence? In: Gynecologic oncology. Band 79, Nummer 2, November 2000, S. 294–299, ISSN 0090-8258. doi:10.1006/gyno.2000.5952. PMID 11063660.
- ↑ Daten zum Gebärmutterhalskrebs (Zervixkarzinom) des Robert Koch-Instituts (2014)
- ↑ A. Gusserow: Ueber Sarcome des Uterus. In: Arch Gynecol Obstet. Band 1, 1870, S. 240–251, doi:10.1007/BF01814006
- ↑ W. A. Freund: Eine neue Methode der Exstirpation des ganzen Uterus. In: Berliner Klin Wochenschrift. 1878, S. 417–418.
- ↑ W. A. Freund: Eine neue Methode der Exstirpation des ganzen Uterus. Sammlung klinischer Vorträge. In: R. Volkmann (Hrsg.): Verbindung mit deutschen Klinikern. Band 41, 1878, Verlag Breitkopf und Härtel, Leipzig, S. 911–924.
- ↑ B. Credé: Eine neue Methode der Exstirpation des Uterus. In: Arch Gynecol Obstet. Band 14, 1879, S. 430–437, doi:10.1007/BF01690793
- ↑ Spiegelberg: Ein weiterer Fall von papillärem hydropischen Cervixsarcom und von Exstirpation nach Freund. In: Arch Gynecol Obstet. Band 15, 1880, S. 437–447, doi:10.1007/BF01687155
- ↑ J. Zander: Milestones in Gynecology and Obstetrics. In: H. Ludwig, K. Thomsen (Hrsg.): Proceedings of the XIth World Congress of Gynecology and Obstetrics, Berlin, 1985. Springer Verlag, Heidelberg, 1986, ISBN 3-540-15559-7, S. 3–24.
- ↑ H. Dietel: 75 Jahre Nordwestdeutsche Gesellschaft für Gynäkologie und Geburtshilfe 1909 bis 1984. (PDF; 494 kB)
- ↑ H. Ludwig:Die Gründung der Deutschen Gesellschaft für Gynäkologie (1885) ( vom 16. Oktober 2014 im Internet Archive) (PDF). In: Frauenarzt. Band 46, 2005, S. 928–932 (PDF; 749 kB)
- ↑ M. Possover, S. Kamprath, A. Schneider: The historical development of radical vaginal operation of cervix carcinoma. In: Zentralbl Gynakol. Band 119, 1997, S. 353–358. PMID 9340975
- ↑ O. Käser, F. A. Iklè: Atlas der gynäkologischen Operationen. Georg Thieme Verlag Stuttgart, 1965, S. 263–307.
- ↑ Paul Diepgen, Heinz Goerke: Aschoff/Diepgen/Goerke: Kurze Übersichtstabelle zur Geschichte der Medizin. 7., neubearbeitete Auflage. Springer, Berlin/Göttingen/Heidelberg 1960, S. 67.
- ↑ T. Sharrer: HeLa Herself. In: The Scientist. Band 20, 2006, S. 22.
- ↑ H. zur Hausen:Papillomviren als Krebserreger. ( vom 15. Oktober 2014 im Internet Archive) (PDF). In: Geburtsh Frauenheilk. Band 58, 1998, S. 291–296. doi:10.1055/s-2007-1022461
Auf dieser Seite verwendete Medien
Title: Pathology: Histology: Cervical Cancer
Description: Histological section showing cervical cancer specifically squamous cell carcinoma in the cervix. Tissue is stained with pap stain and magnified x200.
Subjects (names):
Topics/Categories: Pathology -- Histology
Type: Color Slide
Source: National Cancer Institute
Author: Unknown photographer
AV Number: AV-9303-4404
Date Created: March 1993
Date Entered: 1/1/2001
Access: PublicAutor/Urheber: Tdvorak, Lizenz: CC BY-SA 3.0
Example of an AP radiation therapy treatment field for Stage IB2+ Cervix used at Tufts/Brown residency program. Actual patient contours should guide field design.
- Superior border: L4/L5. If common illiac LN involvement, superior border should extend to L3/L4 or higher to cover the disease with 3 cm margin
- Inferior border: inferior edge of pubic ramus. If vaginal involvement, inferior border should extend 3-4 cm past the vaginal extent of the disease, as marked by a gold seed
- Lateral borders: ~2cm lateral to bony pelvis, in order to cover lymph nodes
- Red: cervix; Blue: uterus; Khaki: bladder; Brown: rectum
- Orange: common illiac LNs; Yellow: external illiac LNs; Light Green: obturator LNs; Purple: internal illiac LNs; Dark Green: presacral LNs
- Please see lateral field
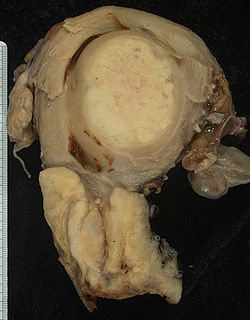
Autor/Urheber: Ed Uthman, MD., Lizenz: CC BY-SA 2.0
Squamous carcinoma of the cervix and incidental benign leiomyoma
This large squamous carcinoma (bottom of picture) has obliterated the cervix and invaded the lower uterine segment. The uterus also has a round leiomyoma up higher.Autor/Urheber: Die Autorenschaft wurde nicht in einer maschinell lesbaren Form angegeben. Es wird KGH als Autor angenommen (basierend auf den Rechteinhaber-Angaben)., Lizenz: CC BY-SA 3.0
Histopathogic image of endocervical adenocarcinoma. Endocervical biopsy. H & E stain.
Autor/Urheber: myself (Alex_brollo), Lizenz: CC BY-SA 3.0
Pap test, Papanicolau stain, 400x. Normal squamous epithelial cells in a premenopausal women.
Autor/Urheber: Die Autorenschaft wurde nicht in einer maschinell lesbaren Form angegeben. Es wird KGH als Autor angenommen (basierend auf den Rechteinhaber-Angaben)., Lizenz: CC BY-SA 3.0
Histopathologic image of cervical intraepithelial neoplasia (CIN3). H & E stain.
Autor/Urheber: Die Autorenschaft wurde nicht in einer maschinell lesbaren Form angegeben. Es wird KGH als Autor angenommen (basierend auf den Rechteinhaber-Angaben)., Lizenz: CC BY-SA 3.0
Histopathologic image of cervical intraepithelial neoplasia with koilocytosis. H & E stain.
Autor/Urheber: Dr Graham Beards, Lizenz: CC BY-SA 4.0
Pathology: EM: Papilloma Virus (HPV).
Autor/Urheber: Die Autorenschaft wurde nicht in einer maschinell lesbaren Form angegeben. Es wird KGH als Autor angenommen (basierend auf den Rechteinhaber-Angaben)., Lizenz: CC BY-SA 3.0
Histopathologic image of normal nonkeratinizing cervical epithelium. H & E stain.
Autor/Urheber: Die Autorenschaft wurde nicht in einer maschinell lesbaren Form angegeben. Es wird KGH als Autor angenommen (basierend auf den Rechteinhaber-Angaben)., Lizenz: CC BY-SA 3.0
Histopathologic image of cervical intraepithelial neoplasia (CIN2). H & E stain.
Autor/Urheber: myself (Alex_brollo), Lizenz: CC BY-SA 3.0
Pap test, Papanicolau stain, 400x. An obviously atypical cell can be seen.
Autor/Urheber: Ed Uthman, MD., Lizenz: CC BY 2.0
Squamous Carcinoma of Cervix