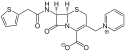
Cefaloridin
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Cefaloridin | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C19H17N3O4S2 | |||||||||||||||||||||
| Kurzbeschreibung | weißer Feststoff[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | J01DB02 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus | Störung der Zellwandsynthese | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 415,48 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand | fest[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Cefaloridin ist ein Antibiotikum, welches zur Klasse der Cephalosporine der 1. Generation zählt und semisynthetisch hergestellt wird. Wegen seiner Nephrotoxizität (giftigen Wirkung auf die Nieren) wurde es schon in den 1980er Jahren kaum noch verwendet.[4]
Cefaloridin wurde 1965 nach der Synthese von 7-Aminocephalospransäure von Glaxo patentiert (Cepaloridin-Glaxo).[5][6]
Indikation
Cefaloridin ist bei Infektionen mit Streptokokken, Pneumokokken und Staphylokokken wirksam. Indolpositive Proteus-Spezies und Pseudomonas aeruginosa sind gegen dieses Antibiotikum resistent.[7] Cefaloridin wurde bei Infektionen des Blutes, des Knochens, der Gelenke, der Atemwege, der Haut und der Harnwege verwendet sowie prophylaktisch während Operationen. In der Veterinärmedizin diente es bei Hunden und Katzen der Behandlung von Infektionen der Atemwege, des Darms und der Harnwege.[8]
Wirkungsprinzip
Die Cefaloridin-Moleküle binden sich an spezifische Penicillin-bindende Proteine, welche sich in der bakteriellen Zellwand befinden. Dadurch wird die weitere Synthese der bakteriellen Zellwand gehindert.[7]
Das Antibiotikum wird über die Nieren aus dem Körper ausgeschieden.[3]
Applizierung
Cefaloridin ist parenteral (intravenös, intramuskulär) zu verabreichen.[7]
Nebenwirkungen
Cefaloridin ist stark nephrotoxisch, weswegen es kaum mehr verwendet wird.[4][9]
Synthese
Die Synthese von Cefaloridin bzw. Cefalotin geschieht über eine Semisynthese, welches in diesem Fall die Acylierung einer Aminogruppe bedeutet. Die zu acylierende 7-Aminocephalospransäure (kurz 7-ACA) wird dabei durch eine chemische Reaktion aus Penicillin G mithilfe von N,N′-Bis(trimethylsilyl)harnstoff umgewandelt.[10]
Zunächst wird durch die Reaktion von 7-ACA (2) mit Thiophenylacetylchlorid (1) in Aceton Cefalotin (3) gebildet.

Durch Erhitzen von Cefalotin, Thiocyanat, Pyridin und Phosphorsäure und anschließendem Einstellen des pH-Wertes mit Mineralsäure wird Cefaloridin gebildet.[11]
Bei einem physiologischen pH-Wert liegt das Cefaloridin-Molekül als Zwitterion vor.[3]
Einzelnachweise
- ↑ a b Biosynth Carbosynth: Cephaloridine | 50-59-9 | Biosynth Carbosynth, abgerufen am 23. Januar 2022.
- ↑ a b Datenblatt Cefaloridin (PDF) bei BLD Pharmatech, Katalognummer: BD120380, abgerufen am 23. Mai 2022.
- ↑ a b c Eintrag zu Cefaloridine in der DrugBank der University of Alberta, abgerufen am 22. Mai 2019.
- ↑ a b Ernst Mutschler, Björn Lemmer (Hrsg.): Wörterbuch der Pharmazie. Band 2: Pharmakologie, Medizinische Grundbegriffe. WVG, Stuttgart 1985, ISBN 3-8047-0667-3, S. 105.
- ↑ Jürgen Falbe (Hrsg.): Römpp-Lexikon Chemie. 10., völlig überarb. Auflage. Band 1: A-Cl. Thieme, Stuttgart 1996, ISBN 3-13-734610-X, S. 631.
- ↑ I. S. Mason, M. Kietzmann: Cephalosporins – pharmacological basis of clinical use in veterinary dermatology. In: Veterinary Dermatology. Vol. 10, Nr. 3, 1999, S. 187–192, doi:10.1046/j.1365-3164.1999.00183.x.
- ↑ a b c Gunter Schmidt: Cephalosporine. In: Chemie in unserer Zeit. Band 10, Nr. 6, 1976, S. 189–195, doi:10.1002/ciuz.19760100605.
- ↑ R. K. Chaudhary, A. K. Srivastava: Disposition and dosage regimen of cephaloridine in calves. In: Veterinary Research Communications. Vol. 13, Nr. 4, 1989, S. 325–329, doi:10.1007/BF00420839, PMID 2781723.
- ↑ Martindale: The Complete Drug Reference. 38. Auflage. Pharmaceutical Press, London 2014, ISBN 978-0-85711-139-5, S. 235.
- ↑ Alle Bruggink (Hrsg.): Synthesis of β-Lactam Antibiotics: Chemistry, Biocatalysis & Process Integration. Springer Science+Business Media, Dortrecht 2001, ISBN 0-7923-7060-0, S. 15.
- ↑ Eintrag zu Cephaloridine in der Hazardous Substances Data Bank (via PubChem), abgerufen am 27. Mai 2019.
Auf dieser Seite verwendete Medien
Autor/Urheber: Lisa1223S, Lizenz: CC BY-SA 4.0
Synthese von Cefalotin aus 7-ACA und Thiophenylacetylchlorid