Catenane

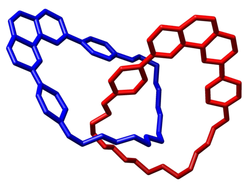

Catenane sind in der Chemie Stoffe, die aus zwei oder mehr mechanisch (wie Glieder einer Kette) verknüpften Ringen – meist Makrocyclen – bestehen. Diese Ringe können nicht voneinander getrennt werden, ohne mindestens eine kovalente Ringbindung eines macrocyclischen Ringes zu brechen. Die Bezeichnung Catenane geht zurück auf das lateinische Wort catena mit der Bedeutung „Kette“. Neben den Catenanen zählen Rotaxane und molekulare Knoten zur Gruppe der mechanisch verknüpften molekularen Architekturen.
Geschichte
Die Idee der Synthese verzahnter Moleküle wird meist Richard Willstätter in einem Seminar in Zürich zwischen 1906 und 1912 zugeschrieben.[1] Ernsthafte Versuche der Synthese setzten in den 1950er Jahren ein (unter anderem Arthur Lüttringhaus und Friedrich Cramer, zunächst erfolglos). Der erste experimentelle Nachweis der Synthese eines Catenans (wenn auch in geringer Ausbeute) erfolgte durch Edel Wasserman 1960,[2][3] damals an den Bell Laboratories. Er führte auch den Begriff Catenane ein. Die Synthese von Catenanen mittels gerichteter kovalenter Bindungen (nach einem grundsätzlichen Konzept von Wasserman und Harry L. Frisch) erfolgte 1964 durch Lüttringhaus und Gottfried Schill.[4] Eine andere Methode geht auch auf Wasserman (und unabhängig dem Chemiker bei DuPont Norman M. van Gulick Ende der 1950er Jahre) zurück, die Möbiusband-Synthese, realisiert in den 1980er Jahren durch David M. Walba. Die Synthese von Catenanen gelang aber lange nur in geringen Ausbeuten und komplizierten Syntheseschritten, bis die Templatmethode mit Metallkomplexen von Jean-Pierre Sauvage von 1983[5] das Gebiet revolutionierte. Ab Anfang der 1990er Jahre synthetisierte er n-Catenane (mit n=2 bis 7 Ringen). Sauvage erhielt unter anderem dafür 2016 den Nobelpreis für Chemie.
Synthese
Für die Synthese von Catenanen gibt es zwei unterschiedliche Methoden. Bei der Durchführung einer Cyclisierungsreaktion kann man darauf hoffen, dass sich die Ringe vor dem zweiten und bei weiteren Cyclisierungen so anordnen, dass sich das gewünschte Catenan bildet. Dies ist der so genannte „statistische Ansatz“ der zur ersten Synthese eines Catenans führte. Allerdings ist diese Methode sehr ineffizient. Allenfalls bei hoher Verdünnung der Reaktionspartner bei der mechanischen Verknüpfung und einem großen Überschuss des zuvor gebildeten ersten makrocyclischen Rings, funktioniert dieses Verfahren leidlich. Dieses Syntheseprinzip besitzt vorwiegend historische Bedeutung.
Die zweite Methode beruht auf supramolekularer Präorganisation der makrocyclischen Vorläufer unter Ausnutzung von Wasserstoffbrückenbindungen, der Koordination von Metallen, hydrophoben Kräften oder Coulomb-Wechselwirkungen. Diese nicht-kovalenten Wechselwirkungen kompensieren die entropischen Nachteile des Assoziation und lenken die Edukte an günstige Plätze für die Bildung der gewünschten Catenane beim letzten Ringschluss. Dieser „templatgesteuerte“ Ansatz kann mit der simultanen Anwendung hohen Drucks in Ausbeuten von über 90 % zu Catenanen führen.
- Catenan-Familien
- Catenane
- Brezelane (→ Brezel)
- „Handschellen“-Catenane
Spezielle Catenane
Im Jahre 1994 gelang den Forschern James Fraser Stoddart und David Amabilino und ihren Forschungsgruppen die Synthese eines [5]-Catenans, das sie Olympiadane (deutsch Olympiadan) nannten, in Anlehnung an die fünf olympischen Ringe. Das Olympiadan hat keinen expliziten Zweck, sondern ist lediglich ein Beitrag zur Grundlagenforschung. Die Synthese sollte die Machbarkeit solcher Synthesen untersuchen.[6]
Literatur
- Gottfried Schill: Catenanes, Rotaxanes and Knots, Academic Press 1971, ISBN 9781483275666 (Organic chemistry : a series of monographs 22)
- Jean-Pierre Sauvage, Christiane Dietrich-Buchecker (Hrsg.): Molecular Catenanes, Rotaxanes and Knots, Wiley-VCH 1999
- Guzmán Gil‐Ramírez, David A. Leigh, Alexander J. Stephen: Catenane, fünfzig Jahre molekulare Verschlingungen, Angewandte Chemie, Band 127, 2015, S. 6208–6249, Online
- Y. Liu, S. A. Vignon, X. Zhang, P. A. Bonvallet, S. I. Khan, K. N. Houk und J. F. Stoddart: Dynamic Chirality in Donor-Acceptor Pretzelanes. In: The Journal of Organic Chemistry. Band 70, Nr. 23, 2005, S. 9334–9344, doi:10.1021/jo051430g (Detaillierte molekulare Struktur).
- Julien Frey, Tomá Kraus, Valérie Heitz und Jean-Pierre Sauvage: A catenane consisting of a large ring threaded through both cyclic units of a handcuff-like compound. In: Chemical Communications. Band 42, 2005, S. 5310–5312, doi:10.1039/B509745B (Detaillierte molekulare Struktur) (PDF; 69 kB).
- O. Safarowsky, B. Windisch, A. Mohry, F. Vögtle: Nomenclature for Catenanes, Rotaxanes, Molecular Knots, and Assemblies Derived from These Structural Elements. In: Journal für praktische Chemie. Band 342, Nr. 5, 2000, S. 437–444, doi:10.1002/1521-3897(200006)342:5<437::AID-PRAC437>3.0.CO;2-7.
Einzelnachweise
- ↑ Guzmán Gil‐Ramírez, David A. Leigh, Alexander J. Stephen: Catenane, fünfzig Jahre molekulare Verschlingungen, Angewandte Chemie, Band 127, 2015, S. 6208–6249, Online
- ↑ E. Wasserman, J. Am. Chem. Soc., Band 82, 1960, S. 4433–4434
- ↑ Edel Wasserman: Chemical Topology, Scientific American, November 1962
- ↑ Lüttringhaus, Schill: Gezielte Synthese von Catena‐Verbindungen (1), Angewandte Chemie, Band 76, 1964, S. 567–568
- ↑ Jean-Pierre Sauvage, Christiane Dietrich-Buchecker, J. P. Kinzinger: Une nouvelle famille de molecules : les metallo-catenanes, Tetrahedron Letters, Band 24, 1983, S. 5095–5098
- ↑ David B. Amabilino, Peter R. Ashton, Anatoli S. Reder, Neil Spencer, J. Fraser Stoddart: Olympiadane. In: Angewandte Chemie International Edition. Band 33, 1994, S. 1286–1290, doi:10.1002/anie.199412861.
Auf dieser Seite verwendete Medien
(c) M stone aus der englischsprachigen Wikipedia, CC BY-SA 3.0
This is a picture generated from crystal structure data reported by Peter R. Ashton, Christopher L. Brown, Ewan J. T. Chrystal, Timothy T. Goodnow, Angel E. Kaifer, Keith P. Parry, Douglas Philp, Alexandra M. Z. Slawin, Neil Spencer, J. Fraser Stoddart and David J. Williams Chemical Communications, 1991, 634 - 639. It shows a catenane with a cyclobis(paraquat-p-phenylene) macrocyle. It was made by myself and is free to be used by all.
Autor/Urheber: M stone in der Wikipedia auf Englisch, Lizenz: CC BY-SA 3.0
This is a picture generated from crystal structure data reported by M. Cesario, C. O. Dietrich-Buchecker, J. Guilhem, C. Pascard and J. P. Sauvage in the Journal of the Chemical Society, Chemical Communications, Year 1985, Pages 244-247. It shows a catenane. It was made by myself and is free to be used by all.
pretzelane scheme









