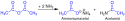Carbonsäureanhydride


Carbonsäureanhydride sind eine Stoffklasse der organischen Chemie, die sich von den Carbonsäuren ableiten und als reaktive Carbonsäurederivate bezeichnet werden können. Sie bestehen aus zwei Acylgruppen, die durch ein Sauerstoffatom miteinander verbunden sind. Dabei wird zwischen symmetrischen (R1=R2) und unsymmetrischen (R1≠R2) unterschieden, wobei die symmetrischen Carbonsäureanhydride häufiger und wichtiger sind. Des Weiteren gibt es sowohl offenkettige (z. B. Acetanhydrid), als auch cyclische Carbonsäureanhydride (z. B. Bernsteinsäureanhydrid oder Maleinsäureanhydrid).[1]
Nomenklatur
Zu beachten ist, dass Carbonsäureanhydride und Säureanhydride nicht ein und dasselbe sind. Alle Carbonsäureanhydride sind Säureanhydride, aber nicht alle Säureanhydride sind Carbonsäureanhydride. So ist z. B. Distickstoffpentoxid auch ein Säureanhydrid, ist jedoch nicht organisch und weist keine Kohlenstoffatome auf. Somit ist es kein Carbonsäureanhydrid. Ein Carbonsäureanhydrid wird so genannt, wie die Carbonsäure, aus der es theoretisch durch Dehydratisierung entstanden ist, mit dem Zusatz -anhydrid. So ist z. B. das Anhydrid der Phthalsäure das Phthalsäureanhydrid. Bei unsymmetrischen Carbonsäureanhydriden wird erst die eine und dann die andere Säure genannt und die Endung -anhydrid angefügt. Das Carbonsäureanhydrid von Ethansäure und Propansäure wäre das Ethansäure-propansäureanhydrid.[2]
Herstellung
Synthese von symmetrischen Carbonsäureanhydriden
Zur Herstellung von symmetrischen Carbonsäureanhydriden lässt sich die Dehydratisierung mit Hilfe von Phosphorpentoxid von der entsprechenden Monocarbonsäure nutzen.[3]
Großtechnische Herstellung von Acetanhydrid
Acetanhydrid (auch Essigsäureanhydrid genannt) gilt als das wichtigste Carbonsäureanhydrid. Es wird mittels des Wacker-Verfahrens atomökonomisch hergestellt. Hierbei wird erst das Ethenon (Keten) durch Dehydratisierung von Essigsäure oder durch Pyrolyse von Aceton erzeugt und danach kommt es zu der Reaktion von Essigsäure mit Keten (siehe Wacker-Verfahren):[2]
Reaktionen
Carbonsäureanhydride sind zwar weniger reaktiv als Carbonsäurechloride jedoch als reaktive Carbonsäurederivate reaktiver als andere Carbonylverbindungen.[2]
Alkoholyse
Durch Alkoholyse von Carbonsäureanhydriden entsteht eine Carbonsäure und ein Carbonsäureester. Bei der Reaktion von Acetanhydrid mit Alkohol entstehen Essigsäure und ein Essigsäureester:
Bei der Reaktion eines cyclischen Carbonsäureanhydrids mit wasserfreiem Alkohol entsteht eine Dicarbonsäure mit einer veresterten Carboxygruppe. Die wasserfreie Alkoholyse von Phthalsäureanhydrid mit Methanol liefert einen Phthalsäuremonomethylester als Produkt:[4]
Hydrolyse
Durch Reaktion mit Wasser entstehen aus Carbonsäureanhydriden zwei Äquivalente der zugrunde liegenden Carbonsäure. Durch die Hydrolyse von Acetanhydrid entstehen zwei Äquivalente Essigsäure:
Bildung von Carbonsäureamiden
Carbonsäureanhydride reagieren mit Ammoniak bzw. Aminen zu Carbonsäuresalzen und Carbonsäureamiden. Die gewünschten Produkte sind hierbei die Carbonsäureamide. Carbonsäuresalze lassen sich weitaus einfacher durch die Reaktion von Carbonsäuren mit Ammoniank bzw. Aminen herstellen. Die Reaktionen laufen wie folgt ab:
Acetanhydrid reagiert mit Ammoniak zu Ammoniumacetat und Acetamid:
Acetanhydrid reagiert mit einem primären Amin zu einem Essigsäuresalz und einem sekundären Essigsäureamid:
Acetanhydrid reagiert mit einem sekundären Amin zu einem Essigsäuresalz und einem tertiären Essigsäureamid:
Diels-Alder-Reaktion
Durch das elektronenarme π-System eignet sich das cyclische Maleinsäureanhydrid als nahezu ideales Dienophil für die Diels-Alder-Reaktion. Bei der [4+2]-Cycloaddition von 1,3-Butadien und Maleinsäureanhydrid entsteht Tetrahydrophthalsäureanhydrid (siehe Diels-Alder-Reaktion):[5][6]
Friedel-Crafts-Acylierung
Die Friedel-Crafts-Acylierung gilt als die wichtigste Methode für die Synthese von aromatischen Ketonen. Sie lässt sich u. a. mit Carbonsäureanhydriden durchführen. Bei der Reaktion einer aromatischen Verbindung und einem Carbonsäureanhydrid entsteht mit Hilfe eines Lewis-Säure-Katalysators ein Arylketon (siehe Friedel-Crafts-Acylierung):[6][7]
Einzelnachweise
- ↑ Robert J. Ouellette, J. Davin Rawn: Organic Chemistry: Structure, Mechanism, and Synthesis. Elsevier, Amsterdam 2014, ISBN 978-0-12-800780-8, S. 699.
- ↑ a b c Adalbert Wollrab: Organische Chemie – Eine Einführung für Lehramts- und Nebenfachstudenten. 4. Auflage. Springer-Verlag, Berlin 2014, ISBN 978-3-642-45143-0, S. 672–675, doi:10.1007/978-3-642-45144-7.
- ↑ Hans P. Latscha, Uli Kazmaier, Helmut A. Klein: Organische Chemie: Chemie-Basiswissen II. 6. Auflage. Springer-Verlag, Berlin 2008, ISBN 978-3-540-77106-7, S. 275–276, doi:10.1007/978-3-540-77107-4.
- ↑ Hans Breuer: Chemie: Organische Chemie und Kunststoffe. 9. Auflage. Deutscher Taschenbuch Verlag, München 2006, ISBN 978-3-423-03218-6, S. 369–372.
- ↑ Maleinsäureanhydrid. In: Jürgen Falbe, Manfred Regitz (Hrsg.): Römpp. 9. Auflage. Georn Thieme Verlag, Stuttgart 2003, ISBN 3-13-734909-5, S. 2617.
- ↑ a b Thomas Laue, Andreas Plagens: Named organic reactions. Wiley, 1999, ISBN 0-471-97142-1, S. 78–109.
- ↑ Norman L. Allinger: Organische Chemie. Hrsg.: Georg Kossmehl. 1. Auflage. De Gruyter, Berlin 1980, ISBN 978-3-11-004594-9, S. 564—565.
Auf dieser Seite verwendete Medien
Autor/Urheber: Nossy123, Lizenz: CC BY-SA 4.0
Reaction of a carboxylic anhydride and a primary amine
Autor/Urheber: Nossy123, Lizenz: CC BY-SA 4.0
Hydrolysis of carboxylic anhydride
Autor/Urheber: Nossy123, Lizenz: CC BY-SA 4.0
Structure of carboxylic anhydrids
Autor/Urheber: Nossy123, Lizenz: CC BY-SA 4.0
Synthesis of acetic anhydride
Autor/Urheber: Nossy123, Lizenz: CC BY-SA 4.0
Reaction of a carboxylic anhydride and ammonia
Autor/Urheber: Nossy123, Lizenz: CC BY-SA 4.0
Friedel-Crafts-acylation with acetic anhydride
Autor/Urheber: Nossy123, Lizenz: CC BY-SA 4.0
Diels-Alder-reaction with Maleic anhydride
Autor/Urheber: Nossy123, Lizenz: CC BY-SA 4.0
Reaction of a carboxylic anhydride and a secundary amine
Autor/Urheber: Nossy123, Lizenz: CC BY-SA 4.0
Dehydration reaction of carboxic acid
Autor/Urheber: Nossy123, Lizenz: CC BY-SA 4.0
Reaction of a carboxylic anhydride and an alcohol
Autor/Urheber: Nossy123, Lizenz: CC BY-SA 4.0
Phthalic anhydride with anhydrous alcohol
Autor/Urheber: Nossy123, Lizenz: CC BY-SA 4.0
Structure: carboxylic anhydride; acetic anhydride; maleic anhydride