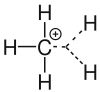
Carbokation
Als Carbokation werden in der organischen Chemie Kohlenwasserstoff-Moleküle bezeichnet, die ein positiv geladenes Kohlenstoffatom besitzen.[1] Bei diesen Molekülen wird zwischen den klassischen Carbokationen mit drei Substituenten und den nichtklassischen Carbokationen mit fünf Substituenten unterschieden. Carbokationen mit einem dreifach koordinierten Kohlenstoffatom werden als Carbeniumionen bezeichnet (+CR3; R steht für einen organischen Rest). Die anderen werden Carboniumionen genannt. Dies sind Kationen mit einem fünffach koordinierten Kohlenstoffatom (z. B. +CR5). Der Begriff Carbokation wurde von George A. Olah eingeführt, Pionierarbeiten dazu stammen von Hans Meerwein (ab 1922).
Carbeniumionen kommen in der organischen Chemie als Zwischenprodukte bei sogenannten SN1-Reaktionen und bei E1-Reaktionen vor. Reaktionen mit SN1-Mechanismus gehören zu den nukleophilen Substitutionen, Reaktionen mit E1-Mechanismus gehören zur Klasse der Eliminierungsreaktionen. Carbeniumionen sind sp2-hybridisiert und somit trigonal-planar.
Der nukleophile Angriff erfolgt auf das leere pz-Orbital des Kohlenstoffes. Dieses steht senkrecht (im rechten Winkel) zu den 3 Hybrid-Orbitalen, wodurch ein weiterer Substituent von oben oder auch von unten angreifen kann. Im Allgemeinen laufen SN1-Reaktionen daher nicht stereoselektiv ab. Ein Carbeniumion ist ein dreibindiger Kohlenstoff, der ein Elektronensextett besitzt. Nach der Anzahl der organischen Reste wird zwischen primären (+CH2R), sekundären (+CHR2) und tertiären Carbeniumionen (+CR3) unterschieden. Die Stabilität der Carbokationen nimmt durch so genannte I-Effekte und Hyperkonjugation mit der Anzahl der Reste von primär nach tertiär zu.
Carboniumionen hingegen kommen nur als theoretischer Zwischenzustand bei der SN2-Reaktionen vor. Hierbei wird das ehemalige Nucleophil des Kohlenstoffatoms durch einen Rückseitigen Angriff des neuen Nucleophils abgedrängt, wodurch dieses fünfbindige Carboniumion als Zwischenzustand entsteht.
Literatur
- Armin de Meijere: Neues über Carbokationen. In: Chemie in unserer Zeit. 9. Jahrg. 1975, Nr. 2, S. 35–42, doi:10.1002/ciuz.19750090202
Einzelnachweise
- ↑ Eintrag zu carbocation. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.C00817 – Version: 2.1.5.
Auf dieser Seite verwendete Medien
Autor/Urheber: Smokefoot, Lizenz: CC BY 4.0
norbornyl cation with critical distances in picometers