Calciumpermanganat
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
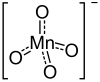 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Calciumpermanganat | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | Ca(MnO4)2 | |||||||||||||||
| Kurzbeschreibung | violetter Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 277,95 g·mol−1 | |||||||||||||||
| Aggregatzustand | fest | |||||||||||||||
| Dichte | 2,4 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit | leicht löslich in Wasser[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK | 0,5 mg·m−3[1] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Calciumpermanganat ist eine chemische Verbindung aus Calcium, Sauerstoff und Mangan. Es ist das Calciumsalz der im freien Zustand unbekannten Permangansäure HMnO4. Für die intensive Färbung des Salzes ist ausschließlich das Permanganat-Anion verantwortlich.
Gewinnung und Darstellung
Calciumpermanganat kann durch Elektrolyse von Lösungen von Alkalimanganaten und Chlorkalk gewonnen werden oder wie beim Magnesiumpermanganat aus Calciumchlorid und Silberpermanganat.
Chemische Eigenschaften
Calciumpermanganat Ca(MnO4)2 ist wie Kaliumpermanganat ein starkes Oxidationsmittel.
Verwendung
Calciumpermanganat wird verwendet:
- in der Textilproduktion
- zum Bleichen von Papier
- zur Sterilisierung von Wasser und bei Zahnbehandlungen
- als Katalysator in Raketentreibstoffen
- in Beschichtungen/Flussmitteln von Schweißelektroden[3]
- allgemein als antiseptische, desinfizierende und deodorierende Verbindung
Einzelnachweise
- ↑ a b c d e Eintrag zu Calciumpermanganat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 27. Februar 2017. (JavaScript erforderlich)
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ HazMap: Calcium permanganate (Memento vom 11. März 2013 im Internet Archive)


