Caesiumchlorid
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| _ Cs+ _ Cl− | |||||||||||||||||||
| Kristallsystem | kubisch | ||||||||||||||||||
| Raumgruppe | Pm3m (Nr. 221) | ||||||||||||||||||
| Gitterparameter | 412,6 pm (bei T = 298 K)[1] | ||||||||||||||||||
| Koordinationszahlen | Cs[8], Cl[8] | ||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Caesiumchlorid | ||||||||||||||||||
| Verhältnisformel | CsCl | ||||||||||||||||||
| Kurzbeschreibung | weißer, hygroskopischer, geruchloser Feststoff[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 168,36 g·mol−1 | ||||||||||||||||||
| Aggregatzustand | fest[2] | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | 1382 °C[2] | ||||||||||||||||||
| Löslichkeit | sehr gut in Wasser (1860 g·l−1 bei 20 °C)[2] | ||||||||||||||||||
| Brechungsindex | 1,640[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Caesiumchlorid, ein Salz mit der Formel CsCl bildet farblose, kubische Kristalle (Caesiumchloridstruktur) und lässt sich in Wasser, Säuren und Laugen lösen. Die Caesiumkationen und Chloridanionen sind in Lösung frei beweglich, und die Beweglichkeit des Caesiumions in Wasser ist relativ hoch, da das Caesiumion nur eine relativ schwach gebundene Hydrathülle hat. Caesiumchlorid ist hygroskopisch.
Struktur

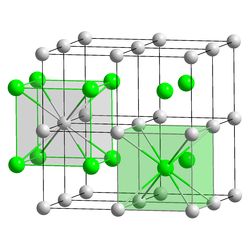
Caesiumchlorid hat eine charakteristische, kubische Kristallstruktur, bei der jedes Caesiumion von acht Chloridionen und jedes Chloridion von acht Caesiumionen umgeben ist: Die kubische Einheitszelle kann beispielsweise so gewählt werden, dass die Chloridionen an den acht Ecken des Würfels sitzen. Dann befindet sich das Caesiumion genau in der Mitte des Würfels. Man kann alternativ auch eine Einheitszelle wählen, bei der sich die Caesiumionen auf den Eckplätzen des Würfels befinden und das Chloridion in der Mitte der Zelle. Die Caesiumchloridstruktur mit der relativ hohen Koordinationszahl acht wird bei Alkalimetallhalogeniden nur gebildet, wenn das Kation relativ groß ist, so dass es auch von acht Anionen umgeben werden kann. Sonst bildet sich die Natriumchlorid-Struktur. Auch Messing mit Zinkgehalten um 50 % hat bei Temperaturen unter 468 °C die Caesiumchloridstruktur.
Eigenschaften
Die Standardbildungsenthalpie von Caesiumchlorid beträgt ΔHf0 = −443 kJ/mol.[5]
Darstellung
Die Synthese von Caesiumchlorid kann über Caesiumhydroxid oder Caesiumcarbonat, zusammen mit Chlorwasserstoffsäure, erfolgen[6]:
oder auch
Verwendung
Verwendung in der Forschung
Caesiumchlorid wird oft in Laborprozessen zur Aufreinigung von Nukleinsäuren oder Viren mit Hilfe einer Ultrazentrifuge verwendet. Dabei bildet sich nach mehrstündiger Ultrazentrifugation ein Dichtegradient selbstständig aus. Die Partikel sammeln sich dann entsprechend ihrer Dichte in charakteristischen Banden im Zentrifugenröhrchen und können separat entnommen werden.
Darüber hinaus wird es in der Atomabsorptionsspektrometrie als Ionisationspuffer von leicht ionisierbaren Metallen verwendet.
Missbräuchliche Anwendung
In der Pseudomedizin wird Caesiumchlorid zur Behandlung gegen Krebs eingesetzt. Anhänger sogenannter Caesiumchlorid-Therapien gehen spekulativ davon aus, dass im Cytoplasma von Tumorzellen ein niedrigerer pH-Wert herrsche als in gesunden Zellen. Caesiumchlorid soll den pH-Wert in den Tumorzellen auf den Normalwert anheben, daher wird diese Therapie im Englischen auch als high pH therapy bezeichnet. Des Weiteren soll Cäsium dazu führen, dass Tumorzellen weniger Glucose aufnehmen können und somit „verhungern“. Ein wissenschaftlich anerkannter Nachweis über die pharmakologische Wirksamkeit konnte nicht erbracht werden.[7] Auch wird in der Literatur Aloe Vera in Verbindung mit Cäsiumchlorid verwendet, der Phytonährstoffe wegen, um Krebs zu behandeln.[8][9][10]
Einzelnachweise
- ↑ V. Ganesan, K.S. Girirajan, Lattice parameter and thermal expansion of CsCl and CsBr by x-ray powder diffraction. I. Thermal expansion of CsCl from room temperature to 90 K, Pramāna – Journal of Physics 27 (1986), S. 472.
- ↑ a b c d e f g Datenblatt Caesiumchlorid bei Merck, abgerufen am 19. Januar 2011.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Index of Refraction of Inorganic Crystals, S. 10-246.
- ↑ a b Eintrag zu Cäsiumchlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 1170.
- ↑ Chemgapedia: , Caesiumchlorid, Seite 3: Synthese, abgerufen am 17. Januar 2015.
- ↑ Cesium Chloride ( vom 12. November 2006 im Internet Archive) In: American Cancer Society. 1. Juni 2005, abgerufen am 9. Februar 2019.
- ↑ Over 200 Alternative Cancer Treatments Plus Other Information. Archiviert vom am 12. Dezember 2010; abgerufen am 19. März 2024.
- ↑ José A. Centeno, Joseph P. Pestaner, Bennet I. Omalu, Norca L. Torres, Frances Field, Glenn Wagner, Florabel G. Mullick: Blood and tissue concentration of cesium after exposure to cesium chloride: a report of two cases. In: Biological Trace Element Research. Band 94, Nr. 2, August 2003, S. 97–104, doi:10.1385/BTER:94:2:97, PMID 12958400.
- ↑ Petr Melnikov und Lourdes Zanoni: Clinical Effects of Cesium Intake. In: Biological Trace Element Research 135(1-3):1-9. September 2009, abgerufen am 25. Mai 2023.
Auf dieser Seite verwendete Medien
Globales Harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS) Piktogramm für gesundheitsgefährdende Stoffe.
Crystal structure of CsCl with coordination polyhedra



