Caesiumazid
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
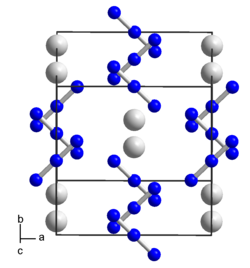 | ||||||||||||||||
| _ Cs+ _ N1/3− | ||||||||||||||||
| Kristallsystem | tetragonal | |||||||||||||||
| Raumgruppe | I4/mcm (Nr. 140) | |||||||||||||||
| Gitterparameter | a = 6,5412 Å, c = 8,0908 Å[1] | |||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Caesiumazid | |||||||||||||||
| Verhältnisformel | CsN3 | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 174,93 g·mol−1 | |||||||||||||||
| Aggregatzustand | fest[2] | |||||||||||||||
| Dichte | 3,5 g·cm−3 (25 °C)[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | 390 °C (Zersetzung)[3] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Caesiumazid ist eine anorganische chemische Verbindung des Caesiums aus der Gruppe der Azide.
Gewinnung und Darstellung
Caesiumazid kann durch Reaktion von Stickstoffwasserstoffsäure und Caesiumhydroxid gewonnen werden.[3]
Es kann auch durch Reaktion von Caesiumcarbonat mit Stickstoffwasserstoffsäure gewonnen werden.[3]
Eigenschaften
Caesiumazid ist ein Feststoff.[2] Es kristallisiert in einer tetragonalen Kristallstruktur mit der Raumgruppe I4/mcm (Raumgruppen-Nr. 140) und vier Formeleinheiten pro Elementarzelle.[5]
Verwendung
Caesiumazid kann zur Herstellung von hochreinem Caesium verwendet werden.[6]
Einzelnachweise
- ↑ Ulrich Müller: Verfeinerung der Kristallstrukturen von KN3, RbN3, CsN3 und TlN3. In: Zeitschrift für anorganische und allgemeine Chemie. Band 392, Nr. 2, 1972, S. 159–166, doi:10.1002/zaac.19723920207.
- ↑ a b c d e f Datenblatt Cesium azide, 99.99% trace metals basis bei Sigma-Aldrich, abgerufen am 31. Oktober 2021 (PDF).
- ↑ a b c d Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 458.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Inorganic Compounds, S. 4-57.
- ↑ C. C. Addison: Inorganic Chemistry of the Main-Group Elements. Royal Society of Chemistry, 1974, ISBN 0-85186-762-6, S. 54 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ FRITZ BLATTER and ERNST SCHUMACHER: PRODUCTION OF HIGH PURITY CAESIUM, Journal of the beg-Common Metals, 115 (1986) 307-313
Auf dieser Seite verwendete Medien
Global harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS): Piktogramm für giftige / toxische Chemikalien
Autor/Urheber: Andif1, Lizenz: CC BY-SA 4.0
Unit cell of rubidium azide. Created using Diamond 4. Data from Mueller, U. Verfeinerung der Kristallstrukturen von K N3, Rb N3, Cs N3 und Tl N3 Zeitschrift fuer Anorganische und Allgemeine Chemie, 392, 159-166 (1972)


