Cadherine
| Cadherin-1; E-cadherin | ||
|---|---|---|
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 728 aa | |
| Sekundär- bis Quartärstruktur | Homodimer | |
| Bezeichner | ||
| Gen-Namen | CDH1, Arc-1, CD324, CDHE, ECAD, LCAM, UVO | |
| Externe IDs | ||
| Vorkommen | ||
| Übergeordnetes Taxon | Euteleostomi | |
| Orthologe | ||
| Mensch | Maus | |
| Entrez | 999 | 12550 |
| Ensembl | ENSG00000039068 | ENSMUSG00000000303 |
| UniProt | P12830 | Q4KML8 |
| Refseq (mRNA) | NM_004360 | NM_009864 |
| Refseq (Protein) | NP_004351 | NP_033994 |
| Genlocus | Chr 16: 67.33 – 67.43 Mb | Chr 8: 109.49 – 109.56 Mb |
| PubMed-Suche | 999 | 12550 |
Cadherine (von englisch Calcium adhering, wie Ca-adherine) sind von Calciumionen (Ca2+) abhängige transmembrane Glykoproteine aus der Gruppe der Adhäsionsproteine. Sie kommen in Desmosomen und Adherens Junctions vor und bewirken Zellkontakte in verschiedenen Geweben. Die Cadherine spielen eine Rolle bei der Stabilisierung von Zell-Zell-Kontakten, der embryonalen Morphogenese, der Erhaltung der Zellpolarität und der Signaltransduktion.
Mit Hilfe der Kryoelektronentomographie gelang der Nachweis, dass die Stabilisierung durch fadenartige Adhäsionsproteine erfolgt, die aus den Zellmembranen herausragen und sich ineinander verhaken.
Aufbau und Unterteilung

Aus der Superfamilie der Cadherine sind derzeit allein bei Wirbeltieren über 300 Proteine bekannt. Beim Menschen wurden bis heute mehr als 80 Cadherine identifiziert. Gemeinsam sind allen Cadherinen mehrere extrazelluläre Cadherin-Domänen (ECs). Eine EC ist ca. 100 Aminosäuren lang, evolutionär sehr konserviert und besitzt negativ geladene Sequenzmotive, welche Calciumionen-abhängige, homophile Bindungen vermitteln. Über kurze, ca. zehn Aminosäuren lange Linkersequenzen wiederholen sich diese ECs tandemartig zwischen 5- und 34-mal, wobei die ECs beginnend am N-terminalen Ende durchnummeriert werden. Anhand dieser Anzahl der ECs, aber auch an der cytoplasmatischen Domäne und der Größe eines Cadherins sowie an Gen-Clustern, wird die Superfamilie der Cadherine in sieben Gruppen unterteilt:
| Subtyp | Beispiele |
|---|---|
| klassische Cadherine Typ I | E- und N-Cadherine |
| klassische Cadherine Typ II | VE-Cadherine |
| desmosomale Cadherine | Desmocolline, Desmogleine |
| Protocadherine | α-, β- und γ-Protocadherine |
| Cadherin-ähnliche Signalproteine | FAT, Daschous, Flamingo |
| Proteinkinase-Cadherine | k. A. |
| 7-Transmembran-Cadherine | k. A. |
Die wichtigsten und auch am besten untersuchten Vertreter, sind die klassischen Cadherine, wie zum Beispiel E- und N-Cadherine, sowie P(planzetare)- und VE-Cadherine.[1] Diese spielen auch bei der malignen Progression eine wichtige Rolle. Sie bilden in der Zelle parallel cis-Dimere. In dieser Konformation vermögen sie, eine trans-Dimerisierung mit einem identischen Cadherin-Dimer in der gegenüberliegenden Zelle zu bilden und überbrücken so den Extrazellulärraum zwischen den beiden Zellen. Klassische Cadherine sind aus fünf extrazellulären Domänen aufgebaut, wobei zwischen den einzelnen Domänen die Bindungsstellen der Calciumionen liegen, welche für die adhäsive Funktion der Cadherine von fundamentaler Bedeutung sind. Die Interaktion von Cadherinmolekülen auf einander gegenüberliegenden Zellen (trans-Interaktion) kommt durch die N-terminalen Domänen der Zellen zustande. Diese Bindungen sind normalerweise proteinspezifisch (homophil), das heißt ein E-Cadherin einer Zelle kann nur an ein E-Cadherin einer anderen Zelle binden, jedoch nicht z. B. an ein N-Cadherin. Selten werden aber auch heterophile Interaktionen verschiedener Cadherin-Subtypen beobachtet.[1]
Nichtklassische Cadherine sind u. a. Desmocollin (v. a. in der Haut in Desmosomen zu finden), Desmoglein (v. a. in der Haut in Desmosomen zu finden), T-Cadherin (v. a. in den Neuronen und Muskeln).
E-Cadherin
Das zu den klassischen Cadherinen zählende E-Cadherin, welches vor allem in den Epithelien vorkommt, ist das bestuntersuchte Cadherin und wird als Prototyp-Molekül für die gesamte Cadherin-Unterfamilie[2] angesehen. Es besitzt 5 ECs in der extrazellulären Domäne, eine transmembran-Domäne und eine intrazelluläre Domäne, welche p120-Catenin und β-Catenin bindet. Diese intrazelluläre Domäne besitzt eine stark phosphorylierte Region, welche für das Binden von β-Catenin essentiell ist (und somit für die Funktion von E-Cadherin).
Das humane E-Cadherin-Gen ist auf Chromosom 16q22.1 lokalisiert,[3] die codierende Region besteht dabei aus 2652 Basenpaaren.
Mutationen in diesem Gen finden sich beim Elschnig-Syndrom.
N-Cadherin
N-Cadherin (neuronales Cadherin) entspricht in seinem Aufbau einem klassischen Cadherin und wurde 1982 von Grunwald als 130 kDa großes Molekül aus der Hühnerretina isoliert. Es spielt eine bedeutende Rolle in der Embryonalentwicklung, da N-Cadherin im frühen Embryonalstadium im Mesoderm und Notochord gebildet wird. Hingegen ist es im späten Embryonalstadium im Nervengewebe, Herz, Skelettmuskel und in der Linse nachweisbar.[4][5]
Im adulten Organismus wird es unter anderem in Nervengewebe und der Retina gebildet.[6] N-Cadherin stimuliert über Zell-Zell-Kontakte die Migration und Invasion von Zellen und unterdrückt zusammen mit dem stark exprimierten E-Cadherin in geringer Menge die Krebsbildung.
VE-Cadherin
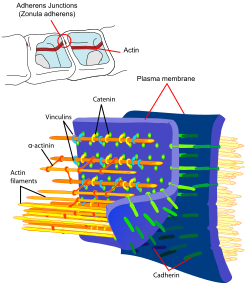
Vaskulär-endotheliales Cadherin (VE-Cadherin) ist ein spezieller Vertreter der klassischen Cadherine, welches in Kontaktstellen aneinandergrenzender Endothelzellen vorkommt. Die Kontaktstellen von Endothelzellen besitzen, im Gegensatz zu denjenigen der Epithelzellen, keine Desmosomen. In endothelialen Kontaktstellen nimmt VE-Cadherin sowohl die Funktion klassischer Cadherine adhärenter Kontaktstellen („adherens junctions“) als auch desmosomaler Cadherine wahr. Die zytoplasmatische Domäne bindet, wie andere klassische Cadherine, β-Catenin, welches seinerseits über α-Catenin das Aktinzytoskelett reguliert.[7][8]
Im menschlichen Organismus sind mehr als 80 verschiedene Mitglieder der Cadherinfamilie bekannt. Von diesen wurden mehr als 30 Cadherine im sich entwickelnden menschlichen Gehirn identifiziert. Jedes Cadherin weist ein Expressionsmuster auf, das spezifisch ist und von der Syntheseregion und dem Entwicklungsstand des Organismus determiniert wird.[9]

Protocadherin GammaC3
Durch die Expression des gamma-Protocadherin-A3-EGFP-Fusionsproteins in kultivierten primären hippocampalen Neuronen konnte nach Gegenfärbung mit dem synaptischen Marker Synaptophysin eine Kolokalisation beobachtet werden. Auch Northern-Blot-Analysen der Gesamt-RNA aus verschiedenen Geweben der adulten Maus zeigten die höchste Expression (bei ca. 4,8 kb) im zentralen Nervensystem.[10] Ein geringeres Expressionsniveau konnte aber auch in der Lunge und nach längerer Exposition auch im Herz und in der Niere beobachtet werden. Im Gegensatz zu anderen Isoformen der gamma-Protocadherine, die vor allem während der Embryogenese exprimiert werden, zeigt die gamma-Protocadherin-Isoform C5 eine verstärkte postnatale Expression im Gehirn, die mit dem Höhepunkt der Synaptogenese zusammenfällt.[11] Außerdem konnte eine starke Expression im Bulbus olfactorius, Corpus striatum, Gyrus dentatus, der CA1 Region des Hippocampus, den Schichten I und II des Cortex cerebri und der Molekularschicht des Cerebellum gezeigt werden. Außerdem wurde eine starke Expression der Isoform in den Glomeruli des Bulbus olfactorius nachgewiesen werden.
Eine homophile Interaktion zwischen zwei identischen gamma-Protocadherin-Isoformen wurde nachweisen, die transgen in Cadherin-freien K562-Leukämie Zellen exprimiert waren.[12] Gleichzeitig konnte gezeigt werden, dass diese Interaktion im Gegensatz zu den N-Cadherinen Calcium-unabhängig stattfindet. Durch die Klonierung von chimären gamma-Protocadherinen wurde außerdem die Abhängigkeit der homophilen Interaktion von den Oberflächen-Proteindomänen 2 und 3 nahegelegt, was einen weiteren Unterschied zu den N-Cadherinen darstellt, deren homophile Interaktion über die Domäne 1 vermittelt wird. Neben einer quantitativen Analyse der Zell-Aggregation wurde die hochspezifische, homophile Interaktion auch durch qualitative konfokalmikroskopische Analysen nach Mischung von rot und grün gelabelten Isoform-exprimierenden Zellen verdeutlicht.
Neben dieser trans-Interaktion wurde eine hoch-promiskuitive bzw. unspezifische Bildung von Tetrameren aus den unterschiedlichsten Isoformen nachgewiesen. In einem nächsten Schritt konnte zudem nachgewiesen werden, dass die promiskuitive Tetramer-Bildung an der Zellmembran mit einer hochspezifischen trans-Interaktion zwischen Zellen einhergeht, welche die gleiche Formation von Tetrameren in ihrer Membran tragen. Die Ausbildung der Interaktion zwischen diesen Zellen nimmt zudem graduell mit der Ungleichheit der gebildeten Tetramere ab. Zusammenfassend lässt sich sagen, dass es durch die differentielle Expression der 22 Isoformen 224 (234.256) verschiedene Möglichkeiten der Tetramer-Bildung gibt. Bei identischer Zusammensetzung dieser Tetramere wird wiederum eine hochspezifische Zell-Zell-Erkennung vermittelt. Durch den Nachweis der intrazellulären cis-Multimerbildung der gamma-Protocadherin-Isoformen mit denen der alpha-Protocadherine multipliziert sich außerdem die Zahl der möglichen spezifischen Zell-Zell-Interaktionen.[13]
Signaltransduktion

Die Cadherin-vermittelte Zelladhäsion ist ein dynamischer Prozess. Dieser Prozess ist von der Topologie und dem Differenzierungsstadium der Zelle abhängig und wirkt aber auch auf diese ein. Hieraus ergibt sich, dass Cadherine nicht nur Adhäsions-, sondern auch wichtige Signalmoleküle darstellen. Die Übertragung extrazellulärer Signale in die Zelle wird durch die zytoplasmatische Cadherindomäne bewerkstelligt.[1][14][15]
Catenine
Catenine sind zytoplasmatische Proteine, für die als Erste eine Assoziation mit klassischen Cadherinen beschrieben wurde. Die Familie der Catenine umfasst α- und β-Catenin, γ-Catenin (Plakoglobin) und δ-Catenin (p120-Catenin). Catenine bilden im Intrazellulärraum die regulatorische Schaltstelle zwischen den transmembranen Cadherinen und den Aktinfilamenten des Zytoskeletts. Das bei der Krebsentstehung bedeutendste Catenin ist β-Catenin, welches auch im WNT-Signalweg eine zentrale Rolle spielt. β-Catenin bindet sowohl an die zytoplasmatische Domäne klassischer Cadherine als auch an α-Catenin, einem wichtigen Regulator des Aktinzytoskeletts. γ-Catenin ist identisch mit Plakoglobin, einem Protein, welches zuerst aus Desmosomen isoliert wurde. Wie β-Catenin bindet auch γ-Catenin sowohl an die zytoplasmatische Cadherindomäne als auch an α-Catenin. Ein weiteres Protein, welches mit der zytoplasmatischen Domäne klassischer Cadherine assoziiert, ist p120-Catenin. p120-Catenin moduliert die Wirkung von Cadherinen, indem es den Cadherin-Turnover an der Zelloberfläche und, über die Beeinflussung von RhoA, Rac und Cdc42, auch die Dynamik des Zytoskeletts reguliert.[7][8]
Cadherine und Karzinomprogression
In der Progression maligner Tumoren spielt E-Cadherin eine herausragende Rolle, da es das wesentliche epitheliale Cadherin ist. E-Cadherin ist das Produkt des CDH1-Gens. Im Verlauf der Embryonalentwicklung wird CDH1 bereits im Blastomerstadium exprimiert. Dieses Genprodukt ist an der Kompaktierung der Blastomere beteiligt. Im weiteren Verlauf findet sich E-Cadherin in allen Epithelien, unabhängig davon, ob diese aus Ekto-, Meso- oder Entoderm entstehen. In der Mehrzahl humaner Karzinome ist der Verlust von E-Cadherin auf eine verminderte Transkription des CDH1-Gens durch Promotormethylierung oder eine veränderte Regulation durch Transkriptionsfaktoren zurückzuführen. In einigen Tumorarten wird E-Cadherin auch durch Sequenzmutation des CDH1-Gens inaktiviert. Hierbei handelt es sich vor allem um Magen- und Mammakarzinome. Inaktivierende Mutationen von CDH1 werden vor allem in solchen Tumoren gefunden, in denen sich die Tumorzellen diffus und weitgehend vereinzelt ausbreiten.[14] Wie bei anderen Tumorsuppressorgenen führen die meisten Mutationen von CDH1 zu einem vorzeitigen Kettenabbruch beziehungsweise zum Verlust größerer Proteinabschnitte.[16] Die meisten Mutationen führen zu einem Kettenabbruch und resultieren in sezernierten E-Cadherin-Fragmenten. Dies erklärt, warum E-Cadherin im Tumor nicht mehr nachweisbar ist. Das Fehlen von E-Cadherinen durch karzinogene Mutation, führt zu einer ineffektiven Bindung unter den Tumorzellen, wodurch sich Karzinomzellen ablösen und durch den Blutstrom oder Lymphabfluss in weite entlegene Körperregionen getragen werden können, in denen sie Metastasen ausbilden können. Wie Versuche an Mäusen, bei welchen dieses Gen ausgeschaltet wurde, zeigten, ist die Abwesenheit von E-Cadherin nicht mit dem Leben vereinbar. Die Embryonalentwicklung endet bereits vor dem Stadium der Blastozyste. N-Cadherin defiziente Mäuse sterben im embryonalen Stadium am Tag 9 oder 10, da die Differenzierung einzelner Gewebe wie z. B. des Herzens nicht stattfindet.[17]
Einzelnachweise
- ↑ a b c d e B. M. Gumbiner: Cell adhesion: Regulation of cadherin-mediated adhesion in morphogenesis. In: Nat Rev Mol Cell Biol. 2005.
- ↑ F. Nollet u. a.: Phylogenetic analysis of the cadherin superfamily allows identification of six major subfamilies besides several solitary members. 2000.
- ↑ M. Takeichi: Cadherin cell adhesion receptors as a morphogeneitc regulator. 1990.
- ↑ K. Hatta u. a.: Spatial and temporal expression pattern of N-cadherin cell adhesion molecules correlated with morphogenetic processes of chicken embryos. 1987.
- ↑ M. Takeichi: The cadherins: cell-cell adhesion molecules controlling animal morphogenesis. 1988.
- ↑ Derycke, Bracke, 2004.
- ↑ a b B. D. Angst u. a.: The cadherin superfamily: diversity in form and function; Journal of cell science. 2001.
- ↑ a b M. J. Wheelock, K. R. Johnson: Cadherins as modulators of cellular phenotype. In: Annual review of cell and developmental biology. 2003.
- ↑ K. Obst-Pernberg, C. Redies: Cadherins and synaptic specificity. In: Journal of neuroscience research. 1999.
- ↑ M. Frank, M. Ebert, W. Shan, G. R. Phillips, K. Arndt, D. R. Colman, R. Kemlera: Differential expression of individual gamma-protocadherins during mouse brain development. In: Mol. Cell. Neurosci. 29, 2005, S. 603–616.
- ↑ Y. Li, D. R. Serwanski, C. P. Miralles, C. G. Fiondella, J. J. Loturco, M. E. Rubio, A. L. De Blas: Synaptic and Nonsynaptic Localization of Protocadherin-gammaC5 in the Rat Brain. In: The Journal of Comparative Neurology. 518, 2010, S. 3439–3463.
- ↑ D. Schreiner, J. A. Weiner: Combinatorial homophilic interaction between gamma-protocadherin multimers greatly expands the molecular diversity of cell adhesion. In: Proc Natl Acad Sci USA. 107, 2010, S. 14893–14898.
- ↑ S. Bonn, P. H. Seeburg, M. K. Schwarz: Combinatorial expression of alpha- and gamma-protocadherins alters their presenilin-dependent processing. In: Mol Cell Biol. 27(11), Jun 2007, S. 4121–4132. Epub 2007 Apr 2.
- ↑ a b M. Conacci-Sorrel u. a.: The cadherin-catenin adhesion system in signaling and cancer. In: Journal of Clinical Investigation. 2002.
- ↑ W. J. Nelson, R. Nusse: Convergence of Wnt,{beta}-catenin, and cadherin pathways. In: Science. 2004.
- ↑ A. R. Brooks-Wilson u. a.: Germline E-cadherin mutations in hereditary diffuse gastric cancer: assessment of 42 new families and review of genetic screening criteria. In: British Medical Journal. 2004.
- ↑ C. Redies: Cadherins in the central nervous system; Progress in neurobiology. 2000.
Weblinks
Auf dieser Seite verwendete Medien
Autor/Urheber: Requanos in der Wikipedia auf Deutsch, Lizenz: CC BY-SA 3.0 de
Interaktion von E-Cadherin mit Cateninen. β-Catenin bindet an die zytoplasmatische Domäne von E-Cadherin und an α-Catenin. α-Catenin reguliert die Polymerisation des Aktinzytoskeletts, β-Catenin und p120-Catenin wirken als Transkriptionsfaktoren
Autor/Urheber: Requanos in der Wikipedia auf Deutsch, Lizenz: CC BY-SA 3.0 de
Modell zur Interaktion von E-Cadherin-Monomeren in trans. Die Bindung wird durch Tryptophanreste (W) vermittelt. Dieses Modell ist am ehesten mit kristallographischen und elektronenoptischen Befunden vereinbar.
Autor/Urheber: Phaeton1, Lizenz: CC BY-SA 3.0
Cadherin pan human endothel DAPI blau
the diagram shows a cell-cell junction called adherens or zonula adherens. It also contains the main proteins involved in it.



