COVID-19
| Klassifikation nach ICD-10 | |
|---|---|
| U07.1 | COVID-19, Corona-Verdacht, Virus nachgewiesen |
| U07.2 | COVID-19, Corona-Verdacht, Virus nicht nachgewiesen |
| ICD-10 online (WHO-Version 2019) | |
| Klassifikation nach ICD-11 | |
|---|---|
| RA01 | COVID-19 |
| RA01.0 | COVID-19, Virus nachgewiesen |
| RA01.1 | COVID-19, Virus nicht nachgewiesen |
| ICD-11: Englisch • Deutsch (Entwurf) | |

COVID-19 (Akronym von englisch coronavirus disease 2019, deutsch Coronavirus-Krankheit-2019, umgangssprachlich Corona oder Covid),[1][2] ist eine Infektionskrankheit, die durch eine Infektion mit dem Betacoronavirus SARS-CoV-2 verursacht wird. In einigen Länder ist die Krankheit meldepflichtig. Die Symptome sind typischerweise ähnlich zu anderen Atemwegsinfektionen: Husten, Schnupfen, Hals-, Kopf- und Gliederschmerzen und Fieber.[3] In schwereren Fällen kann es zu Luftnot kommen, auch kann der Magen-Darm-Trakt, das Herz-Kreislauf-System, die Haut oder das Nervensystem betroffen sein.[4]
Die Ansteckung erfolgt durch Tröpfcheninfektion sowie durch das Einatmen von Bioaerosolen, insbesondere bei längerer Aufenthaltsdauer in geschlossenen und ungenügend gelüfteten Räumen und hinreichender Konzentration der Viren. Die Möglichkeit einer Schmierinfektion an Schleimhäuten (Mund, Nase, Auge etc.) durch Kontakt mit kontaminierten Oberflächen ist nicht ausgeschlossen.[3] Die Inkubationszeit von SARS-CoV-2 beträgt zwischen 1 und 12 Tage, wobei sie im Mittel bei drei Tagen liegt. Eine Übertragung ist auch möglich, ohne dass eine infizierte Person Krankheitssymptome hat.[4]
Wenn die Beschwerden länger als vier Wochen anhalten, neu oder wiederkehrend auftreten, spricht man von Long Covid. Hält dieser Zustand länger als zwölf Wochen an, wird dies als Post-Covid-Syndrom bezeichnet.[5]
Das Virus wurde erstmals im Dezember 2019 in Wuhan (Volksrepublik China) beschrieben. Am 20. Januar 2020 gab die chinesische Gesundheitskommission bekannt, dass eine Mensch-zu-Mensch-Übertragung möglich sei,[6][7] insbesondere wenn zwei Personen geringen Abstand zueinander haben (weniger als 1,5 m Abstand[8]). Das Virus verbreitete sich 2020 weltweit und ist Ursache der COVID-19-Pandemie, die 2023 endete. Seitdem ist die Krankheit weltweit endemisch.[4]
Bezeichnung
Die WHO legte am 11. Februar 2020 das Akronym »COVID-19« als offizielle Bezeichnung fest. Es stammt aus dem Englischen: CO für Corona, VI für Virus, D für Disease (Krankheit) und 19 für das Jahr der Erstbeschreibung 2019.
Übertragungsweg

Ursache der Erkrankung ist das Betacoronavirus SARS-CoV-2, das erstmals im Januar 2020 aufgrund von Isolaten aus Pneumoniepatienten identifiziert wurde.[9] Das Virus wurde bisher im Sekret des Nasen- und Rachenraumes, im Sputum, im Stuhl, der Tränenflüssigkeit, im Blut, in Aerosolen und auf Oberflächen nachgewiesen.[8][10][11][12]
Inkubationszeit und Infektiosität
Die Inkubationszeit (also der Zeitraum zwischen Ansteckung und Beginn der Erkrankung) liegt im Mittel bei drei Tagen, wenigstens bei einem, höchstens bei zwölf Tagen. Die größte Ansteckungsgefahr geht von Infizieren kurz vor Symptombeginn bis fünf Tage nach den ersten Symptomen aus. Virusbestandteile können typischerweise bis etwa elf Tage nach den ersten Symptomen nachgewiesen werden, bei schwer erkrankten Patienten oder bei unterdrücktem Immunsystem auch deutlich länger. Auch symptomfrei Infizierte können infektiös sein.[5]
Aerosol- und Tröpfcheninfektion

Es wird angenommen, dass sich das Virus wie andere Erreger von Atemwegserkrankungen hauptsächlich durch virushaltige Partikel verbreitet. Diese werden von Infizierten beim Atmen, Husten, Niesen und Sprechen freigesetzt und dann von gesunden Personen als Aerosole oder Tröpfchen aufgenommen. Abhängig von ihrer Größe und Dichte können sie dort sehr lange in der Luft verbleiben. Das Risiko für eine Übertragung ist in kleinen, schlecht gelüfteten Räumen wesentlich höher als im Freien.[8]
In klimatisierten Innenräumen, z. B. in Krankenhäusern, können Tröpfchen im Größenbereich von 5 bis 40 μm – bedingt durch eine Verteilung mit Luftströmungen, die durch Klimaanlagen verursacht werden – ganz besonders gut Krankheitserreger übertragen.[13]
Im Freien finden so gut wie keine Infektionen durch Aerosolpartikel statt. Allerdings können Tröpfcheninfektionen auftreten, insbesondere in Menschenansammlungen, wenn Mindestabstände nicht eingehalten oder keine Masken getragen werden.[14]
Kontaktübertragung
Laboruntersuchungen an SARS-CoV-2 zeigten 2020, dass das SARS-CoV-2 auf einigen Oberflächen bis zu einigen Tagen infektiös bleiben kann. Die prinzipielle Möglichkeit einer Übertragung wurde inzwischen (2022) dahingehend bewertet, dass die Wahrscheinlichkeit einer Kontaktinfektion etwa 1000-mal geringer ist als durch Aerosole und Tröpfcheninfektion. Damit sind Kontaktübertragungen für das Infektionsgeschehen von COVID-19 bedeutungslos.[15]
Schwangerschaft und Stillen
In seltenen Fällen kann Covid-19 während der Schwangerschaft oder Geburt übertragen werden. Der Säugling sollte auch bei einer Infektion der Mutter wie gewohnt gestillt werden, wenn sie sich nicht zu krank fühlt.[16]
Klinische Symptome
Nach einer Inkubationszeit von im Mittel 3 Tagen (möglicher Bereich 1 bis 12 Tage) treten bei mildem Verlauf als häufigste Symptome Husten, Fieber, Schnupfen auf. Bei mittelschweren Erkrankungen kann es zu Atembeschwerden und einer leichten Lungenentzündung kommen. Bei schweren Fällen kann es zu einer Lungenentzündung, anderem Organversagen bis hin zum Tod kommen.[17] Das RKI weist beispielhaft auf die folgenden, möglicherweise betroffenen Organsysteme hin:[5]
- Magen-Darm-Beschwerden (Übelkeit, Appetitlosigkeit, Erbrechen, Bauchschmerzen, Durchfall)
- Neurologische Symptome (Kopfschmerzen, Riech- und Geschmacksstörungen, Schwindel und Verwirrtheit)
- Neuropsychiatrische Krankheitsbilder ( (Meningo-)Enzephalopathien, Schlaganfälle, Guillain-Barré-Syndrom und Verschlechterung bestehender neurologischer Erkrankungen)
- Herz-Kreislauf-Symptomatik (Herzmuskel-/Herzbeutelentzündung, Herzinfarkt, Herzinsuffizienz, Herzrhythmusstörungen)
- Gerinnungssystem (thromboembolische Ereignisse, Blutungen, disseminierte intravasale Koagulopathie (DIC))
- Nierenfunktionsstörungen
- Hautmanifestationen (z. B. masernähnlicher Ausschlag, Papeln, Rötungen, Hautbläschen)
Daneben gibt es auch Fälle von asymptomatischen Verläufen, insbesondere bei Geimpften. Deren Anteil ist jedoch nicht abschließend geklärt.[18]
Schwere Verläufe
Zu Beginn der Pandemie kam es in etwa 15 % der Fälle zu schweren Erkrankungen. Inzwischen werden die meisten Fälle nicht mehr dokumentiert, daher ist die Bestimmung des Anteils schwerer, im Krankenhaus behandelter Fälle unsicher, er wird auf 3 % geschätzt.[19]
Erhöhtes Risiko für einen schweren Krankheitsverlauf haben Patienten ab 60 Jahren, wobei das Risiko mit zunehmendem Alter weiter steigt. Zudem steigt das Risiko mit Vorerkrankungen wie Bluthochdruck, Diabetes, chronischen Gesundheitsproblemen, geschwächtem Immunsystem, Adipositas sowie Krebs.[17]
Diagnostik
Die typischen Krankheitssymptome ähneln denen anderer Atemwegserkrankungen, insbesondere der Grippe. Daher ist eine eindeutige Diagnose anhand der Symptome meist nicht möglich. Zur Differenzialdiagnose kann ggf. die aktuelle Verbreitung von Atemwegsinfektionen oder – falls vorliegend – die Beteiligung weiterer Organe herangezogen werden.[5]
Labordiagnostischer Nachweis
Laut RKI erfolgt der labordiagnostische, direkte Erregernachweis durch Nukleinsäurenachweis (z. B. RT-PCR, real-time quantitative Reverse-Transkriptase-Polymerase-Kettenreaktion).[20][21] Dazu werden Abstriche aus Nase, Rachen oder dem Nasen-Rachen-Raum sowie Speichel genommen.[5] Antigen-Schelltests haben in der Pandemie weite Verbreitung gefunden. Sie sind weniger verlässlich und können auch als Selbsttest verwendet werden. Tests auf Antikörper gegen SARS-CoV-2 haben kaum noch Bedeutung, da der Großteil der Bevölkerung durch Impfung oder Infektion inzwischen Antikörper aufweist.[5]
Auch die Erregerisolierung in einer Zellkultur ist möglich,[20] wird aber von der WHO nicht für die Routinediagnostik empfohlen.[22] Dies ist nur in spezialisierten Laboratorien möglich.[5]
RT-PCR-Test
Die Nachweismethode ist die real-time quantitative Reverse-Transkriptase-Polymerase-Kettenreaktion, abgekürzt auch als qRT-PCR, RT-qPCR oder nur als PCR-Test bezeichnet. Sie basiert auf der Detektion von zwei Nukleotidsequenzen, bezeichnet als E Gen und RdRp Gen. Ein positiver PCR-Test ist nicht gleichbedeutend mit Infektiosität: Der PCR-Test ist bei der empfohlenen Abstrich-Technik stets, in einigen Fällen mehrere Wochen, länger positiv als vermehrungsfähige Viren nachweisbar sind.[8][23][24]

Die Wahrscheinlichkeit, mit Hilfe des RT-PCR-Tests einen Kranken auch korrekt als infiziert zu erkennen, hängt maßgeblich von der Entnahmeart des Materials ab (zum Unterschied zwischen „infiziert“ und „Infektion“ siehe dort).
Antigen-Schnelltests

Seit Herbst 2020 sind Antigen-Schnelltests verfügbar, die auf Proteine des SARS-CoV-2 reagieren. Sie werden in der Regel wie PCR-Tests aus in Nasen-Rachen-Abstrichen gewonnenem Material durchgeführt. Die Sensitivität dieser Tests ist geringer als die von PCR-Tests, die als Referenzmethode gelten.[25] Ihr Vorteil liegt in der geringeren Zeit des Testablaufs von 15 bis 30 Minuten, zudem können einige der Tests vor Ort durchgeführt werden.[26] Ein negatives Ergebnis im Antigentest schließt eine Infektion nicht aus, insbesondere, wenn eine niedrige Viruslast vorliegt, wie z. B. in der frühen Inkubationsphase oder ab der zweiten Woche nach Symptombeginn bzw. in der späten Phase der Infektion.[25]

Bildgebende Verfahren

Ob ein Mensch mit dem Virus infiziert ist, lässt sich durch die Bildgebung nicht feststellen. Jedoch lassen sich bei Patienten, deren Krankheit so schwer ist, dass sie eine Lungenentzündung hervorruft, diese bildgebend nachweisen. In der Bildgebung zeigen sich im CT milchglasartige Verdickungen, wie sie auch bei anderen viralen Lungenentzündungen vorkommen.[27][28] Diese Veränderungen lassen sich aufgrund ihrer oft pleuranahen Lage auch sonographisch darstellen.[29]
Therapie
Bei milden Verläufen werden nur die Krankheitssymptome behandelt. Bei Patienten mit erhöhtem Risiko für einen schweren Krankheitsverlauf sollte geprüft werden, ob die Verabreichung antiviraler Medikamente sinnvoll ist, die ggf. fünf bis sieben Tage nach den ersten Symptomen begonnen werden muss.[5]
Bei einem schweren Verlauf wird die Verabreichung entsprechender Medikamente empfohlen (z. B. Corticosteroide), ggf. auch eine zusätzliche Sauerstoffgabe oder Beatmungsunterstützung. Aufgrund des erhöhten Thrombose- und Lungenembolierisikos bei COVID-Patienten[30] wird zudem eine Antikoagulation (Blutgerinnungshemmung) mittels niedermolekularem oder unfraktioniertem Heparin bei allen krankenhauspflichtigen COVID-Patienten über den gesamten Krankheitsverlauf empfohlen. Diese sollte möglichst frühzeitig nach Aufnahme eingeleitet werden. Eine Blutgerinnungshemmung in voller therapeutischer Dosis wird bei allen stationär behandelten Patienten mit Risikofaktoren für ein thrombotisches Ereignis empfohlen. Bei einer Verschlechterung zur Intensivpflichtigkeit soll diese nach Ausschluss einer Thrombose jedoch wieder auf eine prophylaktische Dosis zurückgefahren werden. Eine Empfehlung zur routinemäßigen Antikoagulation ambulant behandelter Patienten besteht nicht.[31][5]
Die Hospitalisierungsrate liegt bei Infizierten ohne Risikofaktoren bei ca. 0,5 %. Die Sterblichkeit über alle Risikogruppen liegt unter 0,5 %.[32]
Die AWMF aktualisiert regelmäßig eine S3-Leitlinie mit „Empfehlungen zur Therapie von Patienten mit COVID-19“ als Langfassung und als Patientenleitlinie.[33] Auf der Website der Europäischen Arzneimittel-Agentur findet sich eine regelmäßig aktualisierte Übersicht über zur Covid-19-Behandlung zugelassenen Arzneimittel,[34] ebenso beim Paul-Ehrlich-Institut.[35]
Vorbeugung
Hygiene
Die Übertragung erfolgt auf gleichen Wegen wie bei anderen Atemwegserkrankungen, daher gelten die Verhaltensregeln allgemein, insb. bei starkem Infektionsgeschehen (siehe auch AHAL-Regel):[4][36]
- Beim Niesen und Husten Abstand halten
- Engen Kontakt zu Erkrankten möglichst meiden
- Auf gute Belüftung achten, z. B. regelmäßiges Stoßlüften
- Bei Kontakt zu Patienten, oder mit vielen Personen in geschlossenen Räumen eine Atemschutzmaske tragen
- Auf gute Handhygiene achten
- Nicht ins Gesicht fassen
- Häufig berührte Oberflächen reinigen
- Bei Erkrankung: zu Hause bleiben

Krankenhaushygiene
Die Kommission für Krankenhaushygiene und Infektionsprävention hat Ende 2023 eine Empfehlung zur Unterbringung von Covid-19-Patienten herausgegeben.[32]
Impfungen und Immunisierung
Das Ziel der Covid-19-Impfungen ist es, schwere Krankheitsverläufe, Krankenhausaufenthalte und Todesfälle sowie Langzeitfolgen zu reduzieren. Hier dargestellt sind die aktuellen Empfehlungen der STIKO von Anfang 2024 (Stand Ende 2025).[39]
Basisimmunität
Die Ständige Impfkommission (STIKO) des Robert Koch-Instituts empfiehlt eine Basisimmunität für
- allen im Alter ab 18 Jahren,
- Bewohner von Pflegeeinrichtungen und bei erhöhtem Risiko Bewohnern der Eingliederungshilfe,
- Menschen im Alter von 6 Monaten bis 17 Jahren, wenn sie eine Grundkrankheit mit erhöhtem Risiko haben,
- Beschäftigte in der medizinischen und pflegerischen Versorgung,
- enge Kontaktpersonen von Personen, bei denen keine schützende Immunantwort zu erwarten ist,
- Frauen im gebärfähigen Alter und Schwangere.
Unter Basisimmunität werden drei Antigen-Kontakte (d. h. Impfungen oder Infektionen) verstanden. Typischerweise sollte der zweite Antigen-Kontakt einen Abstand von mindestens 3 Monaten zum ersten haben, der dritte einen Abstand von sechs Monaten zum zweiten. Dabei sollten mindestens zwei Antigen-Kontakt durch eine Impfung mit einem COVID-19-Impfstoff stattfinden.
Auffrischungsimpfungen
Eine Jährliche Auffrischungsimpfung im Herbst empfiehlt die STIKO für
- allen im Alter ab 60 Jahren,
- Bewohner von Pflegeeinrichtungen und bei erhöhtem Risiko Bewohnern der Eingliederungshilfe,
- Menschen im Alter ab 6 Monaten, wenn sie eine Grundkrankheit mit erhöhtem Risiko haben,
- Beschäftigte in der medizinischen und pflegerischen Versorgung,
- enge Kontaktpersonen von Personen, bei denen keine schützende Immunantwort zu erwarten ist.
Es werden kontinuierlich Impfstoffe entwickelt, die sich an den aktuell zirkulierenden SARS-CoV-2-Varianten orientieren.
Krankheitsentstehung bei COVID-19
Das COVID-19 auslösende Virus SARS-CoV-2 dringt wie SARS-CoV-1 bei SARS über eine Bindung an das in der Zellmembran verankerte Enzym ACE2 in die menschliche Zelle ein.[40] Dabei interagiert das virale Spike-Glykoprotein mit ACE2. Für diesen Prozess ist die Mitwirkung der Serinprotease TMPRSS2 notwendig.[41] Im Versuch mit HeLa-Zellen, die ACE2 des Menschen, der Chinesischen Hufeisennase (Rhinolophus sinicus), einer Schleichkatzenart, des Hausschweins und der Maus exprimieren, konnte SARS-CoV-2 das jeweilige ACE2-Protein als Rezeptor nutzen, um in die Zelle einzudringen, nur bei dem Maus-ACE2 gelang dies nicht, ebenso wenig bei HeLa-Zellen, die kein ACE2 bildeten. An Rezeptoren, die von anderen Coronaviren genutzt werden, findet keine Bindung von SARS-CoV-2 statt.[40] Das Protein LRRC15 ist vermutlich ein Resistenzfaktor gegen SARS-CoV-2 und hemmt dessen Vermehrung.
Eine reverse Suche in einer humanen Zelltypen- und Genexpressions-Datenbank (Human Cell Atlas, kurz: HCA) nach Zelltypen und Geweben, bei denen neben ACE2 auch TMPRSS2 auf Membranoberflächen vorhanden ist, zeigte, dass in der Nasenschleimhaut vor allem den Becherzellen, aber auch den Flimmerepithelen die höchsten Konzentrationen dieser beiden Proteine auftreten. Daher werden diese Zellen als Eintrittspforte für SARS-CoV-2 angesehen und auch als Reservoir vermutet.[42][43] Die Proteine werden ebenso in den Hornhaut-Zellen des Auges, in der Darmschleimhaut sowie im Herz in Perizyten der Blutkapillaren, Herzmuskelzellen und Fibroblasten gebildet. Dabei bleibt die erste Phase des Befalls im Nasenrachen nahezu symptomfrei, während bei Übergang in eine schwere Verlaufsform überwiegend die Lunge angegriffen wird, da ein Großteil der ACE-2 exprimierenden Zellen des Menschen in den Typ-II-Pneumozyten der Lunge vorkommt.[44][45] Als weitere Gründe für die besondere Anfälligkeit der Lunge wird ihre große Oberfläche angegeben,[45] außerdem exprimieren die Pneumozyt-Typ-II-Zellen diverse Gene, die die Replikation und Transmission von SARS-CoV-2 begünstigen.[44] Bei Untersuchungen an kryokonservierten Lungengewebsproben von Nichtinfizierten konnte auch gezeigt werden, dass Lungengewebe kaum ACE2 sowie die Transmembranprotease TMPRSS2 ausbildet, die Pneumozyten Typ II in der Lunge hingegen vermehrt. Diese Vorläuferzellen waren bei Männern und in fortgeschrittenem Alter tendenziell vermehrt nachzuweisen. Neben unterschiedlichen ACE2-Werten bei Männern und Frauen wird eine Ursache für die unterschiedliche Schwere der Erkrankung im geschlechtsspezifischen Hormonhaushalt vermutet: „Östrogen fördert eine Immunantwort, Testosteron dagegen unterdrückt sie“.[46] Eine Rolle der im Lungenepithel und benachbarten Gewebezellen gebildeten Proprotease Furin, die bei anderen Coronaviren dem Virus den Zellzutritt vereinfacht, wird diskutiert, da es am Spike-Protein von SARS-CoV-2 eine Furin-spezifische Trennstelle gibt. Außer in der Lunge wurde ACE-2 auch im Dünn- und Dickdarm, in den Atemwegen und in den Nieren nachgewiesen.[47] Eine Vermehrung des Virus in Darmzellen[48] und Inselzellen der Bauchspeicheldrüse wurde bestätigt.[49]
Durch Untersuchung von Lungengewebe mittels Biopsien oder Autopsien konnte ein diffuser Schaden an den Lungenbläschen nachgewiesen werden. Dieser zeigte sich in der Bildung hyaliner Membranen, der Verdickung der Alveolarwände und der Einwanderung von einkernigen Immunzellen und Makrophagen. Elektronenmikroskopisch ließen sich Viruspartikel in den Pneumozyten Typ 2 und den Zellen der Bronchien nachweisen. Neben den Veränderungen in der Lunge wurden auch Nekrosen der Lymphknoten am Lungenhilus, Lebervergrößerungen mit Entzündungszellinfiltrat, Atrophien der Milz und bei einzelnen Patienten vereinzelte degenerierte Nervenzellen des Gehirns beobachtet. Ob die Schäden außerhalb der Lunge direkt dem Virus oder der allgemeinen Belastung des Organismus durch die Erkrankung zuzuschreiben sind bleibt unklar.[50] In einer anderen Obduktionensserie zeigten sich herdförmige kleinste Thromben in den Lungenkapillaren auch in Abwesenheit von größeren Thrombosen im Organismus. Darüber hinaus zeigte sich bei fortgeschrittener Erkrankung auch ein fibrotischer Umbau der Lungenareale. Eine diffuse alveoläre Schädigung wie beim klassischen ARDS zeigte sich nur bei Patienten, die auch invasiv beatmet worden waren. Die Autoren schlossen daraus, dass die Bildung der Blutgerinnsel in den kleinsten Blutgefäßen den führenden Mechanismus der COVID-assoziierten Lungenschädigung darstellte.[51]
Das Eindringen des Virus in die Riechsinneszellen über die Nasenschleimhaut ist nachgewiesen. Eine Ausbreitung des Virus über diese Nervenzellen in das zentrale Nervensystem wird vermutet.[52] In einigen wenigen Fällen wurde das Auftreten eines Guillain-Barré-Syndroms diagnostiziert, das oft mit Virusinfektionen assoziiert ist. Die Patienten waren PCR-positiv – ein Liquornachweis gelang nicht. In der Bildgebung waren die Cauda equina sowie der Nervus facialis auffällig darstellbar. Symptomatisch zeigten sich Parästhesien und Paresen (motorische Ausfälle).[53] In einem weiteren Fallbericht wurde eine virusinduzierte Encephalitis auch durch positiven PCR-Nachweis in der Cerebrospinalflüssigkeit bestätigt.[54] Die Deutsche Gesellschaft für Neurologie (DGN) empfiehlt in einer eigens für die COVID-Erkrankung herausgegebenen Leitlinie eine fortlaufende Kontrolle besonders stationär, aber auch ambulant versorgter Patienten auf Frühzeichen neurologischer Mitbeteiligung.[55]

Italienische Intensivmediziner haben im April 2020 aufgrund ihrer klinischen Beobachtungen für das Vorhandensein zweier Erscheinungsformen der COVID-19-Viruspneumonie plädiert. Die Pneumonie beginne meist mit dem L-Typ, der sich durch ein geringes Vorhandensein eines Ödems im Gewebe auszeichne. Bei einem Teil der Patienten erfolge der Übergang in einen H-Typ, der sich durch ein Ödem im Gewebe auszeichne. Die Forscher plädieren für eine unterschiedliche Vorgehensweise bei der Beatmung dieser zwei Typen.[56] Bei Vorliegen extrem erniedrigter Sauerstoffsättigung, die auf eine massive Gasaustauschstörung schließen lässt und in Verbindung mit einer Bildgebung eindeutig auf ein akutes Lungenversagen (ARDS) deutet, weichen deutsche Pneumologen mittlerweile auch von bisherigen Leitlinien ab und empfehlen zunächst eine lungenschonendere nichtinvasive Beatmung (NIV) mit O2-Anreicherung.[57] Weitere führende Pneumologen regten ebenfalls aufgrund der vermehrten Endothelschäden befallener Lungengefäße an, nicht die klassische Beatmungsstrategie für ein entzündliches Pneumonitis-ARDS, sondern bei noch gegebener Elastizität mit an das von ihnen zur Unterscheidung als CARDS benannte klinische Bild bei COVID durch adaptierte Tidalvolumina und Expirationsdrucke (PEEP) anzupassen.[58]
Eine feingewebliche Untersuchung an sechs verstorbenen Patienten zeigte bei den fortgeschrittenen Lungenerkrankungen, die klinisch dem H-Typ zuzuordnen sind, die Ausbildung von Fibrinballen in den Lungenbläschen mit einem Infiltrat aus T-Lymphozyten und Plasmazellen sowie einer Hyperplasie der Typ-II-Pneumozyten. In den Blutgefäßen fanden sich Zeichen einer Endothelschädigung mit Ausbildung von Vakuolen im Zellplasma sowie der Unterbrechung der Verbindungen zwischen den Endothelzellen. Die Autoren stellten die Hypothese auf, dass der H-Typ als spätere Verlaufsform der COVID-Lungenkrankheit feingeweblich das Bild einer akut-fibrinösen organisierenden Pneumonie zeige.[59] Eine Untersuchung der Lungen von sieben Verstorbenen zeigte eine deutlich erhöhte Gefäßneubildung durch Lumenteilung in den befallenen Lungengefäßabschnitten. Die Autoren stellten die Hypothese auf, dass die krankhaft gesteigerte Gefäßneubildung zum Lungenschaden beitrage.[60]
Beim Übergang von milden zu schweren Verläufen wird mittlerweile ein virusinduzierter septischer Schock angenommen, der auf einem immunologischen Mechanismus basiert. Bei milden Fällen gelinge es dem Immunsystem, die Virusvermehrung in der Lunge rasch aufzuhalten. Bei schweren Fällen gelänge dies aber durch die virusbedingte Dysfunktion der direkt infizierten T-Zellen nicht. Die Virusvermehrung in den Lungenepithelzellen und auch den Innenschichtzellen der Lungenkapillaren führe zu einem Kapillarleck, das zur Einlagerung von Flüssigkeit in den Lungenbläschen führe. Durch die unkontrollierte Virusvermehrung komme es zu einer weiteren Einwanderung von Monozyten und Granulozyten. Dabei waren entzündungsverstärkende Zytokine und Chemokine einschließlich TNF-α, Interleukin-1β, IL-6, CXCL10, CCL2 und MIP-1α signifikant erhöht, wodurch sich Immunzellen am Ort einer Entzündung ansammeln und die Immunantwort verstärkt wird. Die Entzündungsreaktion in der Lunge führe zusammen mit dem Übergreifen des Virus auf andere Organe zu einer überschießenden Immunreaktion im Sinne des Zytokinsturms, der wiederum lokal zu weiterer Zellschädigung führt und im Anschluss die Lymphozytenzahl – besonders CD4+- und CD8+-T-Zellen – reduziert (Lymphopenie).[61] Bei milden Verläufen wurde kein signifikanter Abfall von Effektor-T-Zellen beobachtet. Bei schweren Verläufen korreliert deren Wiederanstieg mit der Heilung der Erkrankung.[62] Ebenso fand sich in einer kleinen Studie, dass überlebende Patienten vor allem IgG-Antikörper gegen das Spike-Protein bilden und an der Erkrankung Verstorbene vor allem IgG-Antikörper gegen das Nucleocapsid ausbilden.[63]
Als weiterer Mechanismus wird eine direkte Freisetzung des spezifischen Transkriptionsfaktors NF-κB angesehen, die wiederum IL-6 hochreguliert. Zusätzlich ist durch die infektionsbedingte Reduktion von ACE2 ein Anstieg von Serum-AngII beobachtbar, was wiederum über die AngII-AT1R-Achse auch NF-κB, Disintegrin und die Sekretase ADAM17 (englisch ADAM metallopeptidase domain 17) aktiviert, die die reife Form der Liganden des epidermalen Wachstumsfaktor-Rezeptors (EGFR) und TNFα, sowie zwei NF-κB-Stimulatoren erzeugt.[64] Die ADAM17-Induzierung verarbeitet auch die Membranform von IL-6Rα zur löslichen Form (sIL-6Rα), gefolgt von der gp130-vermittelten Aktivierung von STAT3 über den IL-6/sIL-6Rα-Komplex in IL-6Rα-negativen Zellen, wie Fibroblasten, Endothel- und Epithelzellen.[65] So kann eine SARS-CoV-2-Infektion im Atemtrakt sowohl NF-κB als auch STAT3 aktivieren, was wiederum den IL-6-Verstärker (englisch IL-6 amplifier, kurz IL-6 Amp) in Gang setzt, einem Mechanismus für die weitere Überaktivierung von NF-κB durch STAT3, was zu unterschiedlichen Entzündungs- und Autoimmunkrankheiten führt.[65] Dabei wird der IL-6-Verstärker in einer positiven Rückkopplungsschleife durch die Induzierung verschiedener entzündungsfördernder Zytokine und Chemokine, einschließlich Interleukin-6, und die Rekrutierung von lymphoiden und myeloischen Zellen, wie zum Beispiel aktivierte T-Zellen und Makrophagen, verstärkt. Dieser Prozess wird als Zytokinsturm bezeichnet und ist die Ursache für das akute Lungenversagen bei einer SARS-CoV-2-Infektion. Da IL-6 als wichtiger Marker für Seneszenz gilt, könnte der IL-6-Verstärker auch für die höhere Mortalität unter Älteren angesehen werden.[66]
Vergleichende Untersuchungen mit anderen Formen des akuten Lungenversagens und Entzündungssyndromen kommen jedoch zu dem Schluss, dass die Menge der freigesetzten Entzündungsmediatoren bei einer schweren COVID-19-Erkrankung deutlich niedriger ist als bei anderen mit einem Zytokinsturm vergesellschafteten Erkrankungen. Dies wird als Hinweis gewertet, dass auch andere Mechanismen der Krankheitsentstehung wie Gefäßentzündung, direkte virale Schädigung oder durch das Virus induzierte Immunschwäche stark zur Schwere der Erkrankung beitragen.[67]
Interferon-1 ist ein zentraler Regler der zellulären Immunantwort gegen Viren. Im Gegensatz zu anderen respiratorischen Viren zeichnet sich COVID durch eine Verminderung von Interferon-1 und Interferon-3 aus.[68] Ebenso wurde eine Verminderung der Produktion von Interferon-1 durch das Virusprotein Orf9b im Zellmodell nachgewiesen.[69] In einer Studie wurden bei 3,5 % der untersuchten COVID-Patienten mit schwerem Verlauf angeborene Defekte der Interferon-1-Bildung festgestellt.[70]
Interferon alpha spielt eine komplexe, janus-artige Rolle für die Pathogenese von COVID-19. Obwohl es die Elimination virusbefallener Zellen fördert, reguliert es auch die Expression von ACE-2 hoch, so dass es zugleich den Eintritt von SARS-Cov2-Viren in Zellen und deren Replikation erleichtert[43][71]. Ein Wettbewerb negativer (über den protektiven Effekt von Interferon Alpha) und positiver Rückkoppelungen (über Hochregulation von ACE-2) ist daher entscheidend für den Verlauf der Erkrankung[72].
Forscher aus Wuhan haben im März 2020 in einer Studie auch von Herzmuskelschäden berichtet. Bei rund einem Fünftel der 416 untersuchten hospitalisierten Patienten zeigte sich neben der Lungenschädigung auch eine Schädigung des Herzmuskels. Die Ursache der Herzschädigung sei noch nicht klar. Sie vermuteten eine negative Wirkung der im Rahmen der Pneumonie ausgelösten Entzündungsreaktion[73] sowie eine direkte Infektion und erhöhter Stress des Herzens durch die mangelnde Sauerstoffversorgung und die höhere Kreislaufbelastung. Bei Autopsien zeigten sich Entzündungsinfiltrate, die mit Regionen von Zelluntergang korrelierten. Das Bild der Herzmuskelschädigung war in diesen Fällen vereinbar mit einer Myokarditis.[74] Deren Ausbildung ohne bekannte koronare Vorerkrankung wurde auch ohne Beteiligung der üblichen Pneumonitis beobachtet.[75] Mit dem Alter steigt die Expression von ACE2 und TMPRSS2 in Herzmuskelzellen an, über die der Zellzutritt erfolgt. Die Schädigung der Kardiomyozyten ist korreliert mit dem Anstieg von Troponin, einem typischen Marker für Herzinfarkt. Resultiert eine Pumpschwäche des linken Ventrikels, könne das die verminderten Überlebenschancen Älterer erklären. Diese Zusammenhänge, sowie eine höhere Expression eines IL-6 Rezeptors auf Kardiomyozyten im Alter, der für den Zytokinsturm verantwortlich ist, wurde bei postmortem Untersuchungen des Herzens von Patienten gefunden, die nicht an kardialen Erkrankungen, aber auch nicht durch SARS-CoV-2 verstarben.[76] Im Fall zweier relativ junger und nicht vorerkrankter Patienten, die aufgrund geschilderter Symptome einen grippeähnlichen Infekt durchgemacht hatten, zeigte sich 4 Wochen später Atemnot, die den Verdacht einer Herzmuskelfunktionsstörung nahelegte. PCR-Tests der zur Verdachtsabklärung entnommenen Biopsate waren positiv, sodass die Herzerkrankung als Folge einer SARS-CoV-2-Infektion vermutet wird.[77] In einer weiteren Fallserie wurde in Gewebeproben von 104 Patienten, die wegen des Verdachts einer Myokarditis oder anderer entzündlicher Herzkrankheiten untersucht wurden, bei 5 von ihnen das Virusgenom von SARS-CoV-2 nachgewiesen. Bei allen – zwischen 36 und 62 Jahre alt – war es zu einer deutlichen Pumpschwäche gekommen und Troponin bei 4 der 5 Patienten erhöht. Die Studie legt nahe, dass nach einer COVID-19-Erkrankung mit einer Herzbeteiligung zu rechnen ist, obwohl der direkte Nachweis, dass das Virus den Herzmuskel angreift, noch nicht erbracht sei.[78]
Ebenso konnte eine Virusvermehrung in den Nierenkanälchen mit akuter Schädigung des Tubulus durch die nachfolgende Entzündungsreaktion an einzelnen Obduktionsfällen nachgewiesen werden.[79]
In seltenen Einzelfällen tritt bei Kleinkindern vermehrt das Kawasaki-Syndrom auf, eine Gefäßentzündung bei der als Begleitsymptom z. B. Hautausschläge auftreten. Ein direkter Zusammenhang mit einer SARS-CoV-2-Infektion wird vermutet.[80][81] Von der WHO wurde dieses Krankheitsbild multisystem inflammatory syndrome in children (MIS-C) benannt.[82] Mit Stand 1. Juli sind weltweit mehr als 1000 Kinder mit diesem eher seltenen Syndrom erkrankt. In einer Studie wurden 186 Fälle diagnostiziert, wobei das Durchschnittsalter bei 8,3 Jahren lag. Die Inzidenz beträgt 2 auf 100.000. Die ersten Anzeichen etwa 2 bis 4 Wochen nach Infektion bestehen in hohem Fieber, Tachykardie, gastrointestinalen Symptomen, Hautausschlag sowie konjunktivalen Injektionen. CRP war bei allen, außerdem D-Dimer-Werte und Troponin bei den meisten erhöht. Etwa die Hälfte zeigte Zeichen einer Myokarditis, 80 % mussten intensiv behandelt werden. Zwei Kinder verstarben.[83]
Covid-19 während der Pandemie
Gegen Ende der Pandemie, mit dem Aufkommen der Omikron-Variante, hat die Wahrscheinlichkeit für einen schweren Krankheitsverlauf abgenommen. Dieser Absatz bezieht sich auf die früheren Varianten.
Der Krankheitsverlauf ist unspezifisch und kann stark variieren. Laut Schätzung des RKI haben 55 bis 85 % der Infizierten spürbare Beschwerden und/oder zeigen erkennbare Anzeichen einer Erkrankung (Symptome) oder typische Symptomkombinationen (Syndrom) einer COVID-19-Erkrankung (Manifestationsindex). Die übrigen Infizierten sind beschwerdefrei und zeigen keine Symptome; sie sind asymptomatisch erkrankt, können aber dennoch das Virus weiterverbreiten.[8][84] Bei rund 81 % der registrierten Erkrankungen ist ein leichter Verlauf mit Fieber oder einer leichten Lungenentzündung, trockenem Husten und Müdigkeit zu beobachten. Weniger häufig sind eine verstopfte Nase, Kopfschmerzen, Halsschmerzen, Gliederschmerzen, Bindehautentzündungen, Durchfall, Erbrechen, Geschmacks- und Geruchsverlust, Hautausschlag oder Verfärbung von Fingern oder Zehen.[85] Bei etwa 14 % der Krankheitsfälle ist der Verlauf schwerer, und in etwa 5 % so schwer, dass eine Beatmung der Patienten auf einer Intensivstation erfolgen muss.[86] Die höchste Gefährdung schwer zu erkranken besteht für ältere Menschen und solche mit Vorerkrankungen oder unzureichendem Immunschutz.[87] Bei einem schweren Verlauf von COVID-19 tritt eine beidseitige Lungenentzündung und akutes Lungenversagen auf; die Betroffenen können sterben.[8] Beobachtet wurden außerdem krankhafte Veränderungen der Leber,[88] des zentralen Nervensystems,[89] der Nieren,[79] der Blutgefäße[90] und des Herzens.[91][92]
Anhaltende Beschwerden nach der Erkrankung, auch „Long COVID“ genannt, kommen relativ häufig vor, sowohl bei anfänglich schwer Erkrankten[93] als auch bei jungen, gesunden,[94] anfänglich nur leicht Erkrankten. Sie können zu langanhaltenden chronischen Beschwerden in vielen Organsystemen führen.[95] Bei über 100.000 Teilnehmern von COVID-Impfstudien dagegen wurden (Stand Dezember 2020) keine Hinweise auf Long Covid beobachtet.[96][97][98] Long Covid ist Thema laufender Forschung.[74][99][100][101]
COVID-19 wird seit Beginn der Pandemie intensiv erforscht und die Ergebnisse werden international geteilt. Um andere Fachwissenschaftler umgehend über neueste Forschungsergebnisse zu informieren, ist es üblich, aktuelle Studien als Preprints im Internet auf speziellen Servern zu veröffentlichen.[102] Veröffentlichungen in den Sozialen Medien, aber auch in Presse, Rundfunk und Fernsehen sollten nicht nur auf diesen ungeprüften Studien, sondern auf Veröffentlichungen reputabler und fachlich zuständiger Institutionen basieren, so z. B. des Robert Koch-Instituts, der Weltgesundheitsorganisation, des National Health Service (NHS) oder Centers for Disease Control and Prevention (CDC). Diesen liegen zum Teil Peer-Reviews der betreffenden Studien zu Grunde, auf die dort auch verwiesen wird.
Bereits Ende des Jahres 2020 wurden in der Europäischen Union und in einigen Nicht-EU-Ländern COVID-Impfstoffe zugelassen und Impfkampagnen gestartet. Das Wissenschaftsmagazin Science erklärte die Entwicklung von Impfstoffen gegen das SARS-CoV-2 in nie dagewesener Geschwindigkeit zum wissenschaftlichen Durchbruch des Jahres (Breakthrough of the Year).[103]
Meldepflicht, ICD-10-Einordnung, Berufskrankheit
Meldepflicht
In Deutschland sind Verdacht einer Erkrankung, die Erkrankung sowie der Tod in Bezug auf die Coronavirus-Krankheit-2019 seit 23. Mai 2020 gemäß § 6 Abs. 1 Nr. 1 lit. t des Infektionsschutzgesetzes (IfSG) meldepflichtig. Die Meldepflicht wurde bereits zum 1. Februar 2020 durch Verordnung eingeführt. Seit der gesetzlichen Regelung durch das „Zweite Gesetz zum Schutz der Bevölkerung bei einer epidemischen Lage von nationaler Tragweite“ sind auch der Behandlungszustand zur Krankheit (einschließlich der Genesung[104][105]) und der Serostatus durch Ärzte und Gesundheitsämter anzugeben (§ 9 Abs. 1 Nr. 1 lit. n, § 11 Abs. 1 Nr. 1 lit. d und j IfSG). Die klinisch-epidemiologischen Kriterien für den Verdacht[106] werden wie nach der vorherigen Verordnung durch das Robert Koch-Institut festgelegt und veröffentlicht (als Falldefinitionen nach § 11 Absatz 2 IfSG).[105]
Zudem besteht in Deutschland für Labore eine Meldepflicht hinsichtlich des Virus SARS-CoV-2 in Bezug auf Menschen. Seit dem 2. Juli 2020 besteht eine Meldepflicht, wenn Haustiere positiv getestet wurden.[107]
In Österreich bestand ebenfalls Anzeigepflicht nach dem Epidemiegesetz von 1950[108] zusammen mit einer Verordnung[109]. Die Pflicht zur Anzeige bestand für Verdachts-, Erkrankungs- und Todesfälle aufgrund dieses Virus. Die Meldepflicht wurde am 1. Juli 2023 aufgehoben.[110]
Auch in der Schweiz existiert eine Meldepflicht für den Erreger Sars-CoV-2. Diese folgt aus dem Epidemiengesetz[111] der Schweiz in Verbindung mit der Epidemienverordnung[112] und der Verordnung des Eidgenössischen Departements des Innern (EDI) über die Meldung von Beobachtungen übertragbarer Krankheiten des Menschen[113]. Nach Anhang 3 der Verordnung des EDI müssen Labore einen positiven und negativen Befund (also Nachweis) von Sars-CoV-2 melden. Nicht zu melden ist der Nachweis durch einen Antigen-Schnelltest.
Abwasser-Monitoring
In Deutschland finden seit 2022 Abwasseruntersuchungen statt, um die epidimeologische Lage zu beurteilen. Dabei wird die Viruslast von SARS-CoV-2-, Influenza- und RSV-Viren bestimmt.[114]
ICD-Einordnung
| Klassifikation nach ICD-10-GM | |
|---|---|
| U08.9 | COVID-19 in der Eigenanamnese, nicht näher bezeichnet |
| U09.9! | Post-COVID-19-Zustand, nicht näher bezeichnet |
| U10.9 | Multisystemisches Entzündungssyndrom in Verbindung mit COVID-19, nicht näher bezeichnet |
| U99.0! | Spezielle Verfahren zur Untersuchung auf SARS-CoV-2 |
| ICD-10 online (GM-Version 2024) | |
Am 17. Februar 2020 wurde die Krankheit durch die Weltgesundheitsorganisation (WHO) in die Internationale Klassifikation der Krankheiten (ICD) in der aktuellen, international gültigen Ausgabe ICD-10-WHO (Version 2019) unter Schlüsselnummer »U07.1« aufgenommen. Für die in Deutschland geltende ICD-10-GM (German Modification) wurde als sekundärer Kode die Ausrufezeichenschlüsselnummer »U07.1!« vergeben und die Krankheit als COVID-19 (Coronavirus-Krankheit-2019) bezeichnet.[115] Weiterhin erfolgte eine entsprechende Ergänzung für die Todesursachenkodierung in der ICD-10-GM.[116] Am 23. März 2020 wurde von der WHO eine Anpassung vorgenommen, die darauf abzielt, auch Verdachtsfälle kodieren zu können. Entsprechend werden mit der Schlüsselnummer »U07.1« per Labordiagnostik bestätigte COVID-19-Erkrankungen kodiert, während die »Schlüsselnummer U07.2« für Fälle vorgesehen ist, die zwar klinisch-epidemiologisch, aber nicht per Labordiagnostik bestätigt wurden. Für die ICD-10-GM erfolgt die Kodierung analog in Form der beiden sekundären Kodes »U07.1!« mit der Bezeichnung: COVID-19, Virus nachgewiesen und »U07.2!« mit der Bezeichnung: COVID-19, Virus nicht nachgewiesen.[117] Zweites gilt aber nur, soweit vorher ein Verdacht auf COVID-19 bestand.[118] Sofern kein Verdacht auf eine Erkrankung bestand, ein Test auf SARS-CoV-2 durchgeführt wurde und dieser Test negativ ausfällt, so ist mit »U99.0!« für Spezielle Verfahren zur Untersuchung auf SARS-CoV-2 zu kodieren zusammen mit »Z11« für Spezielle Verfahren zur Untersuchung auf infektiöse und parasitäre Krankheiten.[119]
| Klassifikation nach ICD-10-GM | |
|---|---|
| U11.9 | Notwendigkeit der Impfung gegen COVID-19, nicht näher bezeichnet |
| U12.9! | Unerwünschte Nebenwirkungen bei der Anwendung von COVID-19-Impfstoffen, nicht näher bezeichnet |
| ICD-10 online (GM-Version 2024) | |
Im November 2020 veröffentlicht das BfArM (früher DIMDI) in seinem Newsletter neue Codes, welche von der WHO am 11. November 2020 in die ICD-10 aufgenommen worden waren.[120] Diese Codes sind ab 2021 auch in der Schweiz zu verwenden.[121]
Im März 2021 werden vom BfArM neue Codes veröffentlicht, welche im Kontext zur Covid-19-Impfung stehen. In Deutschland sind diese Codes ab 10. März 2021 zu verwenden.[122]
Berufskrankheit
Nach deutschem Recht kann COVID-19 als Berufskrankheit anerkannt werden, wenn der Erkrankte im Gesundheitsdienst, in der Wohlfahrtspflege oder in einem Laboratorium tätig oder durch eine andere Tätigkeit der Infektionsgefahr in ähnlichem Maße besonders ausgesetzt war.[123]
Siehe auch
Abschnitt „Haustiere als mögliche Wirte“ im Artikel SARS-CoV-2
TV-Dokumentationen
- Der Ausbruch – War die Pandemie vermeidbar? TV-Dokumentation in HD von Michael Wech, Peter Wolf; D 2022; mitwirkend: Lawren E. Gostin (globales Gesundheitsrecht), Edward Holmes (Virologe), Jason McLellan (Strukturbiologe), Jeremy Farrar (Infektiologe), Richard Hatcheti (Epidemiologe), James Lawler (Infektiologe) u. a.; gesendet auf ZDF 17. Mai 2022.
- Brisante Spurensuche – Woher kam das Coronavirus wirklich? Originaltitel: Did Covid Leak from a Lab in China? GB 2021 für Channel 4- television; deutsche Synchronfassung: auf n-TV, 2022; Mitwirkend: Jane Metzler (Autor und Berater des nationalen Sicherheitsrates der USA und der WHO), Alina Chan (Molekularbiologin – The Broad Institute of MIT und Harvard), Nikolai Petrowsky (Mediziner an der Flinders University), David Relman (Mediziner an der Stanford University), Sir John Bell (Mediziner an der University of Oxford), Milton Leitenberg (Zentrum für sicherheitstechnische Studien, University of Maryland), Richard Ebright (Direktor des Mikrobiologischen Instituts der Rutgers University), Gilles Demaneuf (Datenanalyst), Rossana Segreto (Molekularbiologin – Expertin für Genomanalyse), Monali Rahalkar (Mikrobiologin am Agharkar Research Institute [ARI]), Nicholas Wade (Wissenschaftsjournalist bei New York Times und Nature) (auch verfügbar auf youtube.com).
- Corona – Ende in Sicht? »Was die Wissenschaft über SARS-CoV-2 weiß«. In: ZDF – planet e., Video-Dokumentation, 28 Minuten. ZDF, 17. Januar 2021, abgerufen am 15. Februar 2021 (in der ZDF-Mediathek → verfügbar bis 13. Januar 2023).
- Leschs Kosmos – Der Corona-Effekt: Freiheit dank Wissenschaft. (Teil der Wissenschaftsreihe Leschs Kosmos.) TV-Dokumentation in HD, ZDF 2022, Mitwirkend: Harald Lesch.
Weblinks
Institutionelle Informationen
- Erregersteckbrief zu SARS-CoV-2/COVID-19. (Stand: 1. Mai 2025). Bundesinstitut für Öffentliche Gesundheit, abgerufen am 20. Oktober 2025.
- Neuartiges Coronavirus (COVID-19) Bundesministerium für Soziales, Gesundheit, Pflege und Konsumentenschutz (Österreich) (mit Link zum amtlichen Dashboard zu COVID-19)
- Covid-19 Bundesamt für Gesundheit (Schweiz)
- Questions and answers on COVID-19 Europäisches Zentrum für die Prävention und die Kontrolle von Krankheiten (englisch)
- Q&A: Coronavirus disease (COVID-19) Weltgesundheitsorganisation (englisch)
- COVID-19 CoV Genetics. Auf: covidcg.org; zuletzt abgerufen am 1. Juli 2024.
COVID-19-Therapie
- RKI: COVID-19: Therapiehinweise und Empfehlungen. Auf: rki.de Stand vom 18. Februar 2025.
- S3-Leitlinie Empfehlungen zur Therapie von Patienten mit COVID-19 – Living Guideline der Deutschen Gesellschaft für Internistische Intensivmedizin und Notfallmedizin, Deutschen Interdisziplinäre Vereinigung für Intensiv- und Notfallmedizin, Deutschen Gesellschaft für Pneumologie und Beatmungsmedizin und der Deutschen Gesellschaft für Infektiologie. In: AWMF online (Stand 02/2025)
- IDSA Guidelines on the Treatment and Management of Patients with COVID-19. Richtlinien der Infectious Diseases Society of America (englisch), Stand: 14. Oktober 2025.
Einzelnachweise
- ↑ § 6 Abs. 1 Nr. 1 lit. t des Infektionsschutzgesetzes (Deutschland).
- ↑ Terminologiesammlung INFEC20 – Terminologie der übertragbaren Krankheiten, Stichwort COVID-19, hrsg. von der Schweiz. Bundeskanzlei.
- ↑ a b COVID-19: Vorbeugung, Symptome, Therapie. 12. Januar 2024, abgerufen am 21. Oktober 2025.
- ↑ a b c d https://www.infektionsschutz.de/download/5895-BZgA_Erregersteckbrief-SARS-CoV-2.pdf_.pdf Erregersteckbrief des Bundesinstituts für Öffentliche Gesundheit, abgerufen am 21. Oktober 2025
- ↑ a b c d e f g h i RKI: RKI-Ratgeber Covid-19. In: RKI-Ratgeber. RKI, 22. Mai 2025, abgerufen am 25. Oktober 2025.
- ↑ Nicky Phillips, Smriti Mallapaty, David Cyranoski: How quickly does the Wuhan virus spread? In: Nature. 21. Januar 2020, doi:10.1038/d41586-020-00146-w (englisch).
- ↑ Zhangkai J. Cheng, Jing Shan: 2019 Novel coronavirus: where we are and what we know. In: Infection. 18. Februar 2020, doi:10.1007/s15010-020-01401-y (englisch).
- ↑ a b c d e f Epidemiologischer Steckbrief zu SARS-CoV-2 und COVID-19. Robert Koch-Institut, 9. Februar 2021, archiviert vom am 21. Februar 2021; abgerufen am 21. Februar 2021.
- ↑ Na Zhu, Dingyu Zhang, Wenling Wang et al.: A Novel Coronavirus from Patients with Pneumonia in China. In: The New England Journal of Medicine. 2019, doi:10.1056/NEJMoa2001017 (englisch).
- ↑ Jasper Fuk-Woo Chan, Shuofeng Yuan, Kin-Hang Kok et al.: A familial cluster of pneumonia associated with the 2019 novel coronavirus indicating person-to-person transmission: a study of a family cluster. In: The Lancet. 24. Januar 2020, doi:10.1016/S0140-6736(20)30154-9 (englisch).
- ↑ Michelle L. Holshue, Chas DeBolt et al. for the Washington State 2019-nCoV Case Investigation Team: First Case of 2019 Novel Coronavirus in the United States. In: The New England Journal of Medicine. 31. Januar 2020, doi:10.1056/NEJMoa2001191 (englisch).
- ↑ Dongyu Guo: Evaluation of coronavirus in tears and conjunctival secretions of patients with SARS-CoV-2 infection. In: Journal of Medical Virology. 18. Februar 2020, doi:10.1002/jmv.25725.
- ↑ Patrick Hunziker: Minimizing exposure to respiratory droplets, ‘jet riders’ and aerosols in air-conditioned hospital rooms by a ‘Shield-and-Sink’ strategy. In: medRxiv. 16. Dezember 2020, doi:10.1101/2020.12.08.20233056 (medrxiv.org [abgerufen am 25. Dezember 2020]).
- ↑ Positionspapier der Gesellschaft für Aerosolforschung zum Verständnis der Rolle von Aerosolpartikeln beim SARS-CoV-2 Infektionsgeschehen. (PDF) Gesellschaft für Aerosolforschung (GAeF), 7. Dezember 2020, abgerufen am 20. April 2021.
- ↑ zum aktuellen Stand siehe Xin Zhang et al.: Monitoring SARS-CoV-2 in air and on surfaces and estimating infection risk in buildings and buses on a university campus. In: nature.com 27. April 2022 / journal of exposure science & environmental epidemiology.
- ↑ Navigating pregnancy and COVID-19 | UNICEF. Abgerufen am 24. Oktober 2025 (englisch).
- ↑ a b COVID-19 symptoms and severity. 2. August 2023, abgerufen am 26. Oktober 2025 (englisch).
- ↑ Eva Tenzer, Carolin Collin: Corona-Verlauf: Infiziert, erkrankt, schwer erkrankt? Apotheken-Umschau, 18. März 2020, abgerufen am 23. November 2021.
- ↑ Coronavirus disease (COVID-19). 28. März 2023, abgerufen am 26. Oktober 2025 (englisch).
- ↑ a b Falldefinition Coronavirus-Krankheit-2019 (COVID-19). (PDF; 82 kB) In: Website des Robert Koch-Instituts. 29. Mai 2020, abgerufen am 19. Juni 2020.
- ↑ Victor M Corman, Olfert Landt, Marco Kaiser, Richard Molenkamp, Adam Meijer: Detection of 2019 novel coronavirus (2019-nCoV) by real-time RT-PCR. In: Eurosurveillance. Band 25, Nr. 3, 23. Januar 2020, ISSN 1560-7917, doi:10.2807/1560-7917.ES.2020.25.3.2000045, PMID 31992387, PMC 6988269 (freier Volltext) – (eurosurveillance.org [abgerufen am 15. Mai 2020]).
- ↑ Laboratory testing for 2019 novel coronavirus (2019-nCoV) in suspected human cases. In: Website WHO. Weltgesundheitsorganisation (WHO), 19. März 2020, abgerufen am 26. März 2020 (englisch).
- ↑ RKI: Hinweise zur Testung von Patienten auf Infektion mit dem neuartigen Coronavirus SARS-CoV-2, Stand 11. August 2020, Abruf 30. August 2020.
- ↑ RKI: zeitliche Verhältnisse von Transmission – Latenz – Inkubation – PCR-Nachweis – Infektiosität – AK-Nachweis bei SARS-CoV-2 ( vom 6. September 2020 im Internet Archive), 3. Juli 2020, Abruf 30. August 2020, Grafik PNG.
- ↑ a b RKI – Coronavirus SARS-CoV-2 – Hinweise zur Testung von Patienten auf Infektion mit dem neuartigen Coronavirus SARS-CoV-2. Abgerufen am 10. Dezember 2020.
- ↑ Victor M. Corman, Verena Claudia Haage, Tobias Bleicker, Marie Luisa Schmidt, Barbara Mühlemann: Comparison of seven commercial SARS-CoV-2 rapid Point-of-Care Antigen tests. In: medRxiv. 13. November 2020, S. 2020.11.12.20230292, doi:10.1101/2020.11.12.20230292 (medrxiv.org [abgerufen am 10. Dezember 2020]).
- ↑ Heshui Shi, Xiaoyu Han, Nanchuan Jiang, Yukun Cao, Osamah Alwalid, Jin Gu, Yanqing Fan, Chuansheng Zheng: Radiological findings from 81 patients with COVID-19 pneumonia in Wuhan, China: a descriptive study. In: The Lancet Infectious Diseases. 24. Februar 2020, doi:10.1016/S1473-3099(20)30086-4 (englisch).
- ↑ Jinnong Zhang, Luqian Zhou, Yuqiong Yang, Wei Peng, Wenjing Wang, Xuelin Chen: Therapeutic and triage strategies for 2019 novel coronavirus disease in fever clinics. In: The Lancet Respiratory Medicine. 13. Februar 2020, doi:10.1016/S2213-2600(20)30071-0 (englisch).
- ↑ Yi Huang, Sihan Wang, Yue Liu, Yaohui Zhang, Chuyun Zheng, Yu Zheng, Chaoyang Zhang, Weili Min, Huihui Zhou, Ming Yu, Mingjun Hu: A Preliminary Study on the Ultrasonic Manifestations of Peripulmonary Lesions of Non-Critical Novel Coronavirus Pneumonia (COVID-19). In: SSRN. 28. Februar 2020, doi:10.2139/ssrn.3544750 (englisch).
- ↑ Seda Bilaloglu et al.: Thrombosis in Hospitalized Patients With COVID-19 in a New York City Health System. In: JAMA. Band 324, Nr. 8, 25. August 2020, S. 799, doi:10.1001/jama.2020.13372.
- ↑ Medikamentöse Therapie bei COVID-19 mit Bewertung durch die Fachgruppe COVRIIN am Robert Koch-Institut RKI, 5. Oktober 2021, doi:10.25646/7743.12
- ↑ a b Deutsche Gesellschaft für Internistische Intensivmedizin und Notfallmedizin (DGIIN), Deutsche Interdisziplinäre Vereinigung für Intensiv- und Notfallmedizin (DIVI), Deutsche Gesellschaft für Pneumologie und Beatmungsmedizin (DGP), Deutsche Gesellschaft für Infektiologie (DGI)-Leitlinie [Empfehlungen zur Therapie von Patienten mit COVID-19 S3] der 2025-02-28. In: AWMF online
- ↑ AWMF Leitlinienregister. Abgerufen am 27. Oktober 2025.
- ↑ COVID-19 treatments, EMA, abgerufen am 26. Mai 2022.
- ↑ COVID-19-Impfstoffe. In: Paul-Ehrlich-Institut. Paul-Ehrlich-Institut, abgerufen am 28. Oktober 2025.
- ↑ https://www.infektionsschutz.de/download/7407-Plakat_Hygienekampagne_Hygiene_schuetzt_DE.pdf
- ↑ Forum Genforschung der Akademie der Naturwissenschaften Schweiz: mRNA-Impfstoffe gegen das Coronavirus. Abgerufen im August 2021.
- ↑ Forum Genforschung der Akademie der Naturwissenschaften Schweiz: Vektorimpfstoffe gegen das Coronavirus. Abgerufen im August 2021.
- ↑ Epidemiologisches Bulletin 2/2024. In: STIKO: Aktualisierung der COVID-19-Impfempfehlung. Robert Koch-Institut, 11. Januar 2024, abgerufen am 28. Oktober 2025.
- ↑ a b Peng Zhou, Xing-Lou Yang, Xian-Guang Wang et al.: A pneumonia outbreak associated with a new coronavirus of probable bat origin. In: Nature. 3. Februar 2020, doi:10.1038/s41586-020-2012-7 (englisch, dieser Artikel wurde am 23. Januar 2020 vorab ohne Peer-Review auf bioRxiv veröffentlicht).
- ↑ Markus Hoffmann, Hannah Kleine-Weber, Simon Schroeder, Christian Drosten, Stefan Pöhlmann et al.: SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor. In: Cell. 4. März 2020, doi:10.1016/j.cell.2020.02.052 (englisch).
- ↑ W. Sungnak, N. Huang, C. Bécavin et al.: SARS-CoV-2 entry factors are highly expressed in nasal epithelial cells together with innate immune genes. In: Nature Medicine. 2020, doi:10.1038/s41591-020-0868-6.
- ↑ a b Carly G. K. Ziegler et al.: SARS-CoV-2 receptor ACE2 is an interferon-stimulated gene in human airway epithelial cells and is detected in specific cell subsets across tissues. In: cell. doi:10.1016/j.cell.2020.04.035.
- ↑ a b Yu Zhao, Zixian Zhao, Yujia Wang, Yueqing Zhou, Yu Ma, Wei Zuo: Single-cell RNA expression profiling of ACE2, the putative receptor of Wuhan 2019-nCov. In: BioRxiv. 26. Januar 2020, doi:10.1101/2020.01.26.919985 (englisch).
- ↑ a b Haibo Zhang, Josef M. Penninger, Yimin Li, Nanshan Zhong, Arthur S. Slutsky: Angiotensin‑converting enzyme 2 (ACE2) as a SARS‑CoV‑2 receptor: molecular mechanisms and potential therapeutic target. In: Intensive Care Medicine. 3. März 2020, doi:10.1007/s00134-020-05985-9 (englisch).
- ↑ Daniel Lingenhöhl: Enzym lässt Männer häufiger und schwerer erkranken. In: Spektrum. 11. Mai 2020, abgerufen am 14. Mai 2020.
- ↑ Soeren Lukassen, Robert Lorenz et al.: SARS‐CoV‐2 receptor ACE2 and TMPRSS2 are primarily expressed in bronchial transient secretory cells. In: EMBO J. 14. April 2020, doi:10.15252/embj.20105114 (englisch).
- ↑ Hans Clevers et al.: SARS-CoV-2 productively infects human gut enterocytes. In: Science. 1. Mai 2020, doi:10.1126/science.abc1669.
- ↑ Peter K. Jackson et al.: SARS-CoV-2 infects human pancreatic β-cells and elicits β-cell impairment. In: Cell Metabolism. 18. Mai 2021, doi:10.1016/j.cmet.2021.05.013.
- ↑ Bin Cao et al.: SARS-CoV-2 and viral sepsis: observations and hypotheses. In: Lancet. 17. April 2020, doi:10.1016/S0140-6736(20)30920-X.
- ↑ Felix K.F. Kommoss: Pathologie der schweren COVID-19 bedingten Lungenschädigun – Hinweise auf Mechanismen und therapeutrische Ansätze. In: Deutsches Arzteblatt International. 2020, Nr. 117, S. 500–506, doi:10.3238/arztebl.2020.0500.
- ↑ J. Meinhardt, J. Radke, C. Dittmayer et al.: Olfactory transmucosal SARS-CoV-2 invasion as a port of central nervous system entry in individuals with COVID-19. In: Nature Neuroscience. 2020, doi:10.1038/s41593-020-00758-5.
- ↑ Gianpaolo Toscano et al.: Guillain–Barré Syndrome Associated with SARS-CoV-2. In: NEJM. 17. April 2020, doi:10.1056/NEJMc2009191.
- ↑ Takeshi Moriguchi et al.: A first case of meningitis/encephalitis associated with SARS-Coronavirus-2. In: International Journal of Infectious Diseases (IJID). Band 94, 25. März 2020, S. 55–58, doi:10.1016/j.ijid.2020.03.062 (englisch).
- ↑ Deutsche Gesellschaft für Neurologie (DGN): AWMF LL 030/144 Neurologische Manifestationen bei COVID-19 ( vom 20. August 2020 im Internet Archive). Auf: dgn.org, Stand 18. August 2020.
- ↑ Luciano Gattinoni et al.: COVID-19 pneumonia: different respiratory treatments for different phenotypes? In: Intensive Care Medicine. 14. April 2020, doi:10.1007/s00134-020-06033-2.
- ↑ Positionspapier zur praktischen Umsetzung der apparativen Differenzialtherapie der akuten respiratorischen Insuffizienz bei COVID-19. (PDF) In: Website DGP. 17. April 2020, archiviert vom (nicht mehr online verfügbar) am 18. April 2020; abgerufen am 17. April 2020.
- ↑ John J. Marini, Luciano Gattinoni: Management of COVID-19 Respiratory Distress. In: JAMA. Band 22, Nr. 323, 22. April 2020, S. 2329–2330, doi:10.1001/jama.2020.6825 (englisch).
- ↑ M. Copin, E. Parmentier, T. Duburcq et al.: Time to consider histologic pattern of lung injury to treat critically ill patients with COVID-19 infection. In: Intensive Care Medicine. 23. April 2020, doi:10.1007/s00134-020-06057-8.
- ↑ Danny Jonigk et al.: Pulmonary Vascular Endothelialitis, Thrombosis, and Angiogenesis in Covid-19. In: New England Journal of Medicine (NEJM). 21. Mai 2020, doi:10.1056/NEJMoa2015432.
- ↑ Hui Li, Bin Cao et al.: SARS-CoV-2 and viral sepsis: observations and hypotheses. In: Lancet. 17. April 2020, doi:10.1016/S0140-6736(20)30920-X.
- ↑ Christian R. Schulze-Florey et al.: Reappearance of effector T cells is associated with recovery from COVID-19. In: EBioMedicine. Band 57, Juli 2020, Artikel. 102885, doi:10.1016/j.ebiom.2020.102885.
- ↑ Galit Alter et al.: Distinct Early Serological Signatures Track with SARS-CoV-2 Survival. In: Immunity. Band 53, Nr. 3, 23. Juli 2020, ISSN 1074-7613, S. 524–532.e4, doi:10.1016/j.immuni.2020.07.020, PMID 32783920.
- ↑ S. Eguchi, T. Kawai, R. Scalia, V. Rizzo: Understanding Angiotensin II Type 1 Receptor Signaling in Vascular Pathophysiology. In: Hypertension. Band 71, Nummer 5, 05 2018, S. 804–810, doi:10.1161/HYPERTENSIONAHA.118.10266. PMID 29581215, PMC 5897153 (freier Volltext) (Review).
- ↑ a b M. Murakami, D. Kamimura, T. Hirano: Pleiotropy and Specificity: Insights from the Interleukin 6 Family of Cytokines. In: Immunity. Band 50, Nr. 4, April 2019, S. 812–831, doi:10.1016/j.immuni.2019.03.027. PMID 30995501 (Review).
- ↑ Toshio Hirano, Masaaki Murakami: COVID-19: A New Virus, but a Familiar Receptor and Cytokine Release Syndrome. In: Cell. 22. April 2020, doi:10.1016/j.immuni.2020.04.003.
- ↑ Daniel E. Leisman et al.: Cytokine elevation in severe and critical COVID-19: a rapid systematic review, meta-analysis, and comparison with other inflammatory syndromes. In: The Lancet Respiratory Medicine. 16. Oktober 2020, doi:10.1016/S2213-2600(20)30404-5.
- ↑ D. Blanco-Melo, B. E. Nilsson-Payant, W. C. Liu et al.: Imbalanced Host Response to SARS-CoV-2 Drives Development of COVID-19. In: Cell. 2020, Band 181, Nr. 5, S. 1036–1045, doi:10.1016/j.cell.2020.04.026.
- ↑ H. Jiang, H. Zhang, O. Meng et al.: SARS-CoV-2 Orf9b suppresses type I interferon responses by targeting TOM70. In: Cellular & Molecular Immunology. 2020, doi:10.1038/s41423-020-0514-8.
- ↑ Jean Laurent Casanova et al.: Inborn errors of type I IFN immunity in patients with life-threatening COVID-19. In: Science. 23. Oktober, 2020, doi:10.1126/science.abd4570.
- ↑ S. P. Sajuthi, P. DeFord, Y. LiN. D. Jackson, M. T. Montgomery, J. L. Everman, C. L. Rios, E. Pruesse, J. D. Nolin, E. G. Plender, M. E. Wechsler, A. C. Y. Mak, C. Eng, S. Salazar, V. Medina, E. M. Wohlford, S. Huntsman, D. A. Nickerson; s. Germer, M. C. Zody, G. Abecasis, H. M. Kang, K. M. Rice, R. Kumar, s. Oh, J. Rodriguez-Santana, E. G. Burchard, M. A. Seibold: Type 2 and interferon inflammation regulate SARS-CoV-2 entry factor expression in the airway epithelium. In: Nature communications. Band 11, Nr. 1, 12. Oktober 2020, S. 5139, doi:10.1038/s41467-020-18781-2, PMID 33046696.
- ↑ F. Tretter, E. M. J. Peters, J. Sturmberg, J. Bennett, E. Voit, J. W. DietrichG. Smith, W. Weckwerth, Z. Grossman, O. Wolkenhauer, J. A. Marcum: Perspectives of (/memorandum for) systems thinking on COVID-19 pandemic and pathology. In: Journal of evaluation in clinical practice. 28. September 2022, doi:10.1111/jep.13772, PMID 36168893.
- ↑ Shaobo Shi, Mu Qin, Bo Shen et al.: Association of Cardiac Injury With Mortality in Hospitalized Patients With COVID-19 in Wuhan, China. In: JAMA Cardiology. 25. März 2020, doi:10.1001/jamacardio.2020.0950 (englisch).
- ↑ a b Akbarshakh Akhmerov, Eduardo Marban: COVID-19 and the Heart. Circulation Research, 7. April 2020, doi:10.1161/CIRCRESAHA.120.317055
- ↑ Riccardo M. Inciardi et al.: Cardiac Involvement in a Patient With Coronavirus Disease 2019 (COVID-19). In: JAMA Cardiology. 27. März 2020, doi:10.1001/jamacardio.2020.1096.
- ↑ Robinson et al.: Genes encoding ACE2, TMPRSS2 and related proteins mediating SARS-CoV-2 viral entry are upregulated with age in human cardiomyocytes. In: Journal of Molecular and Cellular Cardiology. (JMCC) vom 17. August 2020, doi:10.1016/j.yjmcc.2020.08.009
- ↑ Wenzel et al: Evidence of SARS-CoV-2 mRNA in endomyocardial biopsies of patients with clinically suspected myocarditis tested negative for COVID-19 in nasopharyngeal swab. In: Cardiovascular Research. 20. Juni 2020, doi:10.1093/cvr/cvaa160.
- ↑ Wenzel et al. Detection of viral SARS‐CoV‐2 genomes and histopathological changes in endomyocardial biopsies. In: ESC Heart Failure. 12. Juni 2020, doi:10.1002/ehf2.12805.
- ↑ a b Bo Diao et al.: Human kidney is a target for novel severe acute respiratory syndrome coronavirus 2 infection. Open Access. In: Nature Communications. Band 12, 4. Mai 2021, 2506, doi:10.1038/s41467-021-22781-1 (englisch, nature.com [PDF; 16,2 MB; abgerufen am 12. September 2021]): “can directly infect human kidney, thus leading to acute kidney injury (AKI). […] retrospective analysis of clinical parameters from 85 patients with laboratory-confirmed coronavirus disease 2019 (COVID-19); moreover, kidney histopathology from six additional COVID-19 patients with post-mortem examinations was performed. We find that 27 % (23/85) of patients exhibited AKI. Haematoxylin & eosin staining shows that the kidneys from COVID-19 autopsies have moderate to severe tubular damage. In situ hybridization assays illustrate that viral RNA accumulates in tubules.”, preprint war doi:10.1101/2020.03.04.20031120
- ↑ Royal College of Paediatrics and Child Health: Guidance: Paediatric multisystem inflammatory syndrome temporally associated with COVID-19. (Volltext, PDF) In: Webseite RCPCH. (englisch).
- ↑ V. G. Jones, M. Mills, D. Suarez et al.: COVID-19 and Kawasaki disease: novel virus and novel case. In: Hospital Pediatrics. von 2020, doi:10.1542/hpeds.2020-0123.
- ↑ Multisystem inflammatory syndrome in children and adolescents with COVID-19. In: Scientific brief, who.int. WHO, 15. Mai 2020, abgerufen am 17. Mai 2020 (englisch).
- ↑ A. Randolph et al.: Multisystem Inflammatory Syndrome in U.S. Children and Adolescents. In: New England Journal of Medicine. (NEJM) vom 29. Juni 2020, doi:10.1056/NEJMoa2021680.
- ↑ D. Baud, X. Qi, K. Nielsen-Saines et al.: Real estimates of mortality following COVID-19 infection. In: The Lancet. Band 20, 12. März 2020, S. 773, doi:10.1016/S1473-3099(20)30234-6 (englisch, thelancet.com [PDF; 360 kB; abgerufen am 14. August 2020]).
- ↑ „Q&A on coronaviruses (COVID-19)“. Symptome von COVID-19. Weltgesundheitsorganisation (WHO), 17. April 2020, abgerufen am 14. August 2020 (englisch).
- ↑ Zunyou Wu, Jennifer M. McGoogan, CCDC: Characteristics of and Important Lessons From the Coronavirus Disease 2019 (COVID-19) Outbreak in China. In: Journal of the American Medical Association. 24. Februar 2020, doi:10.1001/jama.2020.2648 (englisch).
- ↑ Risikobewertung ( vom 21. Dezember 2021 im Internet Archive) des Robert Koch-Instituts, abgerufen am 14. August 2022.
- ↑ Fu-Sheng Wang: Liver injury in COVID-19: management and challenges. In: Lancet Gastroenterology & Hepatology. 4. März 2020, doi:10.1016/S2468-1253(20)30057-1.
- ↑ Yeshun Wu et al.: Nervous system involvement after infection with COVID-19 and other coronaviruses. In: Brain, Behavior and Immunity. Elsevier, 30. März 2020, doi:10.1016/j.bbi.2020.03.031.
- ↑ Frank Ruschitzka et al.: Endothelial cell infection and endotheliitis in COVID-19. In: The Lancet. 17. April 2020, doi:10.1016/S0140-6736(20)30937-5.
- ↑ R. M. Inciardi, L. Lupi, G. Zaccone et al.: Cardiac Involvement in a Patient With Coronavirus Disease 2019 (COVID-19). In: JAMA Cardiol. 27. März 2020, doi:10.1001/jamacardio.2020.1096.
- ↑ Valentina O. Puntmann, M. Ludovica Carerj, Imke Wieters, Masia Fahim, Christophe Arendt: Outcomes of Cardiovascular Magnetic Resonance Imaging in Patients Recently Recovered From Coronavirus Disease 2019 (COVID-19). In: JAMA Cardiology. 27. Juli 2020, doi:10.1001/jamacardio.2020.3557 (online [abgerufen am 14. August 2020]).
- ↑ How long does COVID-19 last? Abgerufen am 24. Dezember 2020.
- ↑ Gareth Iacobucci: Long covid: Damage to multiple organs presents in young, low risk patients. In: BMJ. Band 371, 17. November 2020, ISSN 1756-1833, doi:10.1136/bmj.m4470 (bmj.com [abgerufen am 24. Dezember 2020]).
- ↑ Elisabeth Mahase: Long covid could be four different syndromes, review suggests. In: BMJ. Band 371, 14. Oktober 2020, ISSN 1756-1833, doi:10.1136/bmj.m3981, PMID 33055076 (bmj.com [abgerufen am 24. Dezember 2020]).
- ↑ Fernando P. Polack et al.: Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. In: New England Journal of Medicine. 10. Dezember 2020, doi:10.1056/NEJMoa2034577, PMID 33301246, PMC 7745181 (freier Volltext) – (nejm.org [abgerufen am 24. Dezember 2020]).
- ↑ Evan J. et al.: Safety and Immunogenicity of SARS-CoV-2 mRNA-1273 Vaccine in Older Adults. In: The New England Journal of Medicine. 29. September 2020, ISSN 0028-4793, doi:10.1056/NEJMoa2028436, PMID 32991794, PMC 7556339 (freier Volltext).
- ↑ Evan J. et al.: Safety and Immunogenicity of SARS-CoV-2 mRNA-1273 Vaccine in Older Adults. In: New England Journal of Medicine. 29. September 2020, doi:10.1056/NEJMoa2028436, PMID 32991794, PMC 7556339 (freier Volltext) – (nejm.org [abgerufen am 24. Dezember 2020]).
- ↑ P. Zhang, J. Li, H. Liu et al.: Long-term bone and lung consequences associated with hospital-acquired severe acute respiratory syndrome: a 15-year follow-up from a prospective cohort study. In: Bone Research – Nature. Band 8, Nr. 8, 2020, doi:10.1038/s41413-020-0084-5.
- ↑ Chia-Husn Huang, Yuan Nian Hsu: First case of Coronavirus Disease 2019 (COVID-19) pneumonia in Taiwan. In: Journal of the Formosan Medical Association. 3. Auflage. Band 119, März 2020, S. 747–751, doi:10.1016/j.jfma.2020.02.007.
- ↑ Jing Gao et al.: Sars-Cov-2: Underestimated damage to nervous system. In: Travel Medicine and Infectious Disease. 24. März 2020, doi:10.1016/j.tmaid.2020.101642.
- ↑ Michael A. Johansson, Daniela Saderi: Open peer-review platform for COVID-19 preprints. In: Nature. 3. März 2020, doi:10.1038/d41586-020-00613-4.
- ↑ Jon Cohen: Science's Breakthrough of the Year 2020: shots of hope in a pandemic-ravaged world. In: sciencemag.org. Science, 17. Dezember 2020, abgerufen am 18. Dezember 2020 (englisch).
- ↑ Schutzpaket für mehr Coronatests und Pflege-Prämien beschlossen. Deutscher Bundestag, 14. Mai 2020, abgerufen am 14. Mai 2020.
- ↑ a b Gesetzentwurf der Fraktionen der CDU/CSU und SPD. (PDF) Entwurf eines Zweiten Gesetzes zum Schutz der Bevölkerung bei einer epidemischen Lage von nationaler Tragweite. In: Bundestags-Drucksache 19/18967. 5. Mai 2020, S. 2, 54 f., abgerufen am 14. Mai 2020.
- ↑ Empfehlungen des Robert Koch-Instituts zur Meldung von Verdachtsfällen von COVID-19. Robert Koch-Institut, 29. Mai 2020, abgerufen am 31. Mai 2020.
- ↑ Meldepflicht bei Corona-Infektionen von Haustieren. Presse- und Informationsamt der Bundesregierung, 2. Juli 2020, abgerufen am 1. November 2020.
- ↑ Epidemiegesetz 1950. Bundesrecht konsolidiert, Gesamte Rechtsvorschrift. In: RIS. 14. Juni 2018, abgerufen am 6. März 2020: „Der Anzeigepflicht unterliegen: […] (2) Der Bundesminister für Gesundheit und Frauen kann, […], durch Verordnung weitere übertragbare Krankheiten der Meldepflicht unterwerfen oder bestehende Meldepflichten erweitern.“
- ↑ 15. Verordnung des Bundesministers für Arbeit, Soziales, Gesundheit und Konsumentenschutz betreffend anzeigepflichtige übertragbare Krankheiten 2020. In: Bundesgesetzblatt für die Republik Österreich. 26. Januar 2020, abgerufen am 4. März 2020: „Der Anzeigepflicht nach dem Epidemiegesetz1950 unterliegen Verdachts-, Erkrankungs- und Todesfälle an 2019-nCoV (‚2019 neuartiges Coronavirus‘).“
- ↑ COVID-19 (SARS-CoV-2). Abgerufen am 10. April 2024.
- ↑ Bundesgesetz über die Bekämpfung übertragbarer Krankheiten des Menschen. Epidemiengesetz, EpG. Bundeskanzlei, 1. Januar 2017, abgerufen am 6. März 2020: „Art. 13 Regelung der Meldungen“
- ↑ Verordnung über die Bekämpfung übertragbarer Krankheiten des Menschen. (Epidemienverordnung, EpV) vom 29. April 2015 (Stand am 1. Juli 2024). Bundeskanzlei, abgerufen am 5. Oktober 2024: „Art. 19 Weiterführende Regelungen durch das EDI“
- ↑ Verordnung des EDI über die Meldung von Beobachtungen übertragbarer Krankheiten des Menschen. vom 1. Dezember 2015 (Stand am 1. Januar 2024). Bundeskanzlei, abgerufen am 5. Oktober 2024: „31a Sars-CoV-2“
- ↑ Abwassersurveillance AMELAG - Wochenbericht. Robert Koch-Institut, Umweltbundesamt, abgerufen am 28. Oktober 2025.
- ↑ ICD-10 (WHO und GM): U07.1 kodiert COVID-19, Coronavirus-Krankheit-2019. Deutsches Institut für Medizinische Dokumentation und Information (DIMDI), 17. Februar 2020, archiviert vom (nicht mehr online verfügbar) am 15. Mai 2020; abgerufen am 14. Mai 2020.
- ↑ Antworten auf häufig gestellte Fragen zum Coronavirus SARS-CoV-2. In: Website des Robert Koch-Instituts. 26. März 2020, archiviert vom (nicht mehr online verfügbar) am 19. März 2020; abgerufen am 27. März 2020.
- ↑ ICD-10 (WHO und GM): U07.2 kodiert Verdacht auf COVID-19. In: dimdi.de. Deutsches Institut für Medizinische Dokumentation und Information, 23. März 2020, archiviert vom (nicht mehr online verfügbar) am 3. August 2020; abgerufen am 14. August 2020.
- ↑ ICD-10-GM 2020: Neuer U-Kode U99.0! und neue Kodierfrage zu Testung auf SARS-CoV-2. DIMDI, 25. Mai 2020, archiviert vom (nicht mehr online verfügbar) am 25. Mai 2020; abgerufen am 27. Mai 2020.
- ↑ Ist U07.2! bei Personen zu kodieren, bei denen kein Verdacht auf eine Infektion mit SARS-CoV-2 besteht, jedoch ein Test auf SARS-CoV-2 durchgeführt wurde, welcher negativ ausfällt? (ICD-10-GM Nr. 1019). DIMDI, abgerufen am 27. Mai 2020.
- ↑ ICD-10-GM 2020: Weitere neue U-Kodes im Zusammenhang mit COVID-19 publiziert. Archiviert vom (nicht mehr online verfügbar) am 24. Januar 2021; abgerufen am 18. Januar 2021.
- ↑ Bundesamt für Statistik: Offizielle Kommunikation 2021 Nr. 1 – Kodierung COVID-19 – Anzuwenden bei Fällen mit Austrittsdatum ab 1. Januar 2021 | Publikation. 3. Dezember 2020, abgerufen am 18. Januar 2021.
- ↑ ICD-10-GM 2021: Neue U-Kodes im Zusammenhang mit Impfungen gegen COVID-19 publiziert. Archiviert vom (nicht mehr online verfügbar) am 24. April 2021; abgerufen am 24. April 2021.
- ↑ Berufsgenossenschaft Rohstoffe und chemische Industrie: Informationen zu dem neuen Coronavirus (SARS-CoV-2). bgrci.de, archiviert vom (nicht mehr online verfügbar) am 8. April 2020; abgerufen am 31. März 2020.
Auf dieser Seite verwendete Medien
Pharynx
Autor/Urheber:
The original poster is made in Russian by meduza.io: Meduza uses CC-BY for all coronavirus-related materials and explicitly invites people to make use of it: "Все материалы «Медузы» о коронавирусе открыты для распространения по лицензии Creative Commons CC BY. Вы можете их перепечатать! На фотографии лицензия не распространяется." I have an explicit confirmation by Meduza by email to make sure that this poster is also under CC-BY. (subsequently, they linked to our translations as well: https://t.me/meduzalive/24784)
The translations of the text for the posters is done by tens of crowd sourced native speakers which will be added separately for every poster. Everyone aggreed to CC-BY4.0.
The compilation and editing of the posters is done by me, Pesho Ivanov., Lizenz: CC BY 4.0Poster about sneezing and coughing correctly. Recommendations are based on the Centers for Disease Control and Prevention, US
Autor/Urheber: Partynia, Lizenz: CC BY-SA 4.0
COVID-19-Test auf Antikörper IgG und IgM
Autor/Urheber: Treck08, Lizenz: CC BY-SA 4.0
Throat swab: Green Spring SARS-CoV-2 Antigen Rapid Test Kit (Colloidal Gold), the same test: After 15 minutes (left), after 30 minutes (right). Attention: There's a light line on the left, too. So the test is positive, too.
Autor/Urheber: 3sat/nano/Raketenfilm/Andreas Gust/Konstantin Fuchs, Lizenz: CC BY 4.0
PCR steht für “Polymerase Chain Reaction”. Es ist eine Methode um Erbsubstanz gezielt aufzuspüren und zu vervielfältigen. Im Prinzip ähnlich wie ein Kopierer. Damit der Kopierer weiß, was er vervielfältigen soll braucht er eine geeignete Vorlage – eine unverwechselbare DNA-Sequenz des Virus. Solche typischen Stellen im Erbgut von Sars-CoV-2 sind bekannt. Mit Hilfe eines Werkzeugs: einem sogenannten „Primer“ der vorab für die Suche nach genau diesen Stellen synthetisiert wurde, wird diese Sequenz in der Probe aufgespürt.
Mann beim Niesen. Übersetzung der originalen Bildunterschrift des CDC: „Dieses Foto aus dem Jahr 2009 hat den Vorgang des Niesens eingefangen. Es macht den ausgedehnten, aus Speicheltröpfchen bestehenden Schwaden sichtbar, der kegelförmig aus dem offenen Mund eines Mannes ausgestoßen wird, und veranschaulicht eindrücklich, warum man seinen Mund beim Husten oder Niesen bedecken muss, um andere vor Keimexposition zu schützen.“
Autor/Urheber: Colin D. Funk, Craig Laferrière, and Ali Ardakani. Graphic by Ian Dennis - http://www.iandennisgraphics.com, Lizenz: CC BY 4.0
Übertragung und Lebenszyklus von SARS-CoV-2 verursachen COVID-19. SARS-CoV-2 wird über Atemtröpfchen infizierter Fälle auf Mund- und Atemschleimhautzellen übertragen. Das Virus, das ein einzelsträngiges RNA-Genom besitzt, das in Nucleocapsid (N) -Protein und drei Hauptoberflächenproteine eingewickelt ist: Membran (M), Hülle (E) und Spike, repliziert und gelangt in die unteren Atemwege, was möglicherweise zu einer schweren Lungenentzündung führt. Das Tor zum Eintritt in die Wirtszelle (vergrößerte Ansicht) erfolgt über die Wechselwirkung des Spike-Converting-Enzyms 2 (ACE2) mit der Spaltung von Spike im Präfusionszustand durch die Proteasen TMPRSS-2/furin. Eine vereinfachte Darstellung des Lebenszyklus des Virus wird zusammen mit möglichen ausgelösten Immunantworten gezeigt.
Autor/Urheber: SCNAT, Lizenz: CC BY-SA 4.0
Gegen das Coronavirus kommen neuartige Impfstoffe zum Einsatz. Dieses Video zeigt, wie die Impfung mit einem mRNA-Impfstoff funktioniert.
Autor/Urheber: SCNAT, Lizenz: CC BY-SA 4.0
Gegen das Coronavirus kommen neuartige Impfstoffe zum Einsatz. Dieses Video zeigt, wie die Impfung mit einem Vektorimpfstoff funktioniert.
Autor/Urheber: Hellerhoff, Lizenz: CC BY-SA 3.0
Röntgenbild (Bettlunge) einer COVID-19-Pneumonie. Zu diesem Fall sind auch CT-Bilder vorhanden. Siehe COVID-19 pneumonia - case 001.
Autor/Urheber: Alexey Solodovnikov (Idea, Producer, CG, Editor), Valeria Arkhipova (Scientific Сonsultant), Lizenz: CC BY-SA 4.0
Coronavirus. SARS-CoV-2.
Science consultant - Valerya Arkhipova.
- Protein Data Bank:
- 2mls membrane bilayers
- 6y3y Human Coronavirus HKU1 Haemagglutinin-Esterase
- 5x29 E protein pentameric ion channel
- 6yyt replicating SARS-CoV-2 polymerase
- Charmm-gui:
- 6vsb_1_1_1_S309 protein spike
- 1. Surya, W., Li, Y., Torres, J. Structural model of the SARS coronavirus E channel in LMPG micelles. // Biochim. Biophys. Acta - Biomembr. – 2018. – Vol. 1860. – N. 6. – P. 1309–1317.
- 2. Koppisetti, R. K., Fulcher, Y. G., Jurkevich, A., Prior, S. H., Xu, J., Lenoir, M., Overduin, M., Van Doren, S. R. Ambidextrous binding of cell and membrane bilayers by soluble matrix metalloproteinase-12. // Nat. Commun. – 2014. – Vol. 5. – P. 1–14.
- 3. Hillen, H. S., Kokic, G., Farnung, L., Dienemann, C., Tegunov, D., Cramer, P. Structure of replicating SARS-CoV-2 polymerase. // Nature. – 2020. – Vol. 584. – N. 7819. – P. 154–156.
- 4. Harris, L. J., Larson, S. B., Hasel, K. W., McPherson, A. Refined structure of an intact IgG2a monoclonal antibody. // Biochemistry. – 1997. – Vol. 36. – N. 7. – P. 1581–1597.
- 5. Noreng, S., Bharadwaj, A., Posert, R., Yoshioka, C., Baconguis, I. Structure of the human epithelial sodium channel by cryo-electron microscopy. // Elife. – 2018. – Vol. 7. – P. 1–23.
- 6. Almond, A., DeAngelis, P. L., Blundell, C. D. Hyaluronan: The Local Solution Conformation Determined by NMR and Computer Modeling is Close to a Contracted Left-handed 4-Fold Helix. // J. Mol. Biol. – 2006. – Vol. 358. – N. 5. – P. 1256–1269.
- 7. Hurdiss, D. L., Drulyte, I., Lang, Y., Shamorkina, T. M., Pronker, M. F., van Kuppeveld, F. J. M., Snijder, J., de Groot, R. J. Cryo-EM structure of coronavirus-HKU1 haemagglutinin esterase reveals architectural changes arising from prolonged circulation in humans. // Nat. Commun. – 2020. – Vol. 11. – N. 1. – P. 1–10.
- 8. Yan, Renhong, Yuanyuan Zhang, Yaning Li, Lu Xia, Yingying Guo, Q. Z. Structural basis for the recognition of SARS-CoV-2 by full-length human ACE2. // Science (80-. ). – 2020. – Vol. 3. – N. 3. – P. 1–8.
- 9. Javitt, G., Khmelnitsky, L., Albert, L., Bigman, L. S., Elad, N., Morgenstern, D., Ilani, T., Levy, Y., Diskin, R., Fass, D. Assembly Mechanism of Mucin and von Willebrand Factor Polymers. // Cell. – 2020. – Vol. 183. – N. 3. – P. 717-729.e16.
- 10. Daniel Wrapp, Nianshuang Wang, Kizzmekia S. Corbett, Jory A. Goldsmith, Ching-Lin Hsieh, Olubukola Abiona, B. S. G., McLellan, and J. S. Cryo-EM structure of the 2019-nCoV spike in the prefusion conformation. // Science (80-. ). – 2020. – Vol. 21. – N. 1. – P. 1–9.
- 11. Wang, M. Y., Zhao, R., Gao, L. J., Gao, X. F., Wang, D. P., Cao, J. M. SARS-CoV-2: Structure, Biology, and Structure-Based Therapeutics Development. // Front. Cell. Infect. Microbiol. – 2020. – Vol. 10. – N. November. – P. 1–17.
- 12. Yao, H., Song, Y., Chen, Y., Wu, N., Xu, J., Sun, C., Zhang, J., Weng, T., Zhang, Z., Wu, Z., Cheng, L., Shi, D., Lu, X., Lei, J., Crispin, M., Shi, Y., Li, L., Li, S. Molecular Architecture of the SARS-CoV-2 Virus. // Cell. – 2020. – Vol. 183. – N. 3. – P. 730-738.e13.
Autor/Urheber: Jin, Y., Cai, L., Cheng, Z. et al., Lizenz: CC BY 4.0
CT imaging of rapid progression stage. A 50 years old female with anorexia, fatigue, muscle soreness, nasal congestion and runny nose for 1 week, sore and itching throat for 2 days. Laboratory test: increased erythrocyte sedimentation rate (25 mm/h), normal white blood cells (4.08 × 109/L), decreased lymphocytes (0.96 × 109/ L), increased C-reaction protein (60.8 mg/L). Imaging examination: a (thin layer CT) and b (high-resolution CT) showed multiple patchy and light consolidation in both lungs and grid-like thickness of interlobular septa
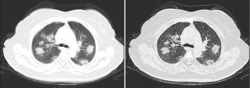
Autor/Urheber: Jin, Y., Cai, L., Cheng, Z. et al. , for the Zhongnan Hospital of Wuhan University Novel Coronavirus Management and Research Team, Evidence-Based Medicine Chapter of China International Exchange and Promotive Association for Medical and Health Care (CPAM), Lizenz: CC BY 4.0
Typical CT imaging manifestation (case 1). A 38 years old male with fever without obvious inducement (39.3 ℃), dry cough and shortness of breath for 3 days. Laboratory test: normal white blood cells (6.35 × 109/L), decreased lymphocytes percentage (4.1%), decreased lymphocytes count (0.31 × 109/L), decreased eosinophil count (0 × 109/L)), increased C-reaction protein (170.91 mg/L), increased procalcitonin (0.45 ng/ml). Imaging examination: multiple patches, grid-like lobule and thickening of interlobular septa, typical "paving stone–like" signs. a SL(Slice): 6 mm; b high-resolution computed tomography(HRCT). HRCT. high-resolution computed tomography












