Boscalid
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Boscalid | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C18H12Cl2N2O | |||||||||||||||||||||
| Kurzbeschreibung | weißer, kristalliner oder pulveriger[1] Feststoff | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 343,21 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand | fest | |||||||||||||||||||||
| Dichte | 1,394 g·cm−3[1] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt | zersetzt sich vor dem Sieden bei 300 °C[2] | |||||||||||||||||||||
| Löslichkeit |
| |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | > 2000 mg·kg−1 (LD50, Ratte, transdermal)[4] | |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Boscalid ist ein Fungizid aus der Gruppe der Carbonsäureamide. Es wurde von BASF entwickelt und kam 2003 auf den Markt. In reiner Form bildet es farb- und geruchlose Kristalle.[1]
Geschichte

Boscalid basiert auf dem 50 Jahre früher eingeführten Fungizid Carboxin.
Verwendung
Boscalid wird vor allem im Obst-, Gemüse- und Weinbau verwendet.[5][1][3][6] Die Anwendung im Erdbeeranbau kann zu einem Verlust an Aroma und Geschmack der Früchte führen.[7]
Boscalid war das erste Fungizid aus der Wirkstoffklasse der Succinat-Dehydrogenase-Hemmer, das Ascomyceten im Obst- und Gemüseanbau bekämpfen konnte.[8]
Boscalid wurde bereits 2005 in den USA zur Bekämpfung von Botrytis cinerea in Form des Pflanzenschutzmittels Pristine eingesetzt. Bei Pristine handelt es sich um ein Fungizidgemisch aus Boscalid und Pyraclostrobin, welches ebenfalls von der Firma BASF entwickelt wurde.[9]
Synthese
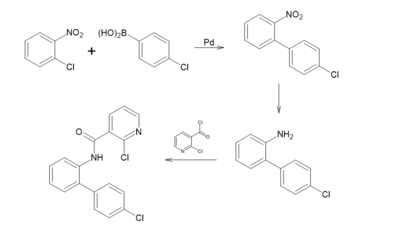
Industriell werden über 1.000 t von Boscalid pro Jahr hergestellt. Der meist verwendete Syntheseweg besteht aus einer dreistufigen Totalsynthese. Im ersten Schritt findet eine Suzuki-Kupplung von 2-Chlornitrobenzol und Benzolboronsäure in Anwesenheit von Palladium(II)-acetat und Triphenylphosphan statt. Im nächsten Schritt wird die Nitrogruppe des Biphenylderivats zu einer Aminogruppe reduziert. Im letzten Schritt reagiert diese mit 2-Chlornicotinsäurechlorid in einer Acylierung zu Boscalid.[10]
Toxikologie
Boscalid hat eine niedrige Giftwirkung bei Einnahme, Einatmen oder Aufnahme über die Haut. In Fütterungsstudien an Ratten, Mäusen und Hunden wurden zuerst Abnahmen des Körpergewichtes sowie Effekte auf Leber und Schilddrüse festgestellt.[11]
Toxikologische Daten:[3]
- erlaubte Tagesdosis 0,04 mg/kg bw
- annehmbare Anwenderexposition (AOEL) 0,1 mg/kg bw/d
- akute Referenzdosis (ARfD) nicht erforderlich
Abbau
Boscalid wird im Boden nur langsam abgebaut, die DT90-Zeit beträgt über 1 Jahr. Der Wirkstoff kann sich also potentiell im Boden anreichern.[12]
Karzinogenität
Eine Karzinogenität wird von der US-amerikanischen Umweltbehörde (EPA) zwar eingeräumt, allerdings wird das krebserregende Potenzial für den Menschen als ungefährlich eingestuft.[1]
Rückstände
Lebensmittelbelastungen mit bis zu 59 % der erlaubten Tagesdosis (ADI) an Boscalid wurden auf handelsüblichem Gemüse (Rauke und Kopfsalat) von Greenpeace nachgewiesen.[13]
In der Schweiz gilt für Fenchel und Stangensellerie ein relativ hoher Rückstandshöchstgehalt von 30 Milligramm Boscalid pro Kilogramm.[14]
Umweltbelastung
Boscalid ist eine langlebige Verbindung und wird in großen Mengen (mehrere hundert Tonnen pro Jahr)[5] eingesetzt. Dennoch erwartet die EPA wegen der geringen Mobilität von Boscalid im Erdboden nur geringe Umweltbelastungen. Es kann aber durch Verwehung während des Ausbringens und durch Bodenerosion in Grund- und Oberflächengewässer gelangen. Wegen der saisonalen Anwendung erwartete die EPA nur relativ geringe Belastungen in Gewässern. Wird Boscalid im Rahmen der vorgeschriebenen Grenzen und nur für die beantragten Zwecke eingesetzt, ist Boscalid nach der EPA nur von geringem Risiko für die Umwelt.[1]
Eine deutliche Belastung in Oberflächengewässern wurde in Rheinland-Pfalz nachgewiesen. In einem zwischen 2008 und 2009 durchgeführten Messprogramm eines rheinland-pfälschen Landesamtes ist Boscalid das am häufigsten nachgewiesene Fungizid. Es wurde in 12 von 24 untersuchten Fließgewässern in jeder Probe nachgewiesen. Mit fünf gemessenen Jahresmitteln über > 0,1 μg/l ist es nach Dimethomorph auf Platz zwei der untersuchten Pestizide.[5] In Mecklenburg-Vorpommern ist Boscalid in einem Sondermessprogramm gegenüber anderen Pestiziden nicht auffällig häufiger nachgewiesen worden.[6]
Erntequalität
Speziell bei Erdbeeren wurde festgestellt, dass die Verwendung des Fungizids die Anteile an löslichem Zucker sowie an Nährstoffen in Erdbeeren reduziert und dafür den Anteil an Säuren erhöht. Dies kann die geschmackliche Qualität der Erdbeeren negativ beeinflussen. Andererseits kann dieses Wissen auch zur Forschung an einer verbesserten Geschmacksqualität genutzt werden.[15]
Zulassung
In einer Reihe von EU-Staaten, unter anderem Deutschland und Österreich sowie der Schweiz sind Pflanzenschutzmittel mit Boscalid als Wirkstoff (z. B. Cantus) zugelassen.[16]
Einzelnachweise
- ↑ a b c d e f g US EPA: US EPA - Pesticides - Fact Sheet for Boscalid. In: www3.epa.gov. Juli 2003, abgerufen am 19. März 2023 (englisch).
- ↑ Eintrag zu Boscalid in der Pesticide Properties DataBase (PPDB) der University of Hertfordshire, abgerufen am 29. April 2022.
- ↑ a b c d e f Bundesamt für Verbraucherschutz und Lebensmittelsicherheit (Hrsg.): Boscalid (Nicofibren), Wirkstoff-Nr. 1023-1, abgerufen am 26. November 2011.
- ↑ a b c Datenblatt Boscalid bei Sigma-Aldrich, abgerufen am 29. April 2022 (PDF).
- ↑ a b c Landesamt für Umwelt, Wasserwirtschaft und Gewerbeaufsicht (Hrsg.):PSM-wirkstoffe in Oberflächengewässern, Ergebnisse und Bewertungen der Messprogramme 2008/2009 ( vom 22. Februar 2014 im Internet Archive), 7/2010, abgerufen am 11. Dezember 2011.
- ↑ a b Landesamt für Umwelt, Naturschutz und Geologie Mecklenburg-Vorpommern (Hrsg.): Sonderbericht über Pflanzenschutz- und Arzneimittelbefunde in Oberflächengewässern und im Grundwasser Mecklenburg-Vorpommerns im Frühjahr 2008 (PDF; 2,8 MB), abgerufen am 11. Dezember 2011.
- ↑ Yuping Liu, Rui Liu, Yue Deng, Meiling Zheng, Simin Yu, Yufan Nie, Jia-Qi Li, Canping Pan, Zhiqiang Zhou, Jinling Diao: Insights into the Mechanism of Flavor Loss in Strawberries Induced by Two Fungicides Integrating Transcriptome and Metabolome Analysis in J. Agric. Food Chem. 71 (2023) 3906–3919, doi:10.1021/acs.jafc.2c08157.
- ↑ Wolfgang Krämer, Ulrich Schirmer, Peter Jeschke, Matthias Witschel: Modern Crop Protection Compounds: Herbicides, Band 1. Wiley-VCH, 2011, ISBN 978-3-527-32965-6, S. 1231 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Y. N. Yin, Y. K. Kim, C. L. Xiao: Molecular Characterization of Boscalid Resistance in Field Isolates of Botrytis cinerea from Apple. In: Phytopathology®. Band 101, Nr. 8, August 2011, S. 986–995, doi:10.1094/phyto-01-11-0016.
- ↑ Balaram S. Takale, Ruchita R. Thakore, Rushil Mallarapu, Fabrice Gallou, Bruce H. Lipshutz: A Sustainable 1-Pot, 3-Step Synthesis of Boscalid Using Part per Million Level Pd Catalysis in Water. In: Organic Process Research & Development. Band 24, Nr. 1, 17. Januar 2020, S. 101–105, doi:10.1021/acs.oprd.9b00455 (nsf.gov [abgerufen am 20. Juli 2023]).
- ↑ Eintrag zu Boscalid in der Hazardous Substances Data Bank (via PubChem), abgerufen am 11. Dezember 2011.
- ↑ Zulassungsbericht Signum
- ↑ Greenpeace (Hrsg.):Pestizide in Kopfsalat und Rucola ( vom 11. Februar 2016 im Internet Archive) (PDF; 375 kB), Februar 2010.
- ↑ Verordnung des EDI über die Höchstgehalte für Pestizidrückstände in oder auf Erzeugnissen pflanzlicher und tierischer Herkunft. In: admin.ch. Abgerufen am 6. Februar 2020.
- ↑ Yuping Liu, Rui Liu, Yue Deng, Meiling Zheng, Simin Yu, Yufan Nie, Jia-Qi Li, Canping Pan, Zhiqiang Zhou, and Jinling Diao. J. Agric. Food Chem. 2023, 71, 8, 3906–3919, 2023, doi:10.1021/acs.jafc.2c08157.
- ↑ Generaldirektion Gesundheit und Lebensmittelsicherheit der Europäischen Kommission: Eintrag zu Boscalid (formerly nicobifen) in der EU-Pestiziddatenbank; Eintrag in den nationalen Pflanzenschutzmittelverzeichnissen der Schweiz, Österreichs (Eingabe von „Boscalid“ im Feld „Wirkstoff“) und Deutschlands, abgerufen am 17. Februar 2016.
Auf dieser Seite verwendete Medien
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
Autor/Urheber: LhDa23, Lizenz: CC BY-SA 4.0
Synthese von Boscalid ausghend von 2-Chloronitrobenzol und Benzolboronsäure
Strukturformel von Boscalid
Strukturformel von Carboxin




