Blutversorgung des Gehirns

(Ansicht von unten, der rechte Schläfenlappen wurde teilweise entfernt)

Die Blutversorgung des Gehirns ist der Teil des Blutkreislaufes, der dem Gehirn Sauerstoff, Glucose und andere Nährstoffe zuführt und Stoffwechselprodukte sowie Kohlenstoffdioxid abtransportiert. Sie unterliegt einigen anatomischen und physiologischen Besonderheiten. Grund hierfür ist, dass das Organ Gehirn einen sehr hohen basalen Stoffwechsel aufweist – das menschliche Gehirn beansprucht bereits in Ruhe ein Fünftel des gesamten Sauerstoffbedarfs des Körpers. Außerdem sind Nervenzellen anders als andere Körperzellen nicht in der Lage, ihren Energiebedarf in ausreichendem Maße ohne Sauerstoff, also anaerob, zu decken. Zur Sicherung der kontinuierlichen Sauerstoff- und Substratversorgung gibt es daher mehrere Sicherheitssysteme.
Vier große Schlagadern versorgen das Gehirn des Menschen und der meisten Säugetiere mit sauerstoffreichem Blut (alte Bezeichnung: „arterielles Blut“). Je zwei liegen auf jeder Seite des Halses, vorn die inneren Halsschlagadern (Arteriae carotides internae) und hinten die Wirbelarterien (Arteriae vertebrales). Das Blut fließt nach der Passage des Gehirns über besondere venöse Hirnblutleiter (Sinus durae matris) ab, die gegenüber den Venen einige Besonderheiten aufweisen.
Grundlagen
Das Blutvolumen je 100 ml Hirnsubstanz liegt in Ruhe bei knapp 4 ml. Der normale Blutfluss im Hirngewebe beträgt beim Menschen zwischen 40 und 50 ml Blut pro 100 g Gewebe pro Minute.[1] In der grauen Substanz ist er deutlich höher (90 ml/100 g/min) als in der weißen Substanz (25 ml/100 g/min).[2] Ein Abfall der Durchblutungsrate auf die Hälfte kann noch ohne weiteres kompensiert werden (unter anderem durch höhere Sauerstoffausschöpfung). Ein Abfall unter 20 ml/100 g/min führt jedoch zu zunächst reversiblen Ausfallerscheinungen. Wenn die Durchblutungsrate auf weniger als 15 ml/100 g/min sinkt, tritt binnen einiger Minuten bis einiger Stunden ein allmählicher Zelluntergang ein. Weniger als 10 ml/100 g/min werden von den Nervenzellen nicht toleriert – es kommt binnen acht bis zehn Minuten zum endgültigen Zelluntergang.[3]
Anatomie
Im Folgenden wird – wenn nicht explizit anders benannt – die anatomische Situation beim Menschen beschrieben.
- Für den prinzipiellen Aufbau des Kreislaufsystems siehe Hauptartikel: Blutkreislauf und Blut
Zuflüsse

Es ist üblich, bei den Zuflüssen einen vorderen und einen hinteren Kreislauf zu unterscheiden, auch wenn es Verbindungen zwischen beiden gibt, sogenannte Anastomosen.
Vorderer Kreislauf
Den Hauptbeitrag zum arteriellen Zustrom tragen die rechte und linke innere Halsschlagader (Arteria carotis interna dextra et sinistra), die aus der gemeinsamen Halsschlagader (Arteria carotis communis dextra et sinistra) jeder Halsseite entspringen. Die Halsschlagader wiederum ist einer der großen Abgänge aus dem Aortenbogen. Ihr Puls kann leicht vor dem Kopfwendermuskel (Musculus sternocleidomastoideus) getastet werden.
Nach dem Eintritt in den Schädel durch den Canalis caroticus zweigt aus der Arteria carotis interna jeder Seite ein Gefäß zum Auge (Arteria ophthalmica) ab. Nach Abgabe weiterer kleinerer Äste teilt sie sich in die Hauptstämme des vorderen Kreislaufs, die mittlere Hirnarterie (Arteria cerebri media) und die vordere Hirnarterie (Arteria cerebri anterior, bei Tieren als Arteria cerebri rostralis bezeichnet). Erstere versorgt die seitlichen (lateralen), letztere die der Mitte zugewandten (medialen) Teile der jeweiligen Großhirnhemisphäre mit Ausnahme von Teilen des Temporallappens und des gesamten Occipitallappens, die vom hinteren Kreislauf gespeist werden. Die tiefen Kerngebiete (Basalganglien, Thalamus) haben eine gemischte Versorgung. Die beiden vorderen Hirnarterien sind durch die sehr kurze Arteria communicans anterior miteinander verbunden.
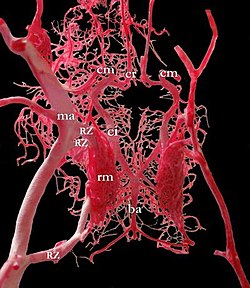
Anders ist die Situation bei Wiederkäuern: Hier verschließt sich der außerhalb der Schädelhöhle liegende Abschnitt der Arteria carotis interna nach der Geburt und nur der innerhalb des Schädels liegende Teil bleibt offen. Dieser bekommt dann sekundär seine Blutzufuhr aus der Oberkieferarterie (Arteria maxillaris). Im Mündungsbereich dieser zuführenden Äste bildet sich ein feines, weitverzweigtes Netz aus kleineren Gefäßen aus, das die Anatomen Wundernetz (Rete mirabile) nennen. Auch bei ausgewachsenen Katzen verschließt sich der außerhalb der Schädelhöhle befindliche Teil der inneren Halsschlagader. Hier bildet die Oberkieferarterie selbst ein Wundernetz (Rete mirabile arteriae maxillaris) von dem mehrere Äste (Rami retis) durch die Fissura orbitalis in die Schädelhöhle ziehen und die Blutzufuhr zum vorderen Kreislauf übernehmen.[4]
Hinterer Kreislauf
Die rechte und linke Wirbelarterie (Arteria vertebralis dextra et sinistra), die aus den Schlüsselbein-Schlagadern (Arteria subclavia) entspringen und entlang der Halswirbelsäule verlaufen, haben einen geringeren Durchmesser als die Halsschlagadern. Sie treten dabei durch Öffnungen der Querfortsätze der oberen sechs Halswirbel. Die beiden Wirbelarterien gelangen durch das Foramen magnum in die Schädelhöhle und vereinigen sich auf Höhe der kaudalen Brücke zur unpaaren Arteria basilaris.
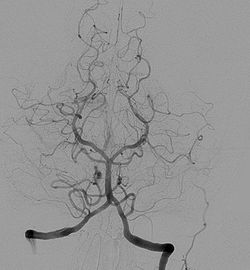
Die Wirbelarterien in ihren Endsegmenten und die Arteria basilaris entsenden Äste zum Hirnstamm und Kleinhirn (A. cerebelli inferior posterior, A. cerebelli inferior anterior, A. cerebelli superior). Oberhalb der Brücke teilt sich die Arteria basilaris abermals und wird zu den beiden hinteren Hirnarterien, die sich in die Arteriae occipitales medialis bzw. lateralis teilen und die hinteren Bezirke des Großhirns sowie Teile des Zwischenhirns versorgen. Eine individuell unterschiedlich stark angelegte Arteria communicans posterior verbindet die hintere Hirnarterie jeder Seite mit der inneren Halsschlagader.
 | 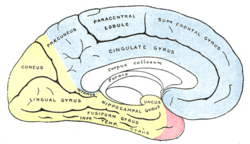 | Versorgungsgebiete der Großhirnrinde: Arteria cerebri anterior (blau unterlegt) |
Varietäten
Etwa ein Drittel der Normalbevölkerung zeigt Abweichungen im individuellen Verlauf der beschriebenen Gefäße von diesem „Lehrbuchfall“: Sehr häufig sind eine oder mehrere Aa. communicantes hypoplastisch. Auch der Stamm der A. cerebri anterior kann hypoplastisch sein, in dem Fall übernimmt das Gefäß der Gegenseite über die A. communicans anterior die Versorgung.[5] Als embryonaler Versorgungstyp wird der ein- oder beidseitige Abgang der A. cerebri posterior aus dem Karotisgebiet bezeichnet, wobei dann die A. communicans posterior dessen erste Strecke bildet und das Gefäßbett des Großhirns im letzteren Fall vollständig über den vorderen Kreislauf gespeist wird. Viele Personen haben eine einseitig schwach oder gar nicht angelegte Wirbelarterie.
Diese Varianten sind an sich ohne Krankheitswert und werden beim Gesunden voll kompensiert, können aber im Einzelfall ein Risikofaktor für den Schlaganfall sein.[6] Selten kommen auch zusätzliche Gefäße vor, wie eine Arteria cerebri media accessoria[7] oder Überbleibsel embryonaler Anastomosen, zum Beispiel als Arteria trigeminalis.
Verbindungen zwischen vorderem und hinterem Kreislauf
Die Arteria communicans anterior, der erste Abschnitt der Arteria cerebri anterior, ein kurzer Abschnitt der Arteria carotis interna, die Arteria communicans posterior und das erste Teilstück der Arteria cerebri posterior bilden, beide Seiten zusammen betrachtet, eine ringförmige Verbindung unter der Hirnbasis aus (Circulus arteriosus cerebri Willisi). Dieser Gefäßring stellt ein Anastomosensystem dar, das die Stromgebiete der Arteriae carotides internae und der Arteria basilaris anatomisch, aber funktionell nicht immer ausreichend miteinander verbindet. Grundsätzlich (das heißt bei ausreichender Adaptationszeit) kann er jedoch ermöglichen, dass ein einziges Hauptgefäß die gesamte Durchblutung des Gehirns aufrechterhält.
Kapillarbett
Die Kapillaren des Gehirns bilden dadurch, dass die Endothelzellen mit tight junctions fest miteinander verbunden sind, eine für größere Moleküle undurchlässige (impermeable) Barriere, die Blut-Hirn-Schranke. Zu dieser tragen in geringerem Umfang auch die Basalmembran und der lückenlose Besatz der Kapillaren mit Astrozytenausläufern bei. Die Blut-Hirn-Schranke schützt das Gehirn vor potenziell schädlichen, im Blut zirkulierenden Substanzen.
Die Kapillardichte ist in den einzelnen Regionen des Gehirns unterschiedlich und entspricht in der Regel ziemlich genau der mittleren Stoffwechselaktivität des jeweiligen Gebietes. Anders als im sonstigen Körper sind die Haargefäße des Gehirns immer komplett geflutet; eine Reservekapazität besteht nicht.[8]
Abflüsse

Das Gehirn besitzt kleine Venolen und Venen wie andere Organe auch, die jedoch unabhängig von den Arterien verlaufen. Sie werden in eine tiefe (Venae profundae cerebri) und eine oberflächliche (Venae superficiales cerebri) Gruppe unterteilt. Die größte Hirnvene ist die nur etwa 1 cm lange Vena magna cerebri (Galeni) unter dem Splenium des Balkens. Das sauerstoffarme Blut wird in anatomisch besonders gebauten Hirnblutleitern, den Sinus durae matris gesammelt: Dabei handelt es sich um Duplikaturen der harten Hirnhaut, die auf der Innenseite mit Endothel ausgekleidet sind. Die Sinus bilden ein miteinander verbundenes System und münden schließlich in die inneren Drosselvenen.
Embryonale Entwicklung
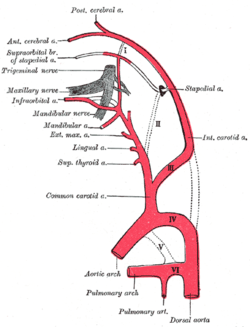
Embryonal entstehen zunächst die paarige Aorta dorsalis und die ebenfalls paarige Aorta ventralis, die durch sechs Kiemenbogenarterien miteinander verbunden sind. In der weiteren Entwicklung werden einzelne Gefäßabschnitte zurückgebildet, andere verstärken sich deutlich. So bildet die linke vierte Kiemenbogenarterie den Aortenbogen, die ventrale Aorta zwischen dritter und vierter Kiemenbogenarterie die Arteria carotis communis, weiter rostal die Arteria carotis externa und ihre Äste. Die dritte Kiemenbogenarterie wird zum ersten Abschnitt der Arteria carotis interna, die sich in der dorsalen Aorta fortsetzt. Der Abschnitt der Aorta dorsalis zwischen dritter und vierter Kiemenbogenarterie hingegen wird zurückgebildet (siehe nebenstehende Abbildung). Die primitive Arteria carotis interna teilt sich an der Anlage des späteren Gehirns in einen kranialen und einen kaudalen Ast. Ersterer bildet zunächst um die 4. Embryonalwoche die Arteria cerebri anterior und die Arteria choroidea anterior, erst um die 9. Woche entsteht aus einem von mehreren Seitenästen die später viel stärkere Arteria cerebri media. Der kaudale Ast entsendet segmentale Arterien zum Neuralrohr, aus denen sich unter anderem die Kleinhirnarterien ableiten. Um die 7. Embryonalwoche entsteht aus diesem Ast auch die Arteria cerebri posterior. Etwa um dieselbe Zeit verschmelzen die beiden Abschnitte des kaudalen Astes vor dem Hirnstamm und bilden die unpaare Arteria basilaris. Die Wirbelarterien bilden sich aus der Fusion von kleineren longitudinalen (in Körperlängsrichtung liegenden) Anastomosen zwischen den primitiven segmentalen Arterien der Halsregion. Sie gewinnen eine Verbindung zu der frühen Arteria basilaris. Um die 9. Woche kehrt sich die Flussrichtung in der Basilararterie bis zur Höhe der Arteria cerebri posterior um, so dass sie mit allen Tochtergefäßen nun hämodynamisch zur hinteren Strombahn gehört. Ganz zuletzt bildet sich die Arteria communicans anterior durch partielle Fusion der Arteriae cerebri anteriores.
Physiologie

Eines der „Sicherheitssysteme“ zum Schutz vor zu geringer, aber auch zu hoher Perfusion ist die Autoregulation der Hirndurchblutung. Die Widerstandsgefäße halten den effektiven Blutdruck im Gehirn (den sogenannten Perfusionsdruck, der sich aus der Differenz zwischen dem systemischen Blutdruck und dem intrakraniellen Druck ergibt) durch verschiedene komplex zusammenspielende Steuerungsmechanismen nahezu konstant, während der systemische Blutdruck zwischen 50 und 170 mmHg schwanken kann. Zu diesen gehören der Bayliss-Effekt, die Regulation durch die sympathische und parasympathische Innervation der größeren Gefäße und direkt auf die Myozyten der Glatten Muskulatur wirkende endokrine und chemische Faktoren (pH-Wert, Adenosin, Kalium und weitere). Die Grenzen dieser Anpassung verschieben sich bei dauerhaftem Bluthochdruck nach oben; durch langbestehenden, schlecht eingestellten Diabetes mellitus kann das Autoregulationsvermögen insgesamt gestört sein.[9]
Gehirnareale mit gesteigerter neuronaler Aktivität werden stärker durchblutet.[10] Die Mechanismen dieses als reaktive Hyperämie oder neurovaskuläre Kopplung bezeichneten Phänomens beinhalten die Reaktion der Widerstandsgefäße auf den lokalen Kohlendioxidpartialdruck, weitere vasoaktive Faktoren und die neurogene Steuerung des Vasotonus,[11] sind im Einzelnen aber noch nicht völlig geklärt.
Mess- und Darstellungsmethoden
Die hirnversorgenden Gefäße können mit bildgebenden Verfahren, insbesondere mit der Angiografie dargestellt werden. Für die digitale Subtraktionsangiographie wird ein strahlendichtes Kontrastmittel appliziert; während der Durchleuchtung mit Röntgenstrahlen werden die Skelettanteile herausgerechnet. Somit bilden sich nur die kontrastmitteldurchströmten Gefäße ab.
Eine neuere Methode ist die dreidimensionale Rekonstruktion von Magnetresonanztomographie-Aufnahmen nach Kontrastmittelgabe (MR-Angiographie). Diese verdrängt zunehmend die invasive Angiographie. Es existieren daneben qualitativ unterlegene MR-Sequenzen zur Gefäßbildgebung ohne Kontrastmittel (Time-of-flight-Magnetresonanzangiographie). Genauso ist auch mit der Computertomographie nach Kontrastmittelgabe eine Gefäßdarstellung möglich. Umschriebene Änderungen der Mikrozirkulation sind mit Positronen-Emissions-Tomographie, SPECT und mit einem speziellen (sauerstoffsättigungsgewichtetem) MR-Signal (BOLD-Kontrast) darstellbar. Optische Methoden stützen sich auf die Messung der Konzentrationsänderungen von Hämoglobin. Mit ihnen können nur oberflächennahe Blutflussänderungen gemessen werden.
Die extracranielle Doppler- und Duplexsonographie erlaubt die Beurteilung von Gefäßquerschnitten, Wandveränderungen und Flusseigenschaften in den großen extracraniellen (außerhalb des Schädels gelegenen) Gefäße. Mittels transcranieller Doppler- und Duplexsonographie ist beim Erwachsenen am temporalen „Knochenfenster“ sowie transorbital (durch die Augenhöhle) und transnuchal (über den Nacken) die Messung von Flussgeschwindigkeiten und -profilen ausgewählter intracranieller Gefäße durch die Schädelkalotte beziehungsweise das Foramen magnum hindurch möglich. Im Säuglingsalter ist dies deutlich einfacher und durch die Fontanelle hindurch können die Blutflussparameter bis in die Arteriae cerebri anteriores hinein problemlos untersucht werden.
- Subtraktionsangiographische Darstellung der vertebrobasilären Hirngefäße
- MR-Angiographie der venösen Strombahnen
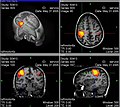
- Funktionelle MRT – stärker durchblutete Areale eingefärbt
- Farbkodierte Duplexsonographie der Arteria carotis communis – unten die Dopplerkurve
Pathologie
Ischämischer Schlaganfall
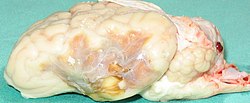
Ein plötzlicher Verschluss eines der oben beschriebenen Gefäße führt in aller Regel zum Schlaganfall, dem schnellen Absterben von Gehirngewebe im jeweiligen Gebiet. Die jeweiligen Ausfälle (neurologische Defizite) können sehr unterschiedlich ausfallen, von diskreten, fast völlig unbemerkten Ausfallerscheinungen bis hin zur Bewusstlosigkeit und zum Tod. Je nach Dauer der Unterbrechung der Blutversorgung und nach Reversibilität der Symptome wird die Transitorische ischämische Attacke (TIA) vom vollständigen Infarkt unterschieden. Bei Verschlüssen im vorderen Kreislauf dominieren Halbseitenlähmungen, Aphasien (Sprachstörungen) und Sensibilitätsstörungen, im hinteren Kreislauf hingegen Gesichtsfeldausfälle, Schwindel, Ataxie (Koordinationsstörung) und Bewusstseinsstörungen. Ursache von ischämischen Infarkten sind in der Regel entweder arteriosklerotische Verengungen der großen zuführenden Gefäße mit späterer Plaqueruptur und Thrombosierung oder die Einschwemmung von Blutgerinnseln (Embolie), die vor allem bei Vorhofflimmern vorkommen kann.
Blutung
Ein anderes Problem ergibt sich, wenn Blutgefäße zerreißen und Blutungen auftreten. Auch hier ist je nach Lokalisation und Ausmaß der Blutung ein weites Spektrum von Symptomen möglich. Auch extrem hoher Blutdruck kann – besonders bei vorgeschädigten Gefäßen – zur Einblutung in das Hirngewebe führen.
Traumatisch bedingte Blutungen betreffen meist den Subdural- oder Epiduralraum. Viele Menschen sind Träger von kleinen Aneurysmata an den Gefäßen der Hirnbasis, ohne je davon zu merken. Die plötzliche Ruptur führt zu dem hochakuten Bild der Subarachnoidalblutung.
Abflussstörung
Auch der Abfluss des Blutes kann gestört sein. Leitsymptome dieser eher chronisch verlaufenden Erkrankungen sind Kopfschmerzen, Antriebsschwäche, Krampfanfälle und Sehstörungen. Zu dieser Gruppe von Störungen gehören die Sinusthrombose, die Hirnvenenthrombose und nach Ansicht mancher Autoren auch der Pseudotumor cerebri.
Kreislaufversagen
Fällt die gesamte Blutzufuhr (zum Beispiel beim Herzstillstand) aus, so tritt im Gehirn ein allgemeiner Sauerstoffmangel, die sogenannte Globalhypoxie, auf. So kommt es nach etwa zehn Sekunden zur Bewusstlosigkeit. Bereits nach zwei- bis dreiminütigem Ausfall beginnt Gehirngewebe abzusterben, nach circa zehn Minuten tritt der Hirntod ein. Wenn die Stoffwechselprozesse stark verlangsamt sind (Unterkühlung, bestimmte Vergiftungen), kann das Gehirn unter Umständen auch deutlich längere Ischämiezeiten überstehen.
Eine kurzzeitige Minderdurchblutung des gesamten Gehirns mit entsprechend vorübergehendem Bewusstseinsverlust wird als Synkope bezeichnet. Ihr liegt beispielsweise eine Herzrhythmusstörung zugrunde.
Gefäßmissbildungen
Fehlbildungen von cerebralen Gefäßen sind zumeist angeboren. Sie kommen an unterschiedlichen Orten vor und erreichen mitunter extreme Ausmaße. Dementsprechend sind auch ganz verschiedene Symptome möglich. Neben arteriovenösen Shunts sind Kavernome, Hämangiome und Fisteln mit dem Sinussystem bekannt. Häufig treten Gefäßfehlbildungen bei Phakomatosen auf.
Geschichte
Die ersten schriftlich überlieferten Mutmaßungen zur Blutversorgung des Gehirns mit Beschreibung der Hauptgefäße gehen auf den griechischen Arzt und Anatom Galenus von Pergamon (1. Jahrhundert n. Chr.) zurück. Er zog seine Erkenntnisse jedoch überwiegend aus der Sektion von Tieren und übertrug die anatomischen Verhältnisse oft ungeprüft auf den Menschen. So beschrieb er ein Rete mirabile fälschlicherweise auch beim Menschen. In der Spätantike und im Mittelalter galt Galen als unanfechtbare Autorität, so dass die meisten seiner Irrtümer erst in der frühen Neuzeit, als die Präparation menschlicher Leichen an Universitäten durchgeführt wurde, korrigiert werden konnten. Während Niccolò Massa – wohl aus Respekt vor Galen – das Wundernetz ebenfalls beim Menschen beobachtet zu haben behauptete, widersprachen dem seine Zeitgenossen Jacopo Berengario da Carpi und Andreas Vesalius. Die grundlegenden anatomischen Erkenntnisse sind jedoch zwei englischen Ärzten zu verdanken. William Harvey erkannte 1628 den wahren Charakter des Blutstromes als Kreislauf. Die erste detaillierte und zutreffende Beschreibung der Gefäße des menschlichen Gehirns und des Circulus arteriosus lieferte Thomas Willis wenig später.
Siehe auch
Literatur
- L. Edvinsson, E.T. MacKenzie, J. McCulloch: Cerebral blood flow and metabolism. Raven, New York 1993, ISBN 0-88167-918-6.
- Karl Zilles, Gerd Rehkämper: Funktionelle Neuroanatomie. 1. Auflage. Springer, Berlin 1993, ISBN 3-540-54690-1.
- Detlev Drenckhahn, W. Zenker: Benninghoff. Anatomie. Urban & Schwarzenberg, München 1994, ISBN 3-541-00255-7.
- Klaus Poeck, Werner Hacke: Neurologie. 10. vollständig überarbeitete Auflage. Springer, Berlin 1998, ISBN 3-540-63028-7.
Einzelnachweise
- ↑ H. Ito, I. Kanno, H. Fukuda: Human cerebral circulation: positron emission tomography studies. In: Annals of nuclear medicine. Band 19, Nummer 2, April 2005, S. 65–74, ISSN 0914-7187. PMID 15909484.
- ↑ Otto Detlev Creutzfeldt: Allgemeine Neurophysiologie der Hirnrinde. In: Otto Detlev Creutzfeldt (Hrsg.): Cortex cerebri. Springer Verlag, Berlin 1983, ISBN 3-540-12193-5.
- ↑ Klaus Poeck, Werner Hacke: Neurologie. 10. vollständig überarbeitete Auflage. Springer, Berlin 1998, ISBN 3-540-63028-7.
- ↑ U. Gille: Herz-Kreislauf- und Abwehrsystem, Angiologia. In: Franz-Victor Salomon, H. Geyer, U. Gille: Anatomie für die Tiermedizin. Enke, Stuttgart 2004, ISBN 3-8304-1007-7.
- ↑ B. Hillen: The variability of the circulus arteriosus (Willisii): order or anarchy? In: Acta Anatomica Band 129, Nummer 1, 1987, S. 74–80, ISSN 0001-5180. PMID 3618101.
- ↑ Y. M. Chuang et al.: Toward a further elucidation: role of vertebral artery hypoplasia in acute ischemic stroke. In: European neurology. Band 55, Nummer 4, 2006, S. 193–197, ISSN 0014-3022. doi:10.1159/000093868. PMID 16772715.
- ↑ A. Abanou et al.: The accessory middle cerebral artery (AMCA). Diagnostic and therapeutic consequences. In: Anatomia clinica. Band 6, Nummer 4, 1984, S. 305–309, ISSN 0343-6098. PMID 6525305.
- ↑ W. Kuschinsky: Capillary perfusion in the brain. In: Pflügers Archiv – European Journal of Physiology. Band 432, Nummer 3 Suppl, 1996, S. R42–R46, ISSN 0031-6768. PMID 8994541.
- ↑ L. Edvinsson, E.T. MacKenzie, J. McCulloch: Cerebral Blood Flow and Metabolism. Raven, New York 1993, ISBN 0-88167-918-6.
- ↑ L. Sokoloff: Relationships among local functional activity, energy metabolism, and blood flow in the central nervous system. In: Federation proceedings. Band 40, Nummer 8, Juni 1981, S. 2311–2316, ISSN 0014-9446. PMID 7238911.
- ↑ W. Kuschinsky, M. Wahl: Local chemical and neurogenic regulation of cerebral vascular resistance. In: Physiological Reviews. Band 58, Nummer 3, Juli 1978, S. 656–689, ISSN 0031-9333. PMID 28540.
Auf dieser Seite verwendete Medien
* Venöse Blutleiter des Gehirns (Sinusvenen)
SVG-Version von Datei:Cerebrovascular_autoregulation.png
Autor/Urheber: Uwe Gille, Lizenz: CC BY-SA 2.5
Brain of a sheep with stroke due to occlusion of the middle cerebal artery
FIG. 518– Medial surface of cerebral hemisphere, showing areas supplied by cerebral arteries. blue - arteria cerebri anterior pink - arteria cerebri media
yellow - arteria cerebri posteriorCerebral angiography, injection in the left vertebral artery, with retrograde flow in the contralateral vertebral artery, the basilar artery and the posterior communicating artery. The posterior cerebral circulation can be seen, including the posterior part of the Circle of Willis.
Autor/Urheber:
John A Beal, PhD
Dep't. of Cellular Biology & Anatomy, Louisiana State University Health Sciences Center Shreveport, Lizenz: CC BY 2.5Human brainstem blood supply
Hirnversorgende Arterien des Halses (A. carotis vorne, A. vertebralis hinten)
Arterien des Gehirns (Ansicht von unten)
Die Abkunft einzelner Gefäßstrecken aus den embryonalen Kiemenbogenarterien (hier lateinisch durchnummeriert).
Autor/Urheber: Original uploader was Drickey at en.wikipedia, Lizenz: CC BY-SA 2.5
Medical spectral Doppler of common carotid artery By Daniel W. Rickey 2006
Outer surface of cerebral hemisphere, showing areas supplied by cerebral arteries. Blue areas are supplied by the Anterior cerebral artery . Pink areas are supplied by the Middle cerebral artery. Yellow areas are supplied by the Posterior cerebral artery
- Bildbeschreibung: Dieses Bild zeigt eine Übersicht der verschiedenen Betrachtungseben einer fMRT-Aufnahme
- Quelle: Screenshot
- Fotograf/Zeichner: Martin Witte
- Datum: 31.05.2005
Autor/Urheber: unknown, Lizenz: CC BY-SA 3.0
Circulus arteriosus eines Schafes, Injektionspräparat