Blei(II)-acetat
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Blei(II)-acetat | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel |
| |||||||||||||||
| Kurzbeschreibung | farblose, süßlich schmeckende, monokline Kristalle[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | ||||||||||||||||
| Aggregatzustand | fest | |||||||||||||||
| Dichte | 3,25 g·cm−3 (wasserfrei)[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | Zersetzung: ab 200 °C[1] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Zulassungsverfahren unter REACH | besonders besorgniserregend: fortpflanzungsgefährdend (CMR)[4] | |||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
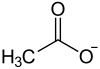
Blei(II)-acetat, ein farbloser kristalliner Feststoff, ist das Blei(II)-salz der Essigsäure mit der Konstitutionsformel Pb(CH3COO)2. Neben der wasserfreien Form ist auch das Trihydrat[5] Pb(CH3COO)2 · 3 H2O bekannt.
Darstellung
Elementares Blei löst sich kaum in kalter, jedoch leicht in siedender Essigsäure. Einfacher kann Blei(II)-acetat durch Reaktion von Blei(II)-oxid mit Essigsäure gewonnen werden:
Eigenschaften
Beim Erhitzen des kristallinen Trihydrates zersetzt sich dieses wieder in Essigsäure und Wasser (die abdampfen) sowie gelbes Blei(II)-oxid:
Verwendung
Blei(II)-acetat dient vor allem zur Gewinnung anderer Bleiverbindungen, beispielsweise Blei(II)-chromat (Chromgelb) und basisches Blei(II)-carbonat (Bleiweiß). Blei(II)-acetat dient auch als Nachweisreagenz für Sulfide.
Bekannt ist Blei(II)-acetat als Bleizucker, da es süß schmeckt und gut in Wasser löslich ist. Trotz seiner Giftigkeit wurde Bleizucker bis zum 19. Jahrhundert als Zuckerersatz (Defrutum) verwendet – insbesondere wurde Wein damit gesüßt. Ludwig van Beethovens Tod durch verpanschte Weine wurde kontrovers diskutiert.[6][7][8] Laut neuesten Untersuchungen, bei der drei seiner Haarlocken „aufgebraucht“ wurden, litt er tatsächlich an einer chronischen Bleivergiftung.[9]
Eine Bleizuckerfabrik, die Anfang des 19. Jahrhunderts auf dem Gelände des Sacrower Schlossparks betrieben wurde, konnte archäologisch untersucht werden.[10] Bleipapier, ein mit einer einprozentigen wässrigen Lösung von Bleiacetat getränktes und in schwefelwasserstofffreier Luft getrocknetes Filterpapier,[11] dient zur qualitativen Erkennung von Schwefelwasserstoff (H2S), es entsteht braungraues, metallisch glänzendes Bleisulfid.[1]
Bei der Isolierung von Naturstoffen kann Blei(II)-acetat genutzt werden, um störende Gerbstoffe und Flavonoide auszufällen. Der Niederschlag kann im Anschluss per Filtration abgetrennt werden. Überschüssige Pb2+-Ionen können durch Zugabe von SO42−-Ionen als Blei(II)-sulfat gefällt werden.[12]
Weblinks
Einzelnachweise
- ↑ a b c Eintrag zu Bleiacetate. In: Römpp Online. Georg Thieme Verlag, abgerufen am 11. April 2014.
- ↑ a b c d e f g Eintrag zu Blei(II)-acetat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- ↑ Eintrag zu Lead di(acetate) im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Eintrag in der SVHC-Liste der Europäischen Chemikalienagentur, abgerufen am 18. Oktober 2015.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Blei(II)-acetat-Trihydrat: CAS-Nummer: 6080-56-4, EG-Nummer: 612-031-2, ECHA-InfoCard: 100.115.474, PubChem: 16693916, ChemSpider: 21062, Wikidata: Q27115555.
- ↑ Brigitte M. Gensthaler: Beethoven und Blei - Tödliches Zusammenspiel. In: Pharmazeutische Zeitung, 30, 2001, abgerufen am 12. Mai 2018.
- ↑ Beethovens Tod: Blei war nicht die Ursache n-tv.de, 29. Mai 2010.
- ↑ Die Leiden des Ludwig van Beethoven. In: Deutschlandfunk. (deutschlandfunk.de [abgerufen am 18. Dezember 2016]).
- ↑ Julia Sica: Starb Beethoven an Bleivergiftung? Analyse liefert neue Hinweise. In: Der Standard. 7. Mai 2024.
- ↑ Annett Dittrich/Kerstin Gessner: Bittersüßes Salz.pdf. In: Bittersüßes Salz – Ausgrabung der Bleizuckerfabrik im Schlosspark Sacrow, Stadt Potsdam. In: Archäologie in Berlin und Brandenburg (2013). 1. Januar 2015 (academia.edu [PDF; abgerufen am 18. Februar 2023]).
- ↑ Walter Wittenberger: Chemische Laboratoriumstechnik, Springer-Verlag, Wien, New York, 7. Auflage, 1973, S. 94, ISBN 3-211-81116-8.
- ↑ Egon Stahl, Werner Schild: Isolierung und Charakterisierung von Naturstoffen. 1. Auflage. Gustav Fischer Verlag, Stuttgart/New York 1986, ISBN 3-437-30511-5, S. 59 f.
Auf dieser Seite verwendete Medien
Globales Harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS) Piktogramm für gesundheitsgefährdende Stoffe.
Struktur des Pb2+-Ions
Struktur des Acetat-Ions
(c) Dormroomchemist in der Wikipedia auf Englisch, CC BY 3.0
Lead(II)Acetate trihydrate crystals prepared from lead carbonate and aqueous acetic acid and crystallized through room temperature evaporation of the solution.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances







