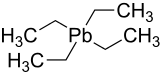
Tetraethylblei
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Tetraethylblei | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C8H20Pb | ||||||||||||||||||
| Kurzbeschreibung | farblose, leicht bewegliche, süßlich riechende, giftige Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 323,45 g·mol−1 | ||||||||||||||||||
| Aggregatzustand | flüssig | ||||||||||||||||||
| Dichte | 1,65 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | 200 °C (Zersetzung)[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Brechungsindex | 1,519 (20 °C)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Zulassungsverfahren unter REACH | besonders besorgniserregend: fortpflanzungsgefährdend (CMR)[5]; zulassungspflichtig[6] | ||||||||||||||||||
| MAK | |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Tetraethylblei (TEL, von englisch tetraethyl lead) ist eine bleiorganische Verbindung mit der Summenformel C8H20Pb (Konstitutionsformel (C2H5)4Pb), bei der vier Ethylgruppen tetraedrisch an einem zentralen Bleiatom gebunden sind. Es handelt sich um eine farblose, viskose Flüssigkeit mit einem angenehmen, süßen Geruch, die luft- und wasserstabil ist.
Der deutsche Chemiker Carl Löwig berichtete 1853 erstmals über die Herstellung von Tetraethylblei. Technische und kommerzielle Bedeutung erlangte es ab den 1920er-Jahren, als Thomas Midgley im Forschungslabor von General Motors seine Wirksamkeit als Antiklopfmittel für Motorenbenzin entdeckte. Die Standard Oil of New Jersey, die das Patent auf die Herstellung hatte, und General Motors, die das Anwendungspatent besaßen, gründeten daraufhin 1924 die Ethyl Corporation, die Tetraethylblei herstellte und vermarktete.
Tetraethylblei wirkt als Antiklopfmittel, da es die bei der Verbrennung von Kohlenwasserstoffen im Motor entstehenden Hydroperoxyl-Radikale abfängt und dadurch eine verzweigte Kettenreaktion inhibiert und so das Klopfen unterbindet. Aufgrund seines guten Preis-Wirksamkeits-Verhältnisses wurde es weltweit als Antiklopfmittel eingesetzt. Seine sekundäre Funktion bestand darin, die Abnutzung an Ventilen und Ventilsitzen in Motoren zu begrenzen.
Die Aufnahme von Tetraethylblei in den Körper kann durch Inhalation, über Hautresorption oder durch Verschlucken erfolgen. Es ist lipophil, giftig und bereits die Aufnahme von geringen Mengen führt zu einer schweren Bleivergiftung. Das letztlich toxische Molekül ist das Triethylblei-Ion, welches das Zentralnervensystem schädigt und eine toxische Psychose oder Lähmungen auslösen kann. Die bei der Verbrennung von Tetraethylblei im Motor entstehenden Bleioxid- und -halogenidpartikel werden mit dem Abgas ausgestoßen und mit der Atemluft aufgenommen. Sie schädigen ebenfalls das Nervensystem, insbesondere das von Kindern. Durch die Verwendung von Tetraethylblei im Benzin wurden allein in den Vereinigten Staaten zwischen seiner Einführung und dem Verbot mehrere Millionen Tonnen Blei emittiert.
Nachdem es anfangs bei der Herstellung von Tetraethylblei zu Vergiftungen und Todesfällen gekommen war, verbot der Surgeon General of the United States 1925 kurzzeitig seine Produktion und Anwendung. Ab den 1970er-Jahren schränkten die Vereinigten Staaten gemäß dem Clean Air Act die Verwendung von Tetraethylblei ein. Neben dem Schutz der Gesundheit sollte damit die Vergiftung von Drei-Wege-Katalysatoren vermieden werden. In der Bundesrepublik Deutschland wurde 1976 der Bleigehalt im Benzin auf 0,15 Gramm pro Liter eingeschränkt, der Gesetzgeber verbot 1988 verbleites Normalbenzin in Deutschland. Das Verbot von verbleitem Superbenzin folgte 1996. Die Europäische Union und die Schweiz verboten verbleites Benzin am 1. Januar 2000.
Geschichte
Tetraethylblei gehört zu den metallorganischen Alkylverbindungen, deren Geschichte 1760 begann. In diesem Jahr synthetisierte Louis Claude Cadet de Gassicourt die erste Verbindung dieser Art, das Kakodyl. Robert Wilhelm Bunsen und seine Schüler Carl Kolbe und Edward Frankland untersuchten das Kakodyl ab 1836 systematisch.[8] Frankland vertiefte seine Forschungen in dieser Richtung und synthetisierte 1849 weitere metallorganische Alkylverbindungen, das Diethylzink und das Dimethylzink.[9][10]
Laborsynthesen

Angeregt durch Franklands Studien widmeten sich weitere Chemiker diesem Forschungsgebiet. So berichtete Carl Löwig, der 1853 die Nachfolge von Bunsen am Lehrstuhl für Chemie der Universität Breslau angetreten hatte, im selben Jahr über die Darstellung der ersten metallorganischen Alkylbleiverbindung. Für deren Darstellung verwendete er eine Blei-Natrium-Legierung, die er mit Iodethan umsetzte. Durch Extraktion mit Diethylether erhielt er eine farblose Flüssigkeit, die sich in Diethylether und Ethylacetat löste, jedoch nicht in Wasser.[8] Löwig konnte Tetraethylblei nicht als reine Verbindung darstellen, da es sich bei der Destillation zersetzte.
Über die erste Darstellung von reinem Tetraethylblei berichtete schließlich George Bowdler Buckton, zur damaligen Zeit Assistent von August Wilhelm von Hofmann am Royal College of Chemistry in London. Er setzte dazu Diethylzink mit einem Überschuss von Blei(II)-chlorid um. Durch eine Destillation des Reaktionsprodukts im leichten Vakuum gelang ihm die Reindarstellung von Tetraethylblei. Buckton untersuchte ebenfalls die Reaktionen von Tetraethylblei mit Chlorwasserstoff unter Bildung von Triethylbleichlorid, mit Schwefelsäure unter Bildung von Hexaethyldibleisulfat ([(C2H5)3Pb]2SO4) und mit Kaliumhydroxid unter Bildung von Hexaethyldibleioxid ([(C2H5)3Pb]2O).[8] Die später im industriellen Bereich übliche Wasserdampfdestillation von Tetraethylblei führte 1879 Frankland ein, der auch als Erster die richtige Strukturformel von Tetraethylblei vorschlug.
Entdeckung des Antiklopfverhaltens

In den Chemielaboratorien der europäischen Hochschulen synthetisierten die Chemiker gegen Ende des 19. und Beginn des 20. Jahrhunderts viele weitere metallorganische Alkylverbindungen, und Tetraethylblei war nur eine von vielen. Es war nicht abzusehen, dass diese Verbindung ab den 1920er-Jahren eine große technische Bedeutung zur Lösung des Klopfproblems erlangen würde. Das Phänomen des Klopfens und dessen schädigende Auswirkung auf den Motor beschrieb bereits Nicolaus Otto 1862 in den Anmerkungen zu den Arbeiten an seinem ersten Viertaktmotor, einer Vierzylinder-Versuchsmaschine:
„1862 lief dieselbe und war auch in demselben Jahr total ruiniert durch die heftigen Stöße, welche in derselben auftraten.“
Dieses Klopfen begrenzte die Steigerung des Wirkungsgrads des Ottomotors, vor allem im oberen Lastbereich. Ein klopffester Kraftstoff lässt ein höheres Verdichtungsverhältnis zu, das zu einer höheren Kraftstoffeffizienz und einer besseren Nutzleistung führt.[12]
Charles Kettering, der Erfinder des elektrischen Anlassers und Gründer der Dayton Engineering Laboratories Company (Delco), beschäftigte sich ab etwa 1910 mit der Verbesserung des thermischen Wirkungsgrads von Verbrennungsmotoren. Er ahnte, dass dazu die Lösung des Klopfproblems von entscheidender Bedeutung wäre, und beauftragte 1916 seinen Mitarbeiter Thomas Midgley mit dessen Untersuchung.[13] Midgley testete daraufhin die Antiklopfeigenschaften von Iod, Anilin und tausenden weiteren organischen und anorganischen Substanzen. Obwohl einige der getesteten Stoffe brauchbare Antiklopfeigenschaften zeigten, schieden sie wegen anderer unerwünschter Eigenschaften wie zu hoher Kosten oder ihrer Korrosionsneigung aus. Die metallorganischen Alkylverbindungen Diethylselenid ((C2H5)2Se) und Diethyltellurid ((C2H5)2Te) zeigten gute Antiklopfeigenschaften, doch besonders die letztere verlieh dem Abgas laut Midgley einen „satanischen Knoblauchgeruch“.[13]
General Motors (GM) übernahm 1919 Ketterings Firma und funktionierte sie zur Forschungsabteilung des Automobilkonzerns um, die Kettering als Vice President führte. Zu dieser Zeit arbeitete der Chemiker Robert E. Wilson, Professor für Angewandte Chemie am Massachusetts Institute of Technology, ebenfalls an Forschungsprojekten für GM. Basierend auf den guten Antiklopfeigenschaften der Alkylmetallverbindungen lenkte er Midgleys Interesse auf eine systematische Untersuchung dieser Produktgruppe. Im Dezember 1921 fanden schließlich Tests mit Tetraethylblei statt, wobei sich gute Antiklopfeigenschaften bereits bei einer Konzentration von 0,025 % zeigten. Tetraethylblei erwies sich als 118 mal effektiver als Anilin und etwa 1200 mal effektiver als Ethanol und war allen anderen getesteten Produkten weit überlegen.[12]
Basierend auf den Arbeiten von Löwig erfolgte die erste technische Synthese von Tetraethylblei auf Basis von Iodethan, die sich jedoch schnell als zu teuer erwies. DuPont entwickelte daraufhin einen Prozess auf Basis von Bromethan, der sich jedoch ebenfalls als zu teuer erwies. In der Zwischenzeit verhandelte GM mit Standard Oil of New Jersey über den Einsatz von Tetraethylblei in deren Produkten. Die von GM angebotenen Konditionen veranlassten Standard Oil, einen eigenen Prozess auf Basis von preiswertem Chlorethan zu entwickeln. Die Forschungsarbeiten dazu vergab Standard Oil an Charles August Kraus, der das industrielle Verfahren mit seinem Mitarbeiter Conrad Callis entwickelte und 1923 patentierte.[14]
Da Tetraethylblei nach diesem Verfahren wesentlich günstiger herzustellen war als nach den Verfahren von GM und DuPont, gründeten Standard Oil Company of New Jersey, die das Herstellungspatent besaß, und General Motors, die das Anwendungspatent besaß, am 18. August 1924 die Ethyl Gasoline Corporation. In dieser Gesellschaft bündelten die Anteilseigner die Aktivitäten zur Herstellung, Verwendung und Vermarktung von Tetraethylblei.[15] Die Ethyl Corporation beauftragte DuPont mit der Produktion, da weder Standard Oil noch GM Erfahrungen auf diesem Gebiet hatten.
Bei Testfahrten und auf Motorprüfständen zeigte sich, dass sich Tetraethylblei nicht problemlos einsetzen ließ. Das verbrannte Tetraethylblei hinterließ eine Schicht aus Blei(II)-oxid im Brennraum sowie auf den Zündkerzen. Thomas Alwin Boyd, ein Mitarbeiter Midgleys, entdeckte, dass die Zugabe von 1,2-Dibromethan diese Ablagerungen verhinderte. Durch diesen Zusatzstoff bildete sich das leichter flüchtige Blei(II)-bromid, das mit dem Abgas emittiert wurde.[12]
Da Brom knapp und teuer war, entwickelte die GM-Forschungsabteilung in Zusammenarbeit mit Dow Chemical einen Prozess zur Gewinnung von Brom aus Meerwasser. Dazu wurde Chlor ins Meerwasser eingespeist, das die dort vorhandenen Bromide oxidierte und so Brom freisetzte.[12] Anlagen in Kure Beach, North Carolina, und Freeport, Texas, lieferten das benötigte Brom für die Bromierung von Ethen.[12] Kurioserweise geht dieses Verfahren ebenfalls auf Carl Löwig zurück, der 1825 durch Einleiten von Chlor in Bad Kreuznacher Solewasser Brom gewann.

Am 2. Februar 1923 verkaufte die Refiners Oil Company die ersten Liter eines mit Tetraethylblei versetzten Benzins an einen Autofahrer in Dayton (Ohio). Mittels eines sogenannten „Ethylizers“, einer Handpumpe, wurde das Tetraethylblei zum Benzin gepumpt. Bis August 1923 waren etwa 30 Ethylizer im Einsatz, die Zahl stieg bis Oktober 1924 auf über 17.000 an. Die ersten drei Plätze des Indianapolis-500-Rennens im Jahr 1923 belegten Rennwagen, die mit Tetraethylblei versetztes Benzin verwendet hatten, ein Ergebnis, das in der Presse besonders herausgestellt wurde. Etwa 18 Monate später betrug der Verkauf von verbleitem Benzin bereits 380 Millionen Liter pro Jahr.[16]
Erstes Verbot von Tetraethylblei
1922 war die giftige Wirkung von Bleiverbindungen schon bekannt, und ein Chemieprofessor warnte das damalige Bundesgesundheitsamt der USA im Herbst 1922 vor ernsten gesundheitlichen Gefahren bei einem Bleizusatz im Kraftstoff. General Motors zeigte jedoch größtes Interesse, den Zusatz auf den Markt zu bringen. Die US-Behörden ließen sich auf die Durchführung einer Studie über die Gesundheitsrisiken des Bleizusatzes ein, die allerdings von GM finanziert wurde und dem Konzern beziehungsweise Ethyl weitreichende Privilegien gewährte, darunter ein Anspruch auf kritische Kommentierung aller Versuchsunterlagen und ein Veto-Recht auf Publikation. Das im Oktober 1924 veröffentlichte Studienergebnis fiel dergestalt aus, dass sich der Verdacht auf Gesundheitsschädigung durch Bleibenzin-Abgase nachdrücklich zurückweisen ließ.[17]
Gleichzeitig aber wurde bekannt, dass bei Standard Oil infolge akuter Bleivergiftung aufgrund der betrieblichen Arbeit Tote und Schwerverletzte zu beklagen waren: Arbeiter, die mit der Herstellung von Tetraethylblei beschäftigt waren, verhielten sich bald seltsam. Die Arbeiter bekamen Halluzinationen und schnappten nach imaginären Schmetterlingen, die vermeintlich um sie herumflogen oder sich auf ihrem Körper niederließen.[18] Tetraethylblei bekam daraufhin den Spitznamen „The loony gas“ (dt.: „Das verrückte Benzin“), das Produktionsgebäude erhielt den Spitznamen „House of Butterflies“ (dt.: „Haus der Schmetterlinge“). Im Herbst 1924 verschlechterte sich der Zustand der Arbeiter rapide. Unterschiedlichen Quellen zufolge starben 5 bis 7 Arbeiter an der Bleivergiftung und 32 bis 35 waren schwerverletzt oder kamen in ein Krankenhaus.[19][20] Das Office of Chief Medical Examiner of the City of New York (OCME) unter Charles Norris leitete die Untersuchungen der Todesfälle. Alexander O. Gettler, ein US-amerikanischer Biochemiker und Pionier der forensischen Toxikologie, wies in den Körpern der Toten hohe Konzentrationen an Blei nach, die Todesursache war letztendlich Bleivergiftung. Dies führte zu einem vorübergehenden Verbot von Tetraethylblei als Benzinzusatzstoff unter anderem in New York City, New Jersey und Philadelphia. Mehrere europäische Staaten schlossen sich dem Verbot 1925 an. Die Schweiz ergänzte die Lebensmittelverordnung und verbot neben Blei ebenso die Verwendung von Selen- und Tellurverbindungen.[19]
In der Folge wurden weitere Betriebsunfälle dieser Art in anderen Fabriken, darunter von Du Pont, aufgedeckt, bei denen mindestens weitere 12 Menschen gestorben waren und zahlreiche weitere im Krankenhaus behandelt werden mussten.[20] Renommierte Forschende wiesen nach, dass die durchgeführte Studie über die Gesundheitsrisiken von Bleibenzin große wissenschaftliche Mängel aufwies und nicht unabhängig finanziert wurde.[17][20] Auf einer Anhörung des Surgeon General 1925 über die Gefahren von Tetraethylblei sprachen sich Yandell Henderson, ein US-amerikanischer Physiologe von der Yale University sowie David Lynn Edsall von der Harvard Medical School gegen die Verwendung von Tetraethylblei aus. Sie prognostizierten eine schleichende Vergiftung durch das emittierte Blei.
“Conditions would grow worse so gradually and development of lead poisoning will come on […] insidiously […] before the public and the government awaken to the situation.”
„Die Zustände würden sich allmählich verschlechtern, und die Entwicklung einer Bleivergiftung würde […] heimtückisch […] vor sich gehen, bevor die Öffentlichkeit und die Regierung sich der Situation bewusst würden.“
Der erzielte Kompromiss auf der nationalen Gesundheitskonferenz am 20. Mai 1925 war die Einrichtung einer Untersuchungskommission über die Gesundheitsrisiken, und Ethyl versicherte, kein weiteres Bleibenzin zu produzieren, bis deren Untersuchungsergebnis veröffentlicht ist. Kritiker vermuteten für sich einen Erfolg, der sich jedoch in das Gegenteil verwandelte: Nach sieben Monaten Untersuchung kam die Kommission zu dem Ergebnis, es gäbe „zum gegenwärtigen Zeitpunkt keine guten Gründe, Äthyl-Benzin zu verbieten“.[17] Die Unterstützer nannten Tetraethylblei ein „Geschenk Gottes“, das die knappen Erdölvorräte entscheidend verlängere. Ein Verbot wäre nur gerechtfertigt, wenn ein Beweis einer Gefährdung der öffentlichen Gesundheit vorläge.[21] Die US-amerikanische Bundesregierung hob das Verbot von Tetraethylblei schließlich 1926 wieder auf.[22] Mit einer „Ethyl-Lady“ als Maskottchen und eingängigen Werbeslogans wurden die Vorzüge des Ethyl-Benzins in den Folgejahren in die Welt getragen.[17]
Siegeszug des Tetraethylbleis
Die Entwicklung des modernen und leistungsstarken Motors war weitgehend von der Verfügbarkeit hochwertigen Benzins abhängig. Die Zugabe von Tetraethylblei schien der wirtschaftlichste Weg zu sein, diese hochwertigen Benzine herzustellen, und galt als einer der wichtigsten Fortschritte der Kraftstoff- und Automobilindustrie.[23] Alfred P. Sloan, der 1923 die Nachfolge von Pierre Samuel du Pont als Präsident von GM antrat, nutzte die Verfügbarkeit hochoktaniger Kraftstoffe für den Bau von Automobilen mit höherer Geschwindigkeit und Leistung. Dies erlaubte GM eine stärkere Differenzierung zwischen den Konzernmarken, welche dem Kunden das Erklettern einer „Erfolgsleiter“ erlaubte. Der Kunde fuhr Chevrolet als Einsteigermarke, um dann über Pontiac, Oldsmobile und Buick schließlich zu Cadillac aufzusteigen. Mit dieser Strategie gelang es GM, Ford aus seiner Marktbeherrschung zu verdrängen und zum größten amerikanischen Automobilkonzern aufzusteigen.[13]
Die US-amerikanische Öffentlichkeit feierte Midgleys Entdeckung enthusiastisch, die akademische Welt zeichnete ihn mit der William H. Nichols Medal, der Priestley-Medaille, der Willard Gibbs Medal, der Perkin Medal und zwei Ehrendoktorwürden aus. Die American Chemical Society wählte den Maschinenbauer Midgley, der auch die Fluorchlorkohlenwasserstoffe entwickelt hatte, 1944 zu ihrem Präsidenten.[24] Anlässlich der Überreichung der Perkin Medal an Midgley schrieb die New York Times:
“Midgley’s work resulted in the creation of the entire ethyl gasoline industry with all that it implies – use of higher compression engines, greater flexibility of automobile operation and other advances. Tetraethyllead in motor fuels adds fifty times as much horsepower annually to American civilization as that which will be supplied by Boulder Dam”
„Die Arbeit von Midgley führte zur Gründung der gesamten Ethylbenzinindustrie mit allem, was dazugehört – dem Einsatz von Motoren mit höherer Verdichtung, größere Flexibilität des Automobilbetriebs und andere Fortschritte. Tetraethylblei in Motorenkraftstoffen liefert der amerikanischen Zivilisation jährlich das 50-fache der Leistung, die der Boulder Dam liefern wird.“
Lizenz an die I.G. Farben
Im Vorfeld des Zweiten Weltkriegs erlangte Tetraethylblei eine kriegswirtschaftliche Bedeutung. Durch die Zugabe von Tetraethylblei ließ sich Flugzeugbenzin mit einer Oktanzahl von 100 und höher herstellen.[26] Während die Luftwaffe der Wehrmacht bis dahin Kraftstoffe mit 87 bis 90 Oktan eingesetzt hatte, führte die Verwendung hochoktanigen Benzins zu einer signifikanten Verbesserung der meisten kampfbedingten Leistungsfaktoren der Flugzeuge. Dazu gehörten eine erhöhte Motorleistung im Steigflug, ein geringerer Kraftstoffverbrauch sowie eine erhöhte Höchstgeschwindigkeit.[27]
Die I.G. Farben erwarb 1935 eine Lizenz zur Herstellung von Tetraethylblei, um damit klopffesteres Flugbenzin herstellen zu können. Das Kriegsministerium der Vereinigten Staaten prüfte den Vorgang und erhob keine Einwände gegen das gemeinsame Unternehmen.[28]
Nach Gründung der Ethyl GmbH durch die I.G. Farben, der Standard Oil of New Jersey und GM wurden zwei Tetraethylblei-Anlagen gebaut und mit der NS-Regierung am 10. Juni 1936 ein Flugbenzinvertrag geschlossen.[29] Eine dieser Tetraethylblei-Anlagen mit einer jährlichen Produktion von 1200 Tonnen entstand 1936 in Gapel, die andere wurde 1938/39 in Frose eröffnet und verfügte über eine Jahresproduktionsmenge von 3600 Tonnen.[30]
Massenmotorisierung nach dem Zweiten Weltkrieg

Ab den 1950er Jahren stieg mit dem Wirtschaftswunder und der beginnenden Massenmotorisierung die Nachfrage nach hochoktanigem Benzin und damit nach Tetraethylblei in Deutschland und Mittel- und Westeuropa stark an, wobei die Schweiz ein Verbot für dessen Verwendung in Motorenbenzin erst 1947 aufhob.[19] In den Vereinigten Staaten stieg die Anzahl der Automobile pro 1000 Einwohner zwischen 1945 und 1970 von 222 auf 545 und 1980 auf 711 an; der Bedarf an Tetraethylblei stieg dementsprechend an.[31] Deutschland verbrauchte 1983 etwa 4600 Tonnen Blei in Form von Tetraethylblei.[32]
Der Esso-Tiger und der Slogan „Pack den Tiger in den Tank!“, der 1959 erfunden worden war, bewarb in den 1960er und 1970er Jahren mit Tetraethylblei versetztes Benzin von Esso.[19] Die erfolgreiche Kampagne steigerte die Umsätze des Unternehmens erheblich, das Time Magazine erklärte deshalb das Jahr 1964 zum Jahr des Tigers. Zur gleichen Zeit herrschten in der DDR mit maximal zulässigen 0,04 % Tetraethylblei-Gehalt strengere Grenzwerte als in Westdeutschland (0,06 %) und den USA (0,08 %).[33]
Im Zuge der Massenmotorisierung wuchs die Umweltbelastung durch den Automobilverkehr und die damit verbundenen Emissionen von Kohlenstoffmonoxid, Kohlenwasserstoffen, Stickoxiden und Schwefeldioxid. Der durch den Straßenverkehr verursachte Smog in US-amerikanischen Großstädten wie New York City oder Los Angeles führte zu Maßnahmen zur Verringerung der Abgasemissionen. Der dichte Smog in Los Angeles führte zu Gerüchten über einen japanischen Gasangriff.[34] Präsident Lyndon B. Johnson und Mitglieder des Kongresses begannen, Bundesgesetze zur Regulierung der Luftverschmutzung in den Vereinigten Staaten auszuarbeiten, in denen Grenzwerte für die Schadstoffgruppen definiert wurden. Eine Reduktion der Emissionen sollte durch den Einsatz von Drei-Wege-Katalysatoren erreicht werden. Hierzu wiederum war es notwendig, flächendeckend auf Tetraethylblei zu verzichten.
Die Muskie-Anhörungen

Der Senator von Maine, Edmund Muskie, leitete 1966 einen Ausschuss für die Anhörungen zum Clean Air Act, eine US-amerikanische gesetzliche Regelung zur Luftreinhaltung. Muskie legte einen Schwerpunkt der Anhörungen auf die gesundheitlichen Auswirkungen von Bleiemissionen durch die Verbrennung von verbleitem Benzin.[35] Der damalige Surgeon General of the United States, William Stewart, der operative Leiter des United States Public Health Service, brachte bei der Anhörung seine Besorgnis über den gesundheitlichen Effekt einer Bleiexposition für Kinder und schwangere Frauen zum Ausdruck. Studien zufolge gab es einen Zusammenhang zwischen der Bleiexposition und dem Auftreten einer geistigen Behinderung bei Kindern.[35] Kernpunkt der Anhörung war jedoch die wissenschaftliche Auseinandersetzung zwischen Robert A. Kehoe und Clair Cameron Patterson.
Robert A. Kehoe war der leitende Mediziner der Ethyl Corporation und Direktor des von GM, DuPont und der Ethyl Corporation finanzierten UC Kettering Laboratory of Applied Physiology. Er galt als der führende Experte in Bezug auf die toxikologische Wirkung von Blei. Kehoe hatte den Blutbleigehalt von mexikanischen Bauern untersucht und dabei Werte gefunden, die mit einer US-amerikanischen, innerstädtischen Gruppe vergleichbar waren, obwohl die Bauern kaum dem Einfluss von Bleiemissionen durch Autoabgase ausgesetzt waren. Daraus zog Kehoe die Schlussfolgerung, dass Blei ein natürlicher Bestandteil der Körperchemie sei. Die richtige Erklärung für die erhöhten Blutbleiwerte war jedoch, dass diese Bauern durch bleihaltiges Tongeschirr kontaminierte Nahrung aufnahmen. Kehoe vertrat überdies die Meinung, dass der Mensch im Laufe der Evolution eine biologische Anpassung an Blei erreicht habe. Seine Arbeiten und sein Wirken führten dazu, dass ein System der freiwilligen Selbstregulierung durch die Bleiindustrie als Modell für die Bewertung der Umweltverträglichkeit akzeptiert wurde.[36]
Clair Patterson war ein US-amerikanischer Geochemiker, der die Uran-Blei-Datierung zur Berechnung des Alters der Erde entwickelt hatte und dafür unter anderem mit dem V. M. Goldschmidt Award der Geochemical Society ausgezeichnet wurde. Bei seinen Untersuchungen stellte er fest, dass Blei aus der Umwelt seine Messungen verfälschte und dass aufwändige Methoden zur Kontrolle der Probenkontamination erforderlich waren, um sichere Ergebnisse bei der Bestimmung des Verhältnisses der Blei-Isotopen zu erreichen. Seine Arbeiten zeigten schließlich, dass es seit der Einführung von Tetraethylblei einen starken Anstieg der Umweltbelastung durch Blei gab und dass der natürliche Wert sehr viel niedriger lag.[37] Eine evolutionäre Anpassung an Blei durch den Menschen war damit ausgeschlossen. Patterson zeigte in der Anhörung nicht nur, dass Kehoes Daten falsch waren und dass aufgrund der Bleibelastung eine große Anzahl von Menschen krank seien, sondern er griff auch die Arbeitsweise des Public Health Service an.
“It is not just a mistake for public health agencies to cooperate and collaborate with industries in investigating and deciding whether public health is endangered; it is a direct abrogation and violation of the duties and responsibilities of those public health organizations.”
„Es ist nicht nur ein Fehler für öffentliche Gesundheitsbehörden mit Industriezweigen zu kooperieren und zusammenzuarbeiten bei der Untersuchung und der Entscheidung, ob die öffentliche Gesundheit gefährdet ist; es ist eine direkte Außerkraftsetzung und eine Verletzung der Pflichten und Verantwortlichkeiten dieser öffentlichen Gesundheitsorganisationen.“
Pattersons Auftritt und die Unterstützung durch Senator Muskie veränderte die öffentliche Wahrnehmung in Bezug auf die Gefahren von Tetraethylblei. Das Bewusstsein der Risiken für die öffentliche Gesundheit nahm in der Folge merklich zu.[36] Muskie unterstützte außerdem das von Patterson eingeführte Konzept der Dosis-Wirkungs-Kurve, bei der die akute Bleivergiftung nur ein Punkt eines Spektrums von Reaktionen des menschlichen Organismus auf die Aufnahme von Blei darstellt. Dieses Konzept spielte fortan eine wesentliche Rolle bei der Regulierung von Tetraethylblei in Benzin.[35] Patterson, der als Sieger aus der wissenschaftlichen Auseinandersetzung mit Kehoe hervorgegangen war, verlor in der Folge sowohl seinen Vertrag mit dem Public Health Service als auch seinen Vertrag mit dem American Petroleum Institute. Einige Mitglieder des Kuratoriums des California Institute of Technology baten seinen Vorgesetzten um seine Entlassung.[35]
Ausstieg

Die in den 1970er-Jahren eingeführten Drei-Wege-Katalysatoren veränderten die Anforderungen sowohl an die Automobil- als auch die Benzinherstellung. Sie reduzierten die Emissionen von Kohlenwasserstoffen, Kohlenstoffmonoxid und Stickoxiden im Autoabgas, benötigten aber Benzin ohne Zusatz von Tetraethylblei. Ablagerungen von Bleioxiden auf der Katalysatoroberfläche verringerten die Effizienz der Katalysatoren, indem sie die katalytisch aktiven Edelmetalle deaktivierten. Die Einführung der Katalysatoren und die Entwicklung bleifreier Benzine führte zur Einführung gehärteter Ventilsitze durch die meisten Automobilhersteller.[38]
Aufgrund der wissenschaftlichen Belege für die durch Tetraethylblei verursachten Gefährdungen sowohl für die Gesundheit als auch für den Einsatz von Drei-Wege-Katalysatoren erließ die US-Umweltschutzbehörde 1973 Vorschriften zur Reduzierung des Bleigehalts und setzte diese 1976 in Kraft. 1996 wurde verbleites Benzin in den USA gänzlich verboten. Die europäischen und japanischen Umweltschutzbehörden folgten dem US-amerikanischen Vorbild. Ab 1984 wurde bleifreies Benzin an Tankstellen in Deutschland und Österreich angeboten (ab 1985 in der Schweiz), zunächst parallel zu herkömmlichen verbleiten Kraftstoffen. Mit fortschreitender Verbreitung von Katalysatoren, die auf „bleifreies“ Benzin angewiesen sind, war es nach einigen Jahren praktisch überall verfügbar. Verbleites Normalbenzin wurde bereits 1988 in Westdeutschland verboten; das Verbot von verbleitem Superbenzin folgte 1996.[39] Die AK Chemie in Biebesheim am Rhein, eine Tochtergesellschaft der Octel Deutschland, die sich wiederum im Besitz der BP, Caltex, Mobil Oil und der Shell befand, produzierte als einzige Gesellschaft in Deutschland Tetraethylblei; die Firma stellte die Produktion Anfang der 1990er Jahre ein.[40]
Die Europäische Union und die Schweiz verboten verbleites Benzin am 1. Januar 2000. Die EU klassifizierte Tetraethylblei am 19. Dezember 2012 als besonders besorgniserregenden Stoff.[5] Es ist weiterhin als bioakkumulierbarer Stoff und Stoff mit problematischen Umwelteigenschaften eingestuft.[41]
China verbot verbleites Benzin um das Jahr 2001. In anderen Ländern und Regionen kam das Verbot von Tetraethylblei später, im Jahr 2002 verwendeten noch 82 Länder Tetraethylblei als Benzinzusatz. Algerien verwendete als letztes Land Tetraethylblei für Motorenbenzin.[42] Innospec, früher bekannt als Octel Corporation, stellte weltweit als letzter Hersteller Tetraethylblei her und exportierte dieses von Großbritannien nach Algerien.[43]
Im August 2021 wurde in Algerien der weltweit einzige noch verbliebene Vorrat an verbleitem Kfz-Benzin verkauft und der letzte Tropfen vertankt. Seitdem gibt es auf der ganzen Erde keine Tankstelle mehr, die noch verbleites Benzin für Kraftfahrzeuge anbietet.[44]
Die US-amerikanische NASCAR-Rennserien setzten bis 2008 mit einer Ausnahmegenehmigung verbleites Benzin mit 110 Oktan ein.[45] Für Kleinflugzeuge wird unter der Bezeichnung AvGas weiterhin bleihaltiges Benzin angeboten und verwendet. Laut der US-amerikanischen Umweltschutzbehörde EPA stellt AvGas damit die größte Quelle für Bleiemissionen.[46] Zwar werden hochverbleite AvGas-Varianten nicht mehr angeboten, aber AvGas 100LL mit einer Oktanzahl von 100 und einem Bleigehalt von 0,56 Gramm Blei pro Liter wird als Flugkraftstoff bundesweit für den Betrieb von Flugzeugen mit Hubkolbenmotor vertrieben.[47] In der Schweiz und Österreich ist AvGas 100LL ebenfalls die Standardqualität für Flugbenzin.
Herstellung
Die ausgezeichnete Wirksamkeit von Tetraethylblei als Antiklopfmittel und seine Verwendung als Benzinadditiv ab 1923 führten zu einer enormen Anzahl von Studien über seine Syntheseverfahren und die industrielle Produktion. Die industrielle Produktion erfolgte vorwiegend auf einer Variante des schon von Löwig angewendeten Synthesewegs über eine Blei-Natrium-Legierung sowie über ein elektrochemisches Verfahren.
Industrielle Herstellung
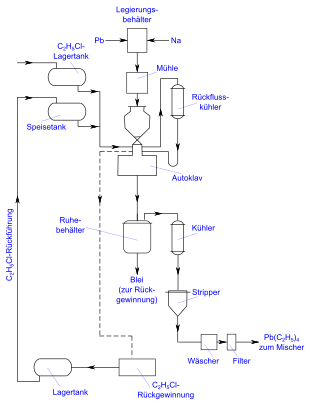
Die industrielle Herstellung von Tetraethylblei erfolgt durch eine Fest-Flüssig-Reaktion einer Natrium-Blei-Legierung mit Chlorethan bei einer Temperatur von 50 bis 75 °C, nach Charles August Kraus und Conrad C. Callis auch Kraus-Callis-Prozess genannt.[12] Das Blei wird dazu mit 10 % Natrium unter einem Schutzgas geschmolzen. Die Legierung wird mechanisch auf eine Korngröße von 5 bis 6 Millimetern zerkleinert und mit Chlorethan in einem Autoklav bei rund 50 bis 75 °C zur Reaktion gebracht.[49] Um einen Druckanstieg im Autoklav zu vermeiden muss das verwendete Chlorethan frei von Verunreinigungen wie Vinylchlorid sein. Aluminiumchlorid dient als Katalysator. Bei einem Ansatz mit 1350 Kilogramm der Blei-Natrium-Legierung und 590 Kilogramm Chlorethan bilden sich rund 400 Kilogramm Tetraethylblei. Die Reaktionsdauer beträgt bei einer solchen Chargengröße etwa 8 Stunden.[49]
Tetraethylblei wird anschließend mittels Wasserdampfdestillation abdestilliert und getrocknet. Das anfallende metallische Blei wird mit Natrium wieder zu einer Blei-Natrium-Legierung umgesetzt.[50] Die Ausbeute beträgt zirka 88 %, bezogen auf Natrium.[51] Typische Nebenprodukte sind Kohlenwasserstoffe wie Butan, die durch Natrium-induzierte Kupplungsreaktionen entstehen.
In der Patentliteratur sind unter anderem Essigsäureethylester, Wasser sowie verschiedene sauerstoffhaltige Kohlenwasserstoffe als Promotoren angegeben. Da die Reaktion möglicherweise eine Reduktionsstufe beinhaltet, könnten diese Stoffe als Wasserstofflieferanten dienen.[52]
Etwa 60 % der US-amerikanischen Produktion von metallischem Natrium sowie 85 % der von Chlorethan wurde für die Synthese von Tetraethylblei nach diesem Verfahren verwendet. In Europa entfiel 65 % der Chlorethanproduktion auf dieses Verfahren.[53] Einhergehend mit dem Verbot von bleihaltigem Benzin sank der Bedarf an metallischem Natrium und Chlorethan signifikant.
Der Nalco-Prozess lieferte ebenfalls Tetraethylblei im technischen Maßstab. Dabei erfolgte die Elektrolyse einer Lösung eines Ethylmagnesiumgrignardreagenz und einem Ethylhalogenid an einer Blei-Anode und einer Magnesium-Kathode. Die bei der Anodenreaktion gebildeten Alkylradikale reagieren mit dem Elektrodenmaterial zu Tetraethylblei.[54] Die Gesamtreaktion ist:[55]
Nalco begann mit der Produktion 1964 und besaß in den 1970er-Jahren einen Marktanteil von 11,8 %. Den restlichen Markt teilten sich die Ethyl Corporation (33,5 %), DuPont (38,4 %) sowie PPG Industries (16,2 %).[56]
Andere Darstellungswege
Die Darstellung von Tetraethylblei erfolgt meist durch oxidative Addition an metallisches Blei oder an Blei(II)-Verbindungen unter anschließender Disproportionierung. Die Verwendung von Blei(IV)-Verbindungen zur Synthese ist ebenfalls möglich.
Die Umsetzung von Blei(II)-chlorid mit einer Ethylgrignard-Verbindung führt zum instabilen Zwischenprodukt Diethylblei:
Dieses reagiert durch Disproportionierung zum Tetraethylblei und elementarem Blei:
Als Nebenprodukt fällt Hexaethyldiblei an.[57]
Die Darstellung von Tetraethylblei gelingt über die Umsetzung von Blei(IV)-chlorid mit Grignard-Verbindungen oder mit Triethylaluminium.[58][59] Aufgrund der instabilen Natur von Blei(IV)-chlorid ist dies kein gängiges Verfahren.
Tetraethylblei bildet sich ebenfalls durch Reduktion von Bromethan an Blei-Kathoden in Propylencarbonat-Lösungen mit Tetraalkylammoniumsalzen als Leitelektrolyten.[60]
Durch die Reaktion von Diethylzink mit Blei(II)-chlorid kann ebenfalls Tetraethylblei hergestellt werden.[8]
Tetraethylblei lässt sich durch Salzmetathese von Triethylbleichlorid unter Austausch der Chlorid- und Ethylliganden gewinnen.[58]
Durch Hydroplumbierung, etwa der Umsetzung von Triethylplumban mit Ethen, lässt sich ebenfalls Tetraethylblei herstellen.[58] Triethylplumban ist eine unstabile Verbindung, die sich durch die Umsetzung von Triethylbleichlorid mit Natriumborhydrid gewinnen lässt.[61]
Die Darstellung von Tetraethylblei kann weiterhin durch die Umsetzung von Blei(II)-chlorid mit Ethyllithium zum Triethylbleilithium und anschließender Umsetzung mit Chlorethan erfolgen.[52]
Eigenschaften
Physikalische Eigenschaften
Tetraethylblei ist eine farblose, ölige, flüchtige Flüssigkeit mit einer Dichte von 1,653 g cm³ bei 20 °C. Der Schmelzpunkt liegt bei −136 °C und der Siedepunkt bei 200 °C (unter Zersetzung), der Flammpunkt liegt bei etwa 80 °C.[2] Die molare Masse beträgt 323,45 g·mol−1. Die Viskosität beträgt 2,2899 · 10−2 Pa·s−1 bei −48,15 °C.[62]
Die Beobachtungen des Schmelzpunkts von Tetraethylblei zeigten, dass die Verbindung in mindestens sechs verschiedenen Formen kristallisieren kann, wobei deren Schmelzpunkte in einem Bereich von wenigen Grad liegen.[63] Es wird vermutet, dass die ungewöhnliche Polymorphie von Tetraethylblei auf die Größe des Zentralatoms zurückzuführen ist, die den Ethylgruppen eine Form der Rotationsisomerie erlaubt.[63]
Molekulare Eigenschaften
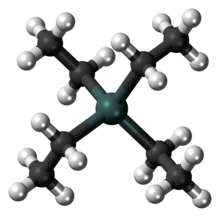
Die Kohlenstoff-Blei-Bindung ist eine rein kovalente σ-Bindung.[64] Blei ist in organischen Verbindungen sp3–hybridisiert, die Ethylliganden sind tetraedrisch am Zentralatom angeordnet. Die Länge der Pb–C–Bindung beim Tetraethylblei beträgt 229 Picometer (pm), die Dissoziationsenergie 226 Kilojoule pro Mol (kJ/mol).[65][66]
Chemische Eigenschaften
Tetraethylblei ist in vielen organischen Lösungsmitteln löslich, aber kaum löslich in verdünnten Säuren oder Laugen. Die Löslichkeit in Wasser beträgt 0,29 mg/l bei 25 °C. Da die vier Ethylgruppen tetraedrisch um das Bleiatom angeordnet sind, fallen der positive (Pb) und die addierten negativen Ladungsschwerpunkte (C2H5) zusammen. Da das Molekül zudem ungeladen ist, ist es unpolar und somit lipophil. Daraus resultieren seine gute Löslichkeit in unpolaren und sehr schlechte Löslichkeit in polaren Lösungsmitteln, zum Beispiel Wasser.
Während viele rein anorganische Bleisalze in der Oxidationsstufe II vorliegen, überwiegt in der Chemie der Alkylbleiverbindungen die Oxidationsstufe IV. Alkylbleiverbindungen der Oxidationsstufe II disproportionieren leicht in metallisches Blei und Blei(IV)-Alkyle.
Tetraethylblei brennt mit einer orangefarbenen Flamme, die an den Rändern hellgrün gefärbt ist. Es reagiert heftig bei der Zugabe von Iod und Brom. Die Chemie wird durch die schwache Pb-C-Bindung dominiert. Durch Pyrolyse von Tetraethylblei bei niedrigen Drücken in einem Inertgasstrom in einer Glasröhre konnten freie Ethylradikale nachgewiesen werden. Dazu wurden die Ethylradikale mit einem Bleispiegel, der zuvor auf dem kalten Teil einer Glasröhre abgeschieden wurde, zu Tetraethylblei umgesetzt. Diese Umsetzung gilt als der erste Nachweis der Existenz einfacher aliphatischer freier Radikale.[67]
Die Behandlung des Tetraethylbleis mit Silbernitrat in Essigsäureethylesterlösung, gefolgt von der Zugabe von wässrigem Kaliumhydroxid führt zur Bildung von Bis-triethylbleioxid ([(C2H5)3Pb]2O). An Luft reagiert dieses unter Aufnahme von Kohlenstoffdioxid zu Bis-triethylbleicarbonat.[8] Die Reaktion von Tetraethylblei mit Salzsäure oder wässriger Kaliumbromidlösung führt zur Bildung der Triethylbleihalogenide (C2H5)3PbCl oder (C2H5)3PbBr als kristalline Feststoffe.[8] Mit trockenem Schwefeldioxid reagiert Tetraethylblei in inerten Lösungsmitteln unter Insertion von SO2 in die Pb-C-Bindung zu Organobleisulfinaten.[68]
Tetraethylblei bildet mit Octakis(3,4-dimethylphenylthio)naphthalen Einschlusskomplexe. Die Kristallstrukturanalyse des Tetraethylblei-Addukts zeigt, dass das Addukt in der kubischen Raumgruppe Pn3 kristallisiert, wobei die Ethylgruppen des Tetraethylbleis stark ungeordnet sind.[69]
Verwendung

In den 1950er-Jahren war eine Lösung names „Ethylfluid“ auf dem Markt. Dieses bestand aus Tetraethylblei (54,6 %), 1,2-Dibromethan (36,4 %), einem blauen Anthrachinonfarbstoff (0,01 %) sowie „Halowachsöl“, 1-Chlornaphthalin, 9 %, welches als Schmierstoff für die Kolbenringe gedacht war.[49] Das 1,2-Dibromethan war zum Teil durch 1,2-Dichlorethan ersetzt. Die Produktionsmenge Tetraethylblei betrug 1937 bereits 30.000 Tonnen, womit etwa 64 Millionen Liter Benzin verbleit wurden, bei einer Oktanzahlerhöhung von 5 Punkten. Die damit verbundene Einsparung betrug annähernd 2,8 Millionen Liter Benzin.[49] Das später entwickelte „TEL Motor 33 Mix“ enthielt etwa 57,5 % Tetraethylblei, 17,6 % Dichlorethan, 16,7 % Dibromethan, 7,0 % (Methylcyclopentadienyl)mangantricarbonyl, 1,2 % Farbstoff sowie Lecithin oder 4-tert-Butylphenol als Antioxidanzien.[12]
| Jahr | Vereinigte Staaten | Westliche Welt (ohne USA) |
|---|---|---|
| 1965 | 225.000 | 35.000 |
| 1966 | 247.000 | 36.000 |
| 1967 | 247.000 | 46.000 |
| 1968 | 262.000 | 48.000 |
| 1969 | 271.000 | 44.000 |
| 1970 | 279.000 | 47.000 |
| 1971 | 264.000 | 113.000 |
| 1974 | 250.000 | 125.000 |
| 1975 | 175.000 | 126.000 |
Antiklopfmittel für Motorenbenzin

Takt 1: Ansaugen; Takt 2: Verdichten; Zünden und Verbrennen des Gemisches am oberen Totpunkt; Takt 3: Arbeiten; Takt 4: Ausstoßen
Der Wirkungsgrad eines Ottomotors nimmt mit zunehmendem Verdichtungsverhältnis zu. Die Verdichtung lässt sich jedoch durch das Auftreten des Motorklopfens nicht beliebig steigern.[70] Das Klopfen tritt während der Verbrennung, am Ende des Verdichtungs- und zu Beginn des Arbeitstaktes nach der Zündung durch den Zündfunken auf; durch die Zündung breitet sich im Brennraum eine Flammenfront aus, die normalerweise das gesamte Gemisch kontrolliert entzündet. Beim Klopfen werden die sogenannten Endzonen des Gemisches durch die Flammfront so sehr Wärme und Druck ausgesetzt, dass sie sich von selbst entzünden, ehe sie von der Flammfront erreicht werden. Die daraus resultierende, annähernd isochore Verbrennung des Restgases führt zu steilen Druckgradienten, die sich als Druckwellen im Brennraum verbreiten und zu einem als Klopfen beziehungsweise Klingeln bezeichneten Geräusch führen. Die beim Klopfbetrieb auftretenden Druckwellen können zu Materialschäden führen; die starken thermischen Belastungen können das Metall von Zylinder und Kolben stellenweise zum Schmelzen bringen.[71]
Bei der Verbrennung von Tetraethylblei entstehen Bleioxidpartikel, die eine fein verteilte heterogene Oberfläche bieten. Hydroperoxidradikale, die auf dieser Oberfläche adsorbiert werden, können nicht mehr an radikalischen Kettenreaktionen teilnehmen. Die dadurch erniedrigte Reaktionsgeschwindigkeit reicht aus, um die Selbstentzündung des bis dahin unverbrannten Gemischanteils zu unterdrücken und das Klopfen zu beseitigen.[72]
Von den 1920er-Jahren bis Anfang der 1960er-Jahre diente Tetraethylblei als Oktanzahlverbesserer für Benzine, das sogenannte „Bleibenzin“. Nachdem in den 1960er-Jahren die technischen Probleme bei der Herstellung von Tetramethylblei überwunden waren, wurde diese bleiorganische Verbindung ebenfalls in Mischung mit Tetraethylblei eingesetzt, typischerweise im Verhältnis 1 : 1. Alternativ können durch katalytische Ligandensubstitution der Alkylgruppen zwischen Tetraethylblei und Tetramethylblei gemischte Methyl-Ethyl-Bleiverbindungen synthetisiert werden. Diese wurden etwa unter dem Namen „Lead Mix 75“ vertrieben, einem Produkt der Ligandensubstitution von 75 Mol. % Tetramethylblei und 25 Mol. % Tetraethylblei.[73]
- mit n = 1 bis 3

Die Siedepunkte der Tetraalkylbleiverbindungen liegen zwischen 110 °C für Tetramethylblei und 200 °C für Tetraethylblei. Dies erlaubte die gezielte Verbesserung der Klopffestigkeit bestimmter Siedefraktionen. Benzin enthält annähernd 200 verschiedene aromatische und aliphatische Kohlenwasserstoffe unterschiedlicher Struktur und Molekülmasse, vom leichtflüchtigen Butan bis zu Aromaten mit zwölf Kohlenstoffatomen je Molekül. Die Flüchtigkeit der verschiedenen Komponenten beeinflusst die Tauglichkeit eines Kraftstoffs und muss der Jahreszeit entsprechend eingestellt werden. Die Anteile der verschiedenen Siedefraktionen lassen sich mittels Siedeanalyse bestimmen. Der unter 70 °C verdampfende Anteil bildet mit Luft leicht ein brennbares Gemisch und begünstigt das Kaltstartverhalten. Ein zu hoher Anteil an Leichtsiedern könnte im Sommer dagegen zu Dampfblasen im Kraftstoffsystem führen.[74] Aufgrund ihrer den Siedefraktionen angepassten Siedetemperatur ergeben die gemischten Tetraalkylbleiverbindungen häufig eine bessere Klopffestigkeit als Mischungen von Tetramethyl- und Tetraethylblei.[75]
| Antiklopfmittel | Siedepunkt in [°C] |
|---|---|
| Tetraethylblei | 200 |
| Triethylmethylblei | 179 |
| Diethyldimethylblei | 159 |
| Ethyltrimethylblei | 137 |
| Tetramethylblei | 110 |

Es zeigte sich schnell, dass der Einsatz von Tetraethylblei zu Ablagerung von Bleioxiden an Motorventilen und Zündkerzen führte. Daraufhin begann die Suche nach Additiven, welche die Bleioxide aus dem Motor entfernen konnten. Thomas Alwin Boyd stellte fest, dass 1,2-Dibromethan bei Zugabe zu dem Tetraethylblei enthaltenden Kraftstoff die Bildung von bleihaltigen Ablagerungen verhinderte. Das 1,2-Dibromethan reagierte mit den schwerflüchtigen Bleioxidkomponenten zu niedrigschmelzenden Bleihalogeniden wie etwa Blei(II)-bromid, das einen Schmelzpunkt von 373 °C aufweist. Dieses wird als Teil des Abgases emittiert.[76]
Schon das erste verkaufte bleihaltige Benzin enthielt bromierte organische Verbindungen, die als „Scavenger“, Spülmittel, bezeichnet wurden. Diese wurden dem Benzin zunächst zusammen mit chlorierten organischen Verbindungen wie Tetrachlorkohlenstoff zugesetzt. 1-Chlornaphthalin wurde zeitweise verwendet. Seit den 1940er-Jahren wurde 1,2-Dichlorethan als Scavenger eingesetzt. Für Motorenbenzin wird ein Molverhältnis von Pb : Cl : Br von 1 : 2 : 1 angestrebt.
Die Ethyl Corporation entwickelte 1957 mit (Methylcyclopentadienyl)mangantricarbonyl (MMT) ein weiteres Antiklopfmittel auf Metallbasis.[77] Dieses wurde ab den 1970er-Jahren, vor allem in den Vereinigten Staaten und Kanada, dem Benzin als Verstärker für Tetraethylblei zugesetzt. Die zugesetzten Mengen bewegten sich im Bereich von 8,3 Milligramm Mangan pro Liter für Motorenbenzin in den USA. In Kanada hatte das Benzin einen Durchschnittsgehalt von 12 Milligramm Mangan pro Liter.
Nach dem Verbot von Tetraethylblei in Kanada wurde dieses zwischen 1990 und 2003 vollständig von MMT als Antiklopfmittel ersetzt.[78] In Kanada verzichteten die Raffinerien ab 2003 freiwillig auf die Verwendung von MMT. Kalifornien verbot 1976 Manganzusätze im Benzin, Neuseeland 2002, in Japan wurde es nicht verwendet. In Deutschland war die Verwendung anderer Metallverbindungen und damit auch die von (Methylcyclopentadienyl)mangantricarbonyl durch das Benzinbleigesetz verboten.[39]
Schutz der Ventilsitze
Die durch die Verbrennung von Tetraethylblei entstehenden Bleioxide lagern sich zwischen Ventil und Ventilsitz ab und dämpfen damit die mechanische Belastung und den Verschleiß der Ventilsitze. Bei Fahrten unter längeren, schweren Fahrbedingungen ist eine Schädigung des Ventilsitzes durch die Verwendung von bleifreiem Benzin in Motoren ohne gehärtete Ventilsitze möglich. Unter normalen Fahrbedingungen tritt diese Schädigung nicht auf.[79]
Antiklopfmittel für Flugbenzin

In Flugbenzin ist Tetraethylblei immer noch ein legaler Zusatz und wird von Flugzeugen mit Ottomotor verwendet. Weltweit wird überwiegend die Sorte AvGas 100 LL mit einem Bleigehalt von 0,56 g Blei pro Liter verwendet. Die US-amerikanische Environmental Protection Agency schätzt, dass Avgas 2019 die Quelle für etwa 60 % der Blei-Aerosole in den Vereinigten Staaten war.[80] Da sowohl die bleihaltigen als auch die bleifreien Benzine dieselben Rohrleitungen in einer Erdölraffinerie nutzen, ist eine Menge von 0,013 Gramm im Liter, gemessen bei +15 °C, für dadurch kontaminierte Motorenbenzine zulässig.[39] Flugzeugbenzin enthält nur 1,2-Dibromethan als Scavenger, das Molverhältnis von Blei zu Brom beträgt hier 1 : 2.
Andere Anwendungen
Die metallorganische chemische Gasphasenabscheidung von Tetraethylblei und Tetraisopropylorthotitanat wurde zur Herstellung von phasenreinen Perowskit-Bleititanat (PbTiO3)-Dünnfilmen auf Quarzglas- und Platin-beschichteten Aluminiumoxidsubstraten angewendet.[81] Bleititanat ist eine technologisch wichtige Keramik, die beim Erreichen der Curie-Temperatur von 447 °C ferroelektrisch wird und eine tetragonale Struktur annimmt. Dieselbe Technik lässt sich zur Herstellung von Bleizirkonattitanatfilmen (PbZrxTi1−xO3) mit ausgezeichneten ferroelektrischen Eigenschaften verwenden.[82]
Weitere technische Anwendungen von Tetraethylblei sind aufgrund seiner Giftigkeit nicht bekannt. Der Einsatz von Tetraethylblei wurde bei Reaktionen erwogen, bei denen Ethylradikale typische Radikalreaktionen induzieren, etwa für die radikalische Polymerisation von Ethen.[83] Im Labormaßstab kann Tetraethylblei für metallorganische Reaktionen wie die Ligandensubstitution eingesetzt werden. Die Synthese von Ethylarsindichlorid kann durch Umsetzung von Tetraethylblei mit Arsen(III)-chlorid erfolgen.[84]
Die Verwendung von Tetraethylblei zur Herstellung von Alkylquecksilberverbindungen, die als Fungizide und Beizmittel eingesetzt werden, ist ebenfalls bekannt.[85] Der Einsatz von Tetraethylblei wurde in der Kohleverflüssigung durch direkte Hydrierung untersucht. Dabei wurde fast die gesamte Kohle in destillierbare Öl- und Gasfraktionen umgewandelt.[86]
Umweltrelevanz
Umweltverschmutzungen durch Tetraethylblei entstehen durch die Bodenkontamination mit bleihaltigem Benzin, mit Tetraethylblei selbst sowie mit Scavengern wie 1,2-Dibromethan und 1,2-Dichlorethan.[87][88] Durch die Havarie des jugoslawischen Frachtschiffs „Cavtat“ versanken 1974 etwa 320 Tonnen Tetraethylblei und Tetramethylblei in 900 Fässern in der italienischen Adria bei Otranto. Taucher einer auf Havarien spezialisierten Firma bargen die Fässer später.[89] Tetraethylblei verbrennt im Motor zu Bleioxochlorid und Bleioxobromid und anderen Bleiverbindungen. Etwa 75 % des Bleis wird an die Umgebung emittiert, ein Teil lagert sich am Abgaskrümmer und dem Auspuff ab.[32]
Tetraethylblei war weltweit die Hauptquelle für die Bleikontamination der Umwelt. Die Analyse der Bleikonzentration in den grönländischen Eisschichten zeigte, dass die Bleikonzentrationen nach 1940 verglichen mit den Werten von 800 vor Christus um das Zweihundertfache angestiegen ist. Geringere Konzentrationsanstiege zwischen dem 5. Jahrhundert vor Christus und dem 3. Jahrhundert nach Christus lassen sich auf die römische Bleiverarbeitung zurückführen.[90]
Es wird geschätzt, dass zwischen 1926 und 1985 in den Vereinigten Staaten über sieben Millionen Tonnen Blei dem Benzin als Tetraalkylblei zugesetzt, verbrannt und als Bleioxidpartikel emittiert wurden.[25] Allein in New Orleans lagerten sich etwa 10.000 Tonnen Blei ab, vor allem in der Nähe von vielbefahrenen Straßen. Mit Blei kontaminierter Boden bleibt eine saisonale Quelle der Blei-Exposition. Mit abnehmender Bodenfeuchtigkeit im Sommer und Herbst werden Blei-kontaminierte Stäube aufgewirbelt und eingeatmet.[80]
Zum Teil wurde spekuliert, dass das Waldsterben auf die toxische Wirkung des Triethylblei-Ions als Abbauprodukt von nicht vollständig verbranntem verbleiten Benzin zurückzuführen ist.[91] Die Vermutung ließ sich jedoch nicht bestätigen.
Emittiertes Blei gelangt aus der Umwelt über die Kontamination von Lebensmittel und der Nahrungsaufnahme wieder in den menschlichen Körper. So lagen 2005 die Bleikonzentrationen von getesteten Kakao- und Schokoladenprodukten bei 230 beziehungsweise 70 Nanogramm pro Gramm. Die Kontamination der Produkte wurde auf die Emissionen durch die Verbrennung von Tetraethylblei zurückgeführt, welches 2005 in den Kakaoanbaugebieten wie Nigeria noch als Antiklopfmittel verwendet wurde. Die Kontamination erfolgte nicht nur beim Anbau, sondern in der gesamten Verarbeitungskette der Schokoladenprodukte.[92] Hohe Bleikonzentrationen in Produkten, die vorwiegend an Kinder vermarktet werden, sind aufgrund der Anfälligkeit von Kindern für Bleivergiftungen besonders bedenklich. Der von der Codex-Alimentarius-Kommission vorgeschlagene maximal zulässige Bleigehalt beträgt nur 0,1 Nanogramm pro Gramm für Kakaobutter.[92]

Die Bodenkontamination mit bleihaltigen Benzin erfolgt etwa durch Leckagen von Untergrundtanks. In den 1960er-Jahren gab es in den Vereinigten Staaten mehr als 200.000 Tankstellen, von denen im Laufe der Jahre viele aufgegeben wurden. Viele dieser Tankstellen besaßen mehrere Untergrundtanks. Leckagen treten bei alten Untergrundtanks recht häufig auf, laut der Environmental Protection Agency sind in den Vereinigten Staaten mehr als 400.000 Freisetzungen von verbleiten Benzin aktenkundig.[93]
Bei der Verbrennung der Scavenger entsteht unter anderem auch Brommethan. Brommethan unterliegt in der Atmosphäre leicht der Photolyse, wobei Bromradikale freigesetzt werden, die für den Abbau des stratosphärischen Ozons verantwortlich sind. Als solches unterliegt es den Ausstiegsanforderungen des Montrealer Protokolls über Ozon abbauende Substanzen.[94]
Durch die Verbrennung von chlorierten Scavengern ist die Entstehung und die Emission von polychlorierten Dibenzodioxinen und Dibenzofuranen möglich. Aufgrund der Vielfalt und Anzahl der Fahrzeuge, deren technischer Ausstattung und die Schwierigkeiten beim Nachweis unter verschiedenen Umweltbedingungen ist die Höhe der Emissionen jedoch unklar.[95] Bei Tests unter kontrollierten Bedingungen konnten verschiedene polychlorierte Dibenzodioxine und Dibenzofurane im Motoröl nachgewiesen werden.[96]
Toxikologie

Blei ist ein natürlicher Bestandteil der Erdkruste, der durchschnittliche Gehalt beträgt etwa 0,0018 %.[97] Bleiverbindungen sind oft schon in geringer Menge giftig; Blei ist ein kumulatives Nervengift mit schwerwiegenden negativen Auswirkungen auf das Nerven-, Kreislauf-, Fortpflanzungs-, Nieren- und Verdauungssystem, wobei erst bei der Überschreitung eines Schwellenwerts Symptome auftreten. Seine Toxizität war bereits in vorchristlicher Zeit bekannt und dokumentiert. So berichtete der griechische Arzt und Dichter Nikandros aus Kolophon um 250 vor Christus über Koliken und Anämien durch Bleivergiftungen.[98] Pedanios Dioskurides beschrieb im ersten Jahrhundert nach Christus die neurotoxischen Eigenschaften von Blei, wobei er feststellte, dass „durch Blei der Verstand nachlässt“.[99]
Die Römer verwendeten Blei und seine Verbindungen vielfältig. Sie setzten Bleipressen bei der Weinherstellung ein und konservierten Wein mit Defrutum, einem Traubensaftkonzentrat, das in Bleigefäßen eingekocht wurde. Sie benutzten bleihaltiges Geschirr und die Aquädukte waren zum Teil mit Blei ausgekleidet. Die neurotoxischen Effekte der daraus resultierenden Bleibelastung leisteten mutmaßlich einen Beitrag zum Niedergang des Römischen Reiches.[99]
In späteren Jahrhunderten waren vor allem bestimmte Berufsgruppen von Bleivergiftungen betroffen, wie Maler, Schriftsetzer oder Beschäftigte in der Keramikindustrie. Diese Berufsgruppen nahmen das Blei durch Einatmen von bleihaltigem Staub oder durch den Verzehr von mit Blei verunreinigten Lebensmitteln auf.[99] Durch die Einführung von Tetraethylblei als Antiklopfmittel im Jahr 1922 erreichten die Bleiemissionen eine neue Größenordnung. In etwas mehr als sieben Jahrzehnten verteilten Fahrzeuge in aller Welt mehrere Millionen Tonnen Blei, insbesondere in Städten und entlang von Hauptstraßen. Die britische Tageszeitung The Guardian nannte 2018 die Verwendung von Tetraethylblei in Motorenbenzin „das mit Sicherheit größte Massenvergiftungsexperiment aller Zeiten“.[100]
Vergiftungen mit Tetraethylblei

Tetraethylblei ist hochgiftig, die Aufnahme weniger Milliliter reicht aus, um eine schwere Vergiftung beim Menschen auszulösen. Aufgrund seiner Lipophilie kann Tetraethylblei die Blut-Hirn-Schranke leicht überwinden und sich im limbischen System, im Frontallappen und im Hippocampus ansammeln und eine akute Vergiftung verursachen. Die Letale Dosis für Tetraethylblei wurde im Tierversuch bei der Ratte bei intragastrischer Applikation mit 14,18 mg/kg bestimmt.[101] Vergiftungen treten beispielsweise durch Hautresorption, das Verschlucken oder infolge der Einatmung auf, etwa bei der Herstellung von Tetraethylblei, beim unsachgemäßen Umgang mit bleihaltigem Benzin oder durch Benzinschnüffeln.[102][103] Die Vergiftung mit Tetraethylblei verläuft gegenüber einer normalen Bleivergiftung meist akut und greift das Zentralnervensystem an.[104]
Die Symptome einer Tetraethylbleivergiftung sind unter anderem ein Abfall des Blutdrucks und der Körpertemperatur, Schlafstörungen, Kopfschmerzen, Bewegungsdrang, Überempfindlichkeit gegenüber auditorischen und taktilen Reizen, Appetitlosigkeit, Zittern, Halluzinationen, Psychosen und starke Aggressivität. Außerdem verursacht es einen starken Niesreiz.
Tetraethylblei wird in der Leber zum Triethylbleiion ((C2H5)3Pb+) gespalten, und danach weiter zum Diethylbleiion ((C2H5)2Pb2+), und ionischem Blei (Pb2+) metabolisiert.[105] Die eigentliche toxische Spezies ist das Triethylbleiion. Im Tierversuch wandelte sich nach 24 Stunden etwa die Hälfte des Tetraethylbleis zu diesem um. Der Körper scheidet das Blei über den Urin als Diethylbleiion und über den Kot als anorganisches Blei aus.[106] Tetraethylblei im unverbrannten Kraftstoff kann durch unkontrolliertes Verdampfen oder den nicht verwendungsgemäßen Gebrauch des Kraftstoffs zu Vergiftungen führen.
Vergiftungen über Partikel
Die durch die Verbrennung von verbleitem Benzin erzeugte Belastung durch Bleioxid- und Bleihalogenidpartikel löst normalerweise keine unmittelbare Bleivergiftung aus.[107] Das mit den Kraftfahrzeugabgasen emittierte Blei wird unmittelbar mit der Atemluft oder über Hautstaub und Nahrungsmittel aufgenommen. Bei Erwachsenen wird anorganisches Blei zu über 90 % in den Knochen gespeichert, die Halbwertszeit beträgt ungefähr 30 Jahre.[108]
Eine Reduzierung der Bleiemissionen aus Kraftfahrzeugen wirkt sich damit deutlich auf die Verringerung der Bleibelastung der Bevölkerung aus. Die toxische Wirkung von Blei beruht, soweit heute bekannt, auf der Inaktivierung verschiedener Enzyme. Daraus folgt eine Hemmung der Blutfarbstoffsynthese oder eine direkte Schädigung roter Blutkörperchen. Mit erhöhten Bleibelastungen sind Anämien sowie Schädigungen der Lungenreinigungsfunktion und verschiedener Stoffwechselprozesse in Verbindung zu bringen. Insbesondere wurden bei entsprechend hohen Bleibelastungen Funktionsstörungen im zentralen Nervensystem bei Kindern beobachtet, die zum Teil irreversibel sind.
Der durchschnittliche Blutbleigehalt US-amerikanischer Kinder lag 2013 bei 1,2 Mikrogramm pro Deziliter (µg/dl). In den Jahren 1976 bis 1980 lag der Durchschnittswert noch bei 15 μg/dl. Die Centers for Disease Control and Prevention legten 2012 einen Schwellenwert für den Blutbleigehalt von 5 μg/dl fest und halbierten damit das bis dahin geltende Interventionsniveau.[46] Als weitere Quellen für Bleikontaminationen wurde in den Vereinigten Staaten 1978 Blei in Anstrichmitteln, 1986 für Wasserleitungen und 1995 als Bestandteil des Lötzinns für Konservendosen verboten.[46][109] Die Centers for Disease Control and Prevention (CDC) haben ihre Kriterien für den Grenzwert der Bleikonzentration im Blut eines Kleinkindes, gemessen in Mikrogramm Blei pro Deziliter Blut, am 28. Oktober 2021 von 5 µg/dL auf 3,5 µg/dL gesenkt. Die Änderung gilt für Kinder im Alter von 1 bis 5 Jahren und könnte die Zahl der Kinder in dieser Altersgruppe, bei denen ein hoher Bleigehalt im Blut festgestellt wird, von etwa 200.000 auf etwa 500.000 verdoppeln.[110] Kinder mit sehr hohen Bleiwerten im Blut können möglicherweise eine Chelattherapie erhalten, um einen Teil des Bleis zu entfernen.
Bei Kindern im Vorschulalter wurde das Verhältnis der Bleiblutspiegel zu den kognitiven Fähigkeiten ermittelt. Obwohl die Bleigehalte unter den Kriterien für eine Bleivergiftung lagen, ergaben statistische Analysen, dass es eine Korrelation zwischen zunehmendem Bleigehalt und der Abnahme der allgemeinen kognitiven, verbalen und Wahrnehmungsfähigkeiten bestand.[111]
Kanzerogenität
Studien in den 1970er-Jahren verneinten einen Zusammenhang zwischen Bleiexposition und Krebssterblichkeit beim Menschen.[112] Spätere Untersuchungen in Bezug auf die Exposition gegenüber Autoabgasen zeigten jedoch, dass Personen, die in der Nähe einer viel befahrenen Straße lebten, ein höheres Krebsrisiko aufwiesen als Personen, die in einer verkehrsarmen Umgebung lebten. Diese Ergebnisse führten zu dem Verdacht, dass ein Zusammenhang zwischen dem Auftreten von Krebs und den emittierten Bleipartikeln besteht, womöglich in Kombination mit anderen krebserregenden Substanzen.[113]
Neuere Studien bejahen einen epidemiologischen Zusammenhang zwischen Bleiexposition und Krebsrisiko beim Menschen, wobei Blei allein möglicherweise nicht notwendig und ausreichend für die Auslösung von Krebs ist. Obwohl die biochemischen und molekularen Wirkungsmechanismen von Blei noch unklar sind, kann Blei mutmaßlich die beteiligten karzinogenen Ereignisse verstärken.[114] Die Internationale Agentur für Krebsforschung stufte Blei mittlerweile als mögliches menschliches Karzinogen (Gruppe 2B) und seine anorganischen Verbindungen als wahrscheinlich menschliches Karzinogen (Gruppe 2A) ein.[115]
Einfluss auf Kriminalitätsrate und den Intelligenzkoeffizienten

Verschiedene Studien kamen zu der Schlussfolgerung, dass eine Bleiexposition in der Kindheit zu aggressivem und kriminellem Verhalten führen kann. Untersuchungen in Chicago, Indianapolis, Minneapolis und anderen US-amerikanischen Großstädten zeigten einen engen statistischen Zusammenhang zwischen der Bleiexposition in der Kindheit und schwerer Körperverletzung mit einem zeitlichen Verzug von etwa 23 Jahren.[117] Obwohl die Befunde uneinheitlich sind, sprechen sie für eine Auswirkung der Bleiexposition auf Mordraten. Es scheint, dass das stufenweise Verbot von bleihaltigem Benzin ab den späten 1970er-Jahren im Zusammenhang mit einem Rückgang der Gewaltkriminalität ab den 1990er-Jahren steht.[118] Andere Untersuchungen fanden einen statistischen Zusammenhang zwischen der Bleiexposition in der Kindheit und dem Ausmaß, der Art und den Auswirkungen der Gewaltkriminalität in den Vereinigten Staaten mit den Daten des Uniform-Crime-Reporting-Programms (UCR), jedoch nicht mit den Daten des National Crime Victimization Surveys (NCVS).[119]
Einige Soziologen sahen im Anstieg der Kriminalitätsrate seit Beginn der 1960er-Jahre den Beginn einer Umkehr des langfristigen Kriminalitätsrückgangs.[120] Manche Kriminalitätshistoriker meinen, dass es sich dabei nur um eine kleine Abweichung des seit Jahrhunderten anhaltenden Trends des Rückgangs handelt und dass die Verschiebungen in den Idealen der Lebensführung eine Erklärung für einen langfristigen Rückgang zwischenmenschlicher Gewalt liefert.[121]
Neben den in vielen Studien vermuteten Zusammenhang zwischen bleiinduzierter Neurotoxizität und Aggressivität sowie Kriminalität sehen andere Studien einen Zusammenhang zwischen Bleiexposition und Intelligenzdefiziten, die sich von Kindheit bis Jugend manifestieren. So wurde die Konzentration von Blei im Boden gemessen, der in zentralen Lagen großer Städte mehr als das 100-fache des Wertes in ländlichen Gebieten betragen kann, und die Auswirkungen auf geistige und verhaltensbezogene Defizite bewertet.[122]
Kritiker beanstandeten jedoch das Design verschiedener epidemiologischen Studien. Weiterhin bemängelten sie die Möglichkeit der Stichprobenverzerrung sowie die ungenügende Beurteilung der analytischen Schwierigkeiten bei der Messung der Bleibelastung des Körpers sowie bei der Messung des Intelligenzquotienten eines Kindes. Darüber hinaus beurteilten sie den Einsatz statistischer Analysetechniken und den Umfang vieler Studien als unzureichend.[123]
Nachweis
Für die Bestimmung von Tetraethylblei im Benzin sind mehrere Verfahren entwickelt worden. Die Standardanalysenmethoden basieren auf der Atomabsorptionsspektrometrie. Dazu werden die Tetraalkylbleiverbindungen zum Beispiel mit Tetrachlorkohlenstoff extrahiert und mit Salpetersäure oxidiert, wobei das Blei anschließend im Graphitrohr bestimmt wird. Zum Nachweis geringer Mengen Blei sind die US-amerikanische Methode ASTM D3237 (Standard Test Method for Lead in Gasoline by Atomic Absorption Spectroscopy) oder die DIN EN 237 (Flüssige Mineralölerzeugnisse – Ottokraftstoff – Bestimmung von niedrigen Bleigehalten durch Atomabsorptionsspektrometrie) anwendbar. Das Verfahren eignet sich für die Bestimmung von Blei in Wasser, Luft und biologischen Material.[124]
Ein weiteres gebräuchliches Standardverfahren war das Iodmonochlorid-Verfahren, das in der DIN EN ISO 3830 beschrieben ist.[125] Mittels Röntgenfluoreszenzanalyse lassen sich neben Tetraethylblei auch Scavenger wie 1,2-Dibromethan bestimmen, wobei die Bleikonzentration in einem Bereich von 0,02 bis 0,24 Gew.-% liegen können.[126]
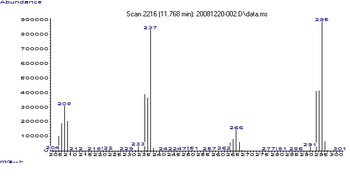
Durch Gaschromatographie, gekoppelt mit Massenspektrometrie, lassen sich die verschiedenen Bleialkyle nebeneinander bestimmen.[127][128] Das Massenspektrum von Tetraethylblei weist 64 Peaks auf, von denen die Peaks mit einem Masse-zu-Ladung-Verhältnis von 237 für (C2H5)208Pb, 295 für (C2H5)3208Pb und 208 für 208Pb die intensivsten sind.[129]
Die Bestimmung von Tetraethylblei kann ebenfalls durch die Zersetzung mittels Iod und anschließender Titration mit Kaliumchromat erfolgen.[130]
Als weitere Methode wurde die Bestimmung mittels Ethylendiamintetraessigsäure-Titration nach Oxidation des Tetraethylbleis mit Schwefelsäure und Salpetersäure entwickelt. Dabei wird das Blei als Blei(II)-sulfat gefällt und anschließend mit Ammoniumtartrat wieder in Lösung überführt. Die Titration erfolgt unter Verwendung von Eriochromschwarz T als Indikator bei einem pH-Wert von 10.[131]
Im Infrarotspektrum zeigt Tetraethylblei bei einer Wellenzahl von 240 cm–1 eine starke Bande, die der Pb-C-C-Biegeschwingung zugeordnet wird, sowie zwei moderate Banden bei Wellenzahlen von 132 und 86 cm–1, die der C-Pb-C-Biegeschwingung zugeordnet werden.[132]
Eine schnelle Methode ohne Probenvorbehandlung zur Bestimmung von Blei in Benzin bietet die Atomemissionsspektrometrie. Die Empfindlichkeit der Methode liegt bei etwa 0,25 Mikroliter Tetraethylblei pro Liter Benzin. Für Routinebestimmungen ist eine Genauigkeit von 2,5 Mikroliter pro Liter möglich.[133]
Der quantitative Nachweis von Tetraethylblei im Benzin ist durch die Lösung einer Probe in wasserfreiem Ethylenglycolmonoethylether und anschließender Reaktion mit Chlorwasserstoff möglich, wobei sich die entstehenden Bleiionen durch Polarographie direkt nachweisen lassen. Die Nachweisgrenze liegt bei etwa 0,13 mL/L.[134]
Literatur
- Magda Lovei: Phasing out lead from gasoline: worldwide experience and policy implications. World Bank technical paper no. 397, ISBN 0-8213-4157-X.
- Dietmar Seyferth: The Rise and Fall of Tetraethyllead. Part 1. In: Organometallics. 22, 2003, S. 2346–2357, doi:10.1021/om030245v.
- Dietmar Seyferth: The Rise and Fall of Tetraethyllead. Part 2. In: Organometallics. 22, 2003, S. 5154–5178, doi:10.1021/om030621b.
Weblinks
Einzelnachweise
- ↑ a b c Eintrag zu Tetraethylblei. In: Römpp Online. Georg Thieme Verlag, abgerufen am 17. Juli 2014.
- ↑ a b c d e f g h i j Eintrag zu Tetraethylblei in der GESTIS-Stoffdatenbank des IFA, abgerufen am 21. August 2018. (JavaScript erforderlich)
- ↑ a b Datenblatt Tetraethyllead bei Sigma-Aldrich, abgerufen am 24. April 2011 (PDF).
- ↑ Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag lead alkyls im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ a b Eintrag in der SVHC-Liste der Europäischen Chemikalienagentur, abgerufen am 14. April 2022.
- ↑ Eintrag im Verzeichnis der zulassungspflichtigen Stoffe der Europäischen Chemikalienagentur, abgerufen am 14. April 2022.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 78-00-2 bzw. Tetraethylblei), abgerufen am 2. November 2015.
- ↑ a b c d e f Dietmar Seyferth: The Rise and Fall of Tetraethyllead. 1. Discovery and Slow Development in European Universities, 1853–1920. In: Organometallics. 22, 2003, S. 2346–2357, doi:10.1021/om030245v.
- ↑ Edward Frankland, In: Liebigs Annalen der Chemie und Pharmacie, 71, 1849, S. 213.
- ↑ Edward Frankland: On the isolation of the organic radicals. In: J. Chem. Soc., 2, 1850, S. 263.
- ↑ Reinhard Seifert: Die Ära Gottlieb Daimlers: Neue Perspektiven zur Frühgeschichte des Automobils und seiner Technik. Vieweg und Teubner Research, Wiesbaden, ISBN 978-3-8348-0962-9, S. 32.
- ↑ a b c d e f g Dietmar Seyferth: The Rise and Fall of Tetraethyllead. 2. In: Organometallics. 22, 2003, S. 5154–5178, doi:10.1021/om030621b.
- ↑ a b c Alan P. Loeb: Birth of the Kettering Doctrine: Fordism, Sloanism and the Discovery of Tetraethyl Lead. In: Business and Economic History, Vol. 24, No. 1, Papers presented at the forty-first annual meeting of the Business History Conference (Fall 1995), S. 72–87.
- ↑ Patent US1639947A: Art of making metallo-organic compounds. Veröffentlicht am 13. April 1923, Erfinder: Charles A Kraus, Conrad C. Callis.
- ↑ Homepage der Ethyl Corporation.
- ↑ Tom McCarthy: Auto Mania: Cars, Consumers, and the Environment. Yale University Press, New Heaven, London, 2007, ISBN 978-0-300-11038-8, S. 49.
- ↑ a b c d Bleiköpfe. In: Markt für klassische Automobile und Motorräder. 5/1988, S. 178–181.
- ↑ Gerald Markowitz, David Rosner: Deceit and Denial: The Deadly Politics of Industrial Pollution. University of California Press, Berkeley, Los Angeles, London, 2002, ISBN 0-520-24063-4, S. 25.
- ↑ a b c d M. Mosimann, M. Breu, T. Vysusil, S. Gerber: Vom Tiger im Tank – Die Geschichte des Bleibenzins. In: GAIA. 2002, 11, S. 203–212, doi:10.14512/gaia.11.3.12 (PDF).
- ↑ a b c W. Kovarik: Ethyl-leaded gasoline: how a classic occupational disease became an international public health disaster. In: Int J Occup Environ Health. 11. Jahrgang, Nr. 4, 2005, S. 384–97, doi:10.1179/oeh.2005.11.4.384, PMID 16350473 (radford.edu ( des vom 11. Juli 2014 im Internet Archive)).
- ↑ a b Colleen F. Moore: Children and Pollution. Why Scientists Disagree. Oxford University Press, 2009, ISBN 978-0-19-538666-0, S. 6.
- ↑ Deborah Blum: Looney Gas and Lead Poisoning: A Short, Sad History. In: Wired.com, 5. Januar 2013.
- ↑ Stanton P. Nickerson: Tetraethyl lead: A product of American research. In: Journal of Chemical Education. 31, 1954, S. 560–571, doi:10.1021/ed031p560.
- ↑ C.F.Kettering: Thomas Midgley, jr.: An Appreciation. In: Science. 100, 1944, S. 562–564, doi:10.1126/science.100.2608.562.
- ↑ a b c Jerome O. Nriagu: The rise and fall of leaded gasoline. In: Science of the Total Environment. 92, 1990, S. 13–28.
- ↑ Jacques R. Pauwels: Profits „Über Alles!“ American Corporations and Hitler. In: Labour/Le Travail, 51, 2003, S. 223–249.
- ↑ Charles G. Moseley: Eugene Houdry, catalytic cracking and World War II aviation gasoline. In: Journal of Chemical Education, 61, 1984, S. 655.
- ↑ Joseph Borkin: Die unheilige Allianz der I.G.-Farben. Eine Interessengemeinschaft im Dritten Reich. Campus, Frankfurt am Main 1990, ISBN 3-593-34251-0, S. 76.
- ↑ Rainer Karlsch, Raymond G. Stokes: Faktor Öl. Die Mineralölwirtschaft in Deutschland 1859–1974. C. H. Beck, München, 2003, ISBN 3-406-50276-8, S. 187.
- ↑ Wolfgang Birkenfeld: Der synthetische Treibstoff 1933–1945. Ein Beitrag zur nationalsozialistischen Wirtschafts- und Rüstungspolitik. Göttingen, Berlin, Frankfurt: Musterschmidt 1964, S. 64.
- ↑ Stacy Cagle Davis, Robert Gary Boundy: Transportation Energy Data Book. Edition 38. No. ORNL/TM-2019/1333. Oak Ridge National Lab.(ORNL), Oak Ridge, Tennessee 37831-6073 (United States), 2020. U.S. Department of Energy, Contract No. DE-AC05-00OR22725.
- ↑ a b Drucksache 11/4023 vom 17.02.89, Antwort der Bundesregierung auf die Kleine Anfrage der Abgeordneten Frau Garbe, Brauer, Frau Rock, Weiss (München) und der Fraktion DIE GRÜNEN: Gifte im Benzin (I), Drucksache 11/3843.
- ↑ Neue Vergaserkraftstoffe. In: Kraftfahrzeugtechnik. Nr. 8/1965, S. 317.
- ↑ Mike McPhate: When L.A. smog was so bad people suspected a gas attack. In: California Sun, 9. Juli 2018.
- ↑ a b c d e Herbert L. Needleman: The Removal of Lead from Gasoline: Historical and Personal Reflections. In: Environmental Research. 84, 2000, S. 20–35, doi:10.1006/enrs.2000.4069.
- ↑ a b Jerome O. Nriagu: Clair Patterson and Robert Kehoe’s Paradigm of “Show Me the Data” on Environmental Lead Poisoning. In: Environmental Research. 78, 1998, S. 71–78, doi:10.1006/enrs.1997.3808.
- ↑ William Kovarik: Ethyl-leaded Gasoline: How a Classic Occupational Disease Became an International Public Health Disaster. In: International Journal of Occupational and Environmental Health. 11, 2013, S. 384–397, doi:10.1179/oeh.2005.11.4.384.
- ↑ Magda Lovei: Phasing out lead from gasoline: worldwide experience and policy implications. World Bank technical paper no. 397, ISBN 0-8213-4157-X, S. 7.
- ↑ a b c Text des Benzinbleigesetzes
- ↑ Die erste Anti-Klopfmittel-Fabrik. In: Chemie Ingenieur Technik, 38, 8, 1965, S. 692.
- ↑ Fritz Kalberlah, Markus Schwarz, Dirk Bunke, Roland Augustin, Reinhard Oppl: Karzinogene, mutagene, reproduktionstoxische (CMR) und andere problematische Stoffe in Produkten Identifikation relevanter Stoffe und Erzeugnisse, Überprüfung durch Messungen, Regelungsbedarf im Chemikalienrecht. 18/2011, im Auftrag des Umweltbundesamts.
- ↑ United Nations Environmental Program: The Lead Campaign.
- ↑ Ian Johnston: UK company sells lead to last place on Earth where leaded petrol is legal. In: The Independent, 22. August 2017.
- ↑ Der Spiegel: 25 Jahre nach Aus in Deutschland: Verbleites Benzin am Ende – letzter Tropfen vertankt. Abgerufen am 2. September 2021.
- ↑ Viv Bernstein: Nascar Plans to Switch to Unleaded Fuel in '08. In: The New York Times, 20. Januar 2006.
- ↑ a b c R. Kessler: Sunset for leaded aviation gasoline? In: Environmental health perspectives. Band 121, Nummer 2, Februar 2013, S. a54–a57, doi:10.1289/ehp.121-a54, PMID 23380048, PMC 3569701 (freier Volltext).
- ↑ AvGas als Flugbenzin, abgerufen am 20. Januar 2023.
- ↑ Gmelin Handbook of Inorganic Chemistry, Organo Lead Compounds, Part 2, Springer, Berlin, Heidelberg, 8th Edition, 1990, ISBN 978-3-662-10293-0, S. 20.
- ↑ a b c d Friedrich Asinger: Chemie und Technologie der Paraffin-Kohlenwasserstoffe. Akademie Verlag, 1956, S. 241–243.
- ↑ Patent USUS1622228A: Process of making organic lead compounds. Veröffentlicht am 19. Mai 1923, Erfinder: Thomas Midgley Jr..
- ↑ Patent USUS2635106A: Process for making tetraethyl lead. Veröffentlicht am 25. Oktober 1951, Erfinder: Shapiro Hymin, Earl G. De Witt.
- ↑ a b Robert W. Leeper, Lawrence Summers, Henry Gilman: Organolead Compounds. In: Chemical Reviews. 54, 1954, S. 101–167, doi:10.1021/cr60167a004.
- ↑ Klaus Weissermel, Hans-Jürgen Arpe: Industrial Organic Chemistry: Important Raw Materials and Intermediates. Wiley-VCH Verlag, Weinheim, 2003, ISBN 3-527-30578-5, S. 198.
- ↑ Christoph Janiak, T. M. Klapötke, H.-J. Meyer, E. Riedel: Moderne Anorganische Chemie. 2. Aufl., de Gruyter, Berlin, 2004, ISBN 978-3-11-044160-4, S. 656–658.
- ↑ Christoph Elschenbroich: Organometallchemie, 3. Auflage, Teubner, Stuttgart, 1993, ISBN 978-3-519-33501-6, S. 171–178.
- ↑ George A. Hay: Facilitating Practices: The Ethyl Case (1984). In: John E. Kwoka; Lawrence J. White: The antitrust revolution: economics, competition, and policy. Oxford University Press, New York, 1999, ISBN 978-0-19-512015-8, S. 182–201.
- ↑ Ionel Haiduc, Jerry J. Zuckerman: Basic Organometallic Chemistry. Walter de Gruyter, Berlin, New York, 1985, ISBN 3-11-007184-3, S. 174–176.
- ↑ a b c A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1028–1029.
- ↑ Frederick W. Frey, Shirl E. Cook: The Synthesis of Tetraethyllead by Reaction of Tetravalent Lead Salts with Triethylaluminum and Other Ethyl Metal Compounds. In: Journal of the American Chemical Society. 82, 1960, S. 530–533, doi:10.1021/ja01488a008.
- ↑ R. Galli: The formation of tetraethyllead by electrochemical reduction of ethyl bromide. In: Journal of Electroanalytical Chemistry and Interfacial Electrochemistry. 22, 1969, S. 75–84, doi:10.1016/S0022-0728(69)80148-8.
- ↑ R. Duffy, J. Feeney, A. K. Holliday: 219. Trialkylplumbanes. Part II. Some properties of trimethyl- and triethyl-plumbane. In: Journal of the Chemical Society. 1962, S. 1144–1147, doi:10.1039/JR9620001144.
- ↑ Thomas E. Daubert: Physical and thermodynamic properties of pure chemicals: data compilation. Design Institute for Physical Property Data (DIPPR), 1989.
- ↑ a b L. A. K. Staveley, H. P. Paget, B. B. Goalby, J. B. Warren: 470. Polymorphism in tetraethyl-tin and -lead. In: Journal of the Chemical Society. 1950, S. 2290–2301, doi:10.1039/JR9500002290.
- ↑ Ionel Haiduc, Jerry J. Zuckerman: Basic Organometallic Chemistry. Walter de Gruyter, Berlin, New York, 1985, ISBN 3-11-007184-3, S. 3.
- ↑ W. P. Neumann, K. Kühlein: Recent Developments in the Organic Chemistry of Lead: Preparations and Reaction of Compounds with Pb–C, Pb–H, Pb–N and Pb–O Bond. In: F. G. A. Stone, R. West: Advances in Organometallic Chemistry, Vol. 7, Academic Press, New York, London, 1968, ISBN 978-0-12-031107-1, S. 242–303.
- ↑ Gregory P. Smith, Roger Patrick: Pyrolysis studies of main group metal-alkyl bond dissociation energies: VLPP of GeMe4, SbEt3, PbEt4, and PEt3. In: International Journal of Chemical Kinetics. 15, 1983, S. 167–185, doi:10.1002/kin.550150207.
- ↑ Fritz Paneth, Karl Herzfeld: Über freies Methyl und freies Äthyl. In: Zeitschrift für Elektrochemie und angewandte physikalische Chemie, 37, S. 577–582 (1931). doi:10.1002/bbpc.19310370834.
- ↑ Rolf Gelius: Reaktionen von Organobleiderivaten mit Schwefelverbindungen. III. Die Umsetzung von Tetraäthyl- und Tetramethylblei mit Schwefeldioxid. In: Zeitschrift für anorganische und allgemeine Chemie. 349, 1967, S. 22–32, doi:10.1002/zaac.19673490104.
- ↑ Gary A. Downing, Christopher S. Frampton, James H. Gall, David D. MacNicol: Octakis(3,4-dimethylphenylthio)naphthalene: A Designed Spider Host of Unparalled Versatility. In: Angewandte Chemie International Edition in English. 35, 1996, S. 1547–1549, doi:10.1002/anie.199615471.
- ↑ Jürgen Warnatz, Ulrich Maas, Robert W. Dibble: Motorklopfen. In: Verbrennung. Springer, Berlin, Heidelberg, 2001, ISBN 978-3-642-62658-6, S. 247–258.
- ↑ Fred Schäfer, Richard van Basshuysen (Hrsg.): Handbuch Verbrennungsmotor, Grundlagen · Komponenten · Systeme · Perspektiven, 8. Auflage, Springer, Wiesbaden 2017, ISBN 978-3-658-10901-1, S. 729.
- ↑ Jürgen Wolfrum (Hrsg.): Gas phase chemical reaction systems: experiments and models 100 years after Max Bodenstein. Springer, Berlin, Heidelberg, New York, 1995, ISBN 978-3-642-80301-7, S. 285.
- ↑ R. Perry, C. DiPerna, D. Heath: Tetramethyl lead an Antiknock for better Road Performance. SAE Technical Paper 600141, 1960, doi:10.4271/600141.
- ↑ Christian Jentsch: Unverbleite Ottokraftstoffe. In: Chemie in unserer Zeit. 20, 1986, S. 105–110, doi:10.1002/ciuz.19860200402.
- ↑ a b J. Riggs: Mixed lead alkyls; volatile and selective antiknocks. 6th World Petroleum Congress, 19-26 June, Frankfurt am Main, Germany, WPC-10506, 1963.
- ↑ V. M. Thomas, J. A. Bedford, R. J. Cicerone: Bromine emissions from leaded gasoline. In: Geophysical Research Letters. 24.11, 1997, S. 1371–1374, doi:10.1029/97GL01243.
- ↑ J. E. Brown, W. G. Lovell: A New Manganese Antiknock. In: Industrial & Engineering Chemistry. 50, 1958, S. 1547–1550, doi:10.1021/ie50586a035.
- ↑ Alexandre Joly, Jean Lambert, Claude Gagnon, Greg Kennedy, Donna Mergler, Ariane Adam-Poupart, Joseph Zayed: Reduced Atmospheric Manganese in Montreal Following Removal of Methylcyclopentadienyl Manganese Tricarbonyl (MMT). In: Water, Air & Soil Pollution. 219, 2011, S. 263–270, doi:10.1007/s11270-010-0704-6.
- ↑ V. M. Thomas: The Elimination of Lead in Gasoline. In: Annual Review of Energy and the Environment. 20, 1995, S. 301–324, doi:10.1146/annurev.eg.20.110195.001505.
- ↑ a b Howard W. Mielke, Christopher R. Gonzales, Eric T. Powell: Curtailing Lead Aerosols: Effects of Primary Prevention on Declining Soil Lead and Children’s Blood Lead in Metropolitan New Orleans. In: International Journal of Environmental Research and Public Health. 16, 2019, S. 2068, doi:10.3390/ijerph16122068.
- ↑ S. L. Swartz, D. A. Seifert, G. T. Noel, T. R. Shrout: Characterization of MOCVD PbTiO3 thin films. In: Ferroelectrics. 93, 1989, S. 37–43, doi:10.1080/00150198908017318.
- ↑ M. De Keijser, G. J. M. Dormans, P. J. Van Veldhoven, P. K. Larsen: High quality lead zirconate titanate films grown by organometallic chemical vapour deposition. In: Integrated Ferroelectrics. 3, 2006, S. 131–137, doi:10.1080/10584589308216707.
- ↑ P. L. Kooijman, W. L. Ghijsen: Investigations concerning polymerization of propene and ethene induced by tetraethyl lead. In: Recueil des Travaux Chimiques des Pays-Bas. 66, 1947, S. 247–256, doi:10.1002/recl.19470660411.
- ↑ M. S. Kharasch, Elwood V. Jensen, Sidney Weinhouse: Alkylation Reactions of Tetraethyllead. A New Synthesis of Ethyldichloroarsine and related Compounds. In: The Journal of Organic Chemistry. 14, 1949, S. 429–432, doi:10.1021/jo01155a014.
- ↑ George Calingaert, Harold A. Beatty, Harold Soroos: The Redistribution Reaction. V. R4Pb Compounds. In: Journal of the American Chemical Society. 62, 1940, S. 1099–1104, doi:10.1021/ja01862a030.
- ↑ Moetaz I. Attalla, Robinson A. Quezada, Anthony M. Vassallo, Michael A. Wilson: Tetraethyl lead as a coal liquefaction promoter. In: Fuel. 71, 1992, S. 401–407, doi:10.1016/0016-2361(92)90029-N.
- ↑ Ronald W. Falta, N. Bulsara, J. K. Henderson, R. A. Mayer: Leaded-gasoline additives still contaminate groundwater. In: Environ Sci. Technol. 39, 2005, S. 378A-384A, PMID 16201608; doi:10.1021/es053352k.
- ↑ Ronald W. Falta: The Potential for Ground Water Contamination by the Gasoline Lead Scavengers Ethylene Dibromide and 1,2-Dichloroethane. In: Ground Water Monitoring & Remediation. 24, 2004, S. 76–87, doi:10.1111/j.1745-6592.2004.tb01294.x.
- ↑ Jacques Cousteau, Susan Schiefelbein: Der Mensch, die Orchidee und der Oktopus: Mein Leben für die Erforschung und Bewahrung unserer Umwelt. Campus Verlag, Frankfurt, New York, 2008, ISBN 978-3-593-38564-8, S. 135–137.
- ↑ M. Murozumi, Tsaihwa J Chow, C. Patterson: Chemical concentrations of pollutant lead aerosols, terrestrial dusts and sea salts in Greenland and Antarctic snow strata. In: Geochimica et Cosmochimica Acta. 33, 1969, S. 1247–1294, doi:10.1016/0016-7037(69)90045-3.
- ↑ H. Faulstich, Chr. Stournaras: Verursacht Triethylblei unsere Waldschäden? In: Naturwiss. Rundsch., 37, 1984, S. 398–401.
- ↑ a b Charley W. Rankin, Jerome O. Nriagu, Jugdeep K. Aggarwal, Toyin A. Arowolo, Kola Adebayo, A. Russell Flegal: Lead Contamination in Cocoa and Cocoa Products: Isotopic Evidence of Global Contamination. In: Environmental Health Perspectives. 113, 2005, S. 1344–1348, doi:10.1289/ehp.8009.
- ↑ Gil Oudijk: The Use of Alkyl Leads in Gasoline Age-Dating Investigations: New Insights, Common Investigative Techniques, Limitations, and Recommended Practices. In: Environmental Claims Journal. 19, 2007, S. 68–87, doi:10.1080/10406020601158329.
- ↑ B. Ramacher, J. Rudolph, R. Koppmann: Hydrocarbon measurements during tropospheric ozone depletion events: Evidence for halogen atom chemistry. In: Journal of Geophysical Research: Atmospheres. 104, 1999, S. 3633–3653, doi:10.1029/1998JD100061.
- ↑ R. Smit, K. Zeise, A. Caffin, P. Anyon: Dioxins Emissions from Motor Vehicles in Australia. In: National Dioxins Program Technical Report No. 2, P, 2004, Department of the Environment and Heritage, Canberra, ISBN 0-642-54994-X.
- ↑ Stellan Marklund, Christoffer Rappe, Mats Tysklind, Karl-Erik Egebäck: Identification of polychlorinated dibenzofurans and dioxins in exhausts from cars run on leaded gasoline. In: Chemosphere. 16, 1987, S. 29–36, doi:10.1016/0045-6535(87)90105-6.
- ↑ Hans Breuer: Allgemeine und anorganische Chemie. (= dtv-Atlas Chemie. Band 1). 9. Auflage. dtv, München 2000, ISBN 3-423-03217-0, S. 151.
- ↑ Herbert L. Needleman, David Gee: Lead in petrol makes the mind „give way“. Late lessons from early warnings: science, precaution, innovation. Copenhagen, European Environment Agency, 2013.
- ↑ a b c Herbert L. Needleman: History of lead poisoning in the world. Vortrag auf der International Conference on lead Poisoning Prevention and Treatment, Bangalore, 1999.
- ↑ Geoffrey Lean: Lead is even deadlier than we feared as the full extent of its toxic effects are revealed. In: The Guardian. 17. März 2018, abgerufen am 1. März 2020.
- ↑ T. Schroeder, D. D. Avery, H. A. Cross: The LD50 value of tetraethyl lead. In: Experientia. 28, 1972, S. 425–426, doi:10.1007/BF02008318.
- ↑ A.D Beattie, M.R Moore, A. Goldberg: Tetraethyllead-Poisoning. In: The Lancet. 300, 1972, S. 12–15, doi:10.1016/S0140-6736(72)91276-7.
- ↑ R. L. Boeckx, B. Postl, F. J. Coodin: Gasoline sniffing and tetraethyl lead poisoning in children. In: Pediatrics. 60.2, 1977, S. 140–145, PMID 887326.
- ↑ E. Oberdisse: Pharmakologie und Toxikologie, Springer, Berlin, Heidelberg, New York, 1999, ISBN 978-3-642-98031-2, S. 716–717.
- ↑ Z. Turlakiewicz, J. Chmielnicka: Diethyllead as a specific indicator of occupational exposure to tetraethyllead. In: British Journal of Industrial Medicine. Band 42, Nummer 10, Oktober 1985, S. 682–685, doi:10.1136/oem.42.10.682, PMID 4041386, PMC 1007558 (freier Volltext).
- ↑ Regine Gihr, Gerd Rippen: Ableitung eines vorläufigen Geringfügigkeitsschwellenwertes für Methyl- und Ethylbleiverbindungen (GFS Bleialkyle). Hessisches Landesamt für Geologie und Umwelt, 21. Oktober 2011, 31 Seiten.
- ↑ Rainer Braun, Günter Fred Fuhrmann, Wolfgang Legrum, Christian Steffen: Spezielle Toxikologie für Chemiker: Eine Auswahl toxischer Substanzen. Teubner Verlag, Stuttgart, Leipzig, 1999, ISBN 978-3-519-03538-1, S. 34–37.
- ↑ Ruth A. Lawrence, Christof Schaefer: Industrial chemicals and environmental contaminants. In: Christof Schaefer, Paul Peters, Richard K. Miller: Drugs During Pregnancy and Lactation. Treatment Options and Risk Assessment. Academic Press, 2015, ISBN 978-0-12-408078-2, S. 863–892.
- ↑ Food and Drug Administration, Department of Health and Human Services: Lead-Soldered Food Cans. In: Federal Register, Volume 60, Number 123 (27. Juni 1995), S. 33106–33109. FR Doc No: 95-15593.
- ↑ Blood lead reference value, abgerufen am 30. Oktober 2021.
- ↑ Joseph Perino, Claire B. Ernhart: The Relation of Subclinical Lead Level to Cognitive and Sensorimotor Impairment in Black Preschoolers. In: Journal of Learning Disabilities. 7, 2016, S. 616–620, doi:10.1177/002221947400701006.
- ↑ Michael R. Moore, Peter A. Meredith: The carcinogenicity of lead. In: Archives of Toxicology. 42, 1978, S. 87–94, doi:10.1007/BF00316488.
- ↑ W. Blumer, Th. Reich: Leaded gasoline — A cause of cancer. In: Environment International. 3, 1980, S. 465–471, doi:10.1016/0160-4120(80)90154-3.
- ↑ E. Silbergeld: Facilitative mechanisms of lead as a carcinogen. In: Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis. 533, 2003, S. 121–133, doi:10.1016/j.mrfmmm.2003.07.010.
- ↑ Julia García-Lestóna, Josefina Méndez, Eduardo Pásaroa, Blanca Laffona: Genotoxic effects of lead: An updated review. In: Environment International. 36, 6, 2010, S. 623–636, doi:10.1016/j.envint.2010.04.011.
- ↑ Bastian Herre, Fiona Spooner, Max Roser: Langzeittrend der Tötungsdelikte in Europa. In: ourworldindata.org. 26. Juni 2023, abgerufen am 27. März 2024.
- ↑ Howard W. Mielke, Bruce Blake, Sarah Burroughs, Nancy Hassinger: Urban lead levels in Minneapolis: The case of the Hmong children. In: Environmental Research. 34, 1984, S. 64–76, doi:10.1016/0013-9351(84)90076-8.
- ↑ Jessica Wolpaw Reyes: Environmental Policy as Social Policy? The Impact of Childhood Lead Exposure on Crime. In: The B.E. Journal of Economic Analysis & Policy. 7, 2007, doi:10.2202/1935-1682.1796.
- ↑ Janet L. Lauritsen, Maribeth L. Rezey, Karen Heimer: When Choice of Data Matters: Analyses of U.S. Crime Trends, 1973–2012. In: Journal of Quantitative Criminology. 32, 2016, S. 335–355, doi:10.1007/s10940-015-9277-2.
- ↑ Helmut Thome: Explaining Long Term Trends in Violent Crime. In: Crime, Histoire & Sociétés. 5, 2001, S. 69–86, doi:10.4000/chs.738.
- ↑ Manuel Eisner: Modernity strikes back? A historical perspective on the latest increase in interpersonal violence (1960–1990). In: International Journal of Conflict and Violence, 2008, S. 288–316.
- ↑ Howard W. Mielke, Sammy Zahran: The urban rise and fall of air lead (Pb) and the latent surge and retreat of societal violence. In: Environment International. 43, 2012, S. 48–55, doi:10.1016/j.envint.2012.03.005.
- ↑ Stuart J. Pocock, Deborah Ashby: Environmental Lead and Children’s Intelligence: A Review of Recent Epidemiological Studies. In: The Statistician. 34, 1985, S. 31–44, doi:10.2307/2987502.
- ↑ K. -H. Diehl, A. Rosopulo, W. Kreuzer: Bestimmung von Blei aus Tetraalkylbleiverbindungen mit Hilfe der AAS. In: Fresenius' Zeitschrift für analytische Chemie. 314, 1983, S. 755–757, doi:10.1007/BF00467109.
- ↑ Horst Czichos: Das Ingenieurwissen. Springer, Berlin, Heidelberg, 2012, ISBN 978-3-642-22849-0, S. 79.
- ↑ F. W. Lamb, L. M. Niebylski, E. W. Kiefer: Determination of Tetraethyllead in Gasoline by X-Ray Fluorescence. In: Analytical Chemistry. 27, 1955, S. 129–132, doi:10.1021/ac60097a042.
- ↑ H. E. Howard, W. C. Ferguson, L. R. Snyder: Determination of tetramethyllead and tetraethyllead in gasoline by mass spectrometry. In: Analytical Chemistry. 32, 1960, S. 1814–1815, doi:10.1021/ac50153a033.
- ↑ H. J. Dawson: Determination of Methyl-Ethyl Lead Alkyls in Gasoline by Gas Chromatography with an Electron Capture Detector. In: Analytical Chemistry. 35, 1963, S. 542–545, doi:10.1021/ac60197a001.
- ↑ Eintrag zu Tetraethylblei (Henry's Law data). In: P. J. Linstrom, W. G. Mallard (Hrsg.): NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg MD, abgerufen am 1. März 2020.
- ↑ B. E. Gordon, R. A. Burdett: Microdetermination of Tetraethyllead in Gasoline. In: Analytical Chemistry. 19, 1947, S. 137–140, doi:10.1021/ac60002a021.
- ↑ M. Brandt, R. H. Vanden Berg: Determination of Tetraethyllead in Gasoline by Titration with (Ethylenedinitrilo)tetraacetate. In: Analytical Chemistry. 31, 1959, S. 1921, doi:10.1021/ac60155a001.
- ↑ B. J. Aylett: Organometallic Compounds: The Main Group Elements. Chapman and Hall, London, 1979, ISBN 978-94-009-5731-2, S. 280–286.
- ↑ P. Gilbert: Determination of Tetraethyllead in Gasoline by Flame Photometry. In: Symposium on Flame Photometry, West Conshohocken, PA: ASTM International, 1952, S. 77–91, doi:10.1520/STP39248S.
- ↑ K. A. Hansen, T. D. Parks, Louis. Lykken: Rapid Polarographic Determination of Tetraethyllead in Gasoline. In: Analytical Chemistry. 22, 1950, S. 1232–1233, doi:10.1021/ac60046a003.
Auf dieser Seite verwendete Medien
Global harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS): Piktogramm für giftige / toxische Chemikalien
Globales Harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS) Piktogramm für gesundheitsgefährdende Stoffe.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
Autor/Urheber: User Stahlkocher on de.wikipedia, Lizenz: CC BY-SA 2.0
Aufgeschnittener metalkatalysator für ein Kfz, valuable earth elements
- 17:40, 25. Sep 2004 Stahlkocher 640 x 297 (43410 Byte) (Aufgeschnittener metalkatalysator für ein Kfz, {{Bild-CC-by-sa}})
Autor/Urheber: Mister Pommeroy, Lizenz: CC BY-SA 4.0
Long-term homicide rates across Western Europe; data taken from https://ourworldindata.org/homicides
Autor/Urheber: NadirSH, Lizenz: CC BY-SA 4.0
Symptome der Bleivergiftung
process flow diagram for the synthesis of tetraethyllead
Siedekurven von Benzinsorten. Bezeichnet die Temperatur, zu der ein prozentualer Anteil eines Kohlenwasserstoffgemisches verdampft (und wieder kondensiert). Der prozentuale Rest der nicht verdampft (und wieder kondensiert) ist 'Rückstand und Verlust'.
Spettrometro di Massa Agilent Tecnologies 5973, spettro di massa del Piombo tetraetile,
Autor/Urheber:
- IbaAirportjf9319_15.JPG: Ramon FVelasquez
- derivative work: MichaelFrey
AVGAS 100 LL Petron Leaded fuel 190 liters ASTM D 910-11 - Avgas[1] (aviation gasoline, also known as aviation spirit in the UK) is an aviation fuel used to power piston-engine aircraft. Avgas is distinguished from mogas (motor gasoline), which is the everyday gasoline used in cars and some non-commercial light aircraft. Unlike mogas from the mid-1970s era onward to allow the adoption of platinum-content catalytic converters for pollution reduction, avgas still contains tetraethyllead (TEL), a toxic substance used to enhance combustion stability. crew and pilots in identifying and distinguishing the fuel grades. 100LL The most commonly used aviation fuel is 100LL, that is, "low lead". It is dyed blue and contains a relatively small amount of tetraethyllead—though the amount is greater than what was contained in many automotive grades of leaded fuel before such fuel was phased out.
Autor/Urheber: Jynto (talk), Lizenz: CC0
Ball-and-stick model of the tetraethyllead molecule, the antiknock agent agent added to leaded petrol. It was the single cause of atmospheric lead pollution in the 20th century.
Colour code:
- Carbon, C: black
- Hydrogen, H: white
- Lead, Pb: blue-grey
Autor/Urheber:
- File:Otto-engine-all-strokes.png: MikeRun
- derivative work: Universalamateur
overview of all four Otto engine strokes.
Struktur von Tetraethylplumban
Autorenbild des griechischen Arztes Pedanios Dioskurides aus der mittelalterlichen Handschrift Medicina antiqua (Österreichische Nationalbibliothek: Codex Vindobonensis 93, fol. 133 recto).
Autor/Urheber:
16 December 2000, 12:00:19 Source originally posted to Flickr as Closed
Author Bart Everson, Lizenz: CC BY 2.0Closed gas station, December 2000 Jefferson, Louisiana. Oschener Hospital in background. Cutaway from original
Valenzstrukturformel von 1,2-Dibromethan
Départ de l'Indy 500 1923.
U.S. Senator Ed Muskie poses for a portrait photograph
Autor/Urheber: Plazak, Lizenz: CC BY-SA 3.0
Sign on an antique gasoline pump, advertising gasoline additive (tetraethyl lead) by the Ethyl Corporation. Photo taken at the highway rest stop on I-94 westbound, east of Bismarck, North Dakota, USA.
























