Blei(IV)-fluorid
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| _ Pb4+ _ F− | ||||||||||||||||
| Kristallsystem | tetragonal | |||||||||||||||
| Raumgruppe | I4/mmm (Nr. 139) | |||||||||||||||
| Gitterparameter | a 425,36 pm,c 806,4 pm, Z = 2 | |||||||||||||||
| Koordinationszahlen | [6]Pb | |||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Blei(IV)-fluorid | |||||||||||||||
| Andere Namen | Bleitetrafluorid | |||||||||||||||
| Verhältnisformel | PbF4 | |||||||||||||||
| Kurzbeschreibung | weißer Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 283,18 g·mol−1 | |||||||||||||||
| Aggregatzustand | fest[1] | |||||||||||||||
| Dichte | 6,7 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Blei(IV)-fluorid ist eine anorganische chemische Verbindung des Bleis aus der Gruppe der Fluoride.
Gewinnung und Darstellung
Blei(IV)-fluorid kann durch Reaktion von Blei(II)-fluorid oder Blei mit Fluor gewonnen werden.[2]
Eigenschaften
Blei(IV)-fluorid ist ein weißer, kristalliner Feststoff, der sehr empfindlich gegen Feuchtigkeit ist. Er färbt sich an feuchter Luft durch Bildung von Bleidioxid sofort braun.[2]
Diese Reaktion passiert auch in verdünnter Flusssäure, in konzentrierter Flusssäure (oder reinem Fluorwasserstoff) entsteht Bleifluoridsäure ("fluoroplumbic acid").
Auch die Salze dieser Säure sind darstellbar.
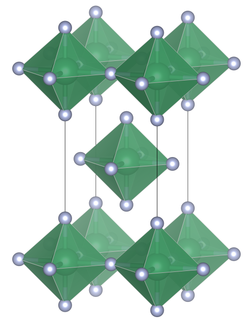
Blei(IV)-fluorid besitzt eine tetragonale Kristallstruktur mit der Raumgruppe I4/mmm (Raumgruppen-Nr. 139) [3] und den Gitterkonstanten a 425,36 pm,c 806,4 pm, sowie Z = 2. Die Verbindung besteht wie Zinn(IV)-fluorid aus PbF6-Oktaedern die über gemeinsame äquatoriale Brücken mit jeweils vier PbF6-Oktaedern zu planaren Schichten verknüpft sind.[4][5]
Einzelnachweise
- ↑ a b c d Datenblatt Lead(IV) fluoride, 99% bei AlfaAesar, abgerufen am 31. Oktober 2021 (PDF) (JavaScript erforderlich).
- ↑ a b c d Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 233.
- ↑ Jean d’Ans, Ellen Lax, Roger Blachnik: Taschenbuch für Chemiker und Physiker. Springer DE, 1998, ISBN 3-642-58842-5, S. 660 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 970.
- ↑ M. Bork, R. Hoppe: Zum Aufbau von PbF4 mit Strukturverfeinerung an SnF4. In: Zeitschrift für anorganische und allgemeine Chemie. 622, 1996, S. 1557–1563, doi:10.1002/zaac.19966220919.
Auf dieser Seite verwendete Medien
Globales Harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS) Piktogramm für gesundheitsgefährdende Stoffe.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
Autor/Urheber: Speedpera, Lizenz: CC BY 4.0
Elementarzelle von Niobtetrafluorid (NbF4). Quelle der Kristallstruktur: doi:10.1107/S2056989016012081. Die Struktur entspricht dem SnF4-Typ.





