Blei(IV)-acetat
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
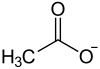 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Blei(IV)-acetat | |||||||||||||||
| Andere Namen | Bleitetraacetat | |||||||||||||||
| Summenformel | C8H12O8Pb | |||||||||||||||
| Kurzbeschreibung | farbloser bis rosafarbener Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 443,37 g·mol−1 | |||||||||||||||
| Aggregatzustand | fest | |||||||||||||||
| Dichte | 2,23 g·cm−3 (17 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Blei(IV)-acetat bildet farblose, prismatische monokline Kristalle, die an feuchter Luft nach Essig riechen.[4] Es ist das Bleisalz der Essigsäure in der Oxidationsstufe +IV mit der Konstitutionsformel Pb(CH3COO)4. Es stellt ein starkes Oxidationsmittel dar. Die Verbindung ist in heißem Eisessig gut löslich. In Wasser erfolgt eine Hydrolyse in Bleidioxid und Essigsäure.[4]
Gewinnung und Darstellung
Blei(IV)-acetat wird normalerweise durch Reaktion von Blei(II,IV)-oxid („Mennige“) mit heißem Eisessig bzw. einem Gemisch aus Eisessig und Acetanhydrid hergestellt.[4][5]
Verwendung
Blei(IV)-acetat findet in der organischen Chemie u. a. als Oxidationsmittel für die Criegeesche Glycolspaltung[6] bzw. als Dehydrierungs- und Hydroxylierungsmittel Verwendung.[4]
Einzelnachweise
- ↑ a b c Eintrag zu Bleiacetate. In: Römpp Online. Georg Thieme Verlag, abgerufen am 9. Oktober 2014.
- ↑ a b Datenblatt Blei(IV)-acetat bei Sigma-Aldrich, abgerufen am 13. März 2011 (PDF).
- ↑ Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag lead compounds with the exception of those specified elsewhere in this Annex im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ a b c d Brockhaus ABC Chemie, VEB F.A. Brockhaus Verlag Leipzig 1971
- ↑ Organikum, 16. Auflage, VEB Deutscher Verlag der Wissenschaften, Berlin 1986, S. 642.
- ↑ Hermann O. L. Fischer, Erich Baer: Helv. Chim. Acta 19 (1936) 519-532
Auf dieser Seite verwendete Medien
Globales Harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS) Piktogramm für gesundheitsgefährdende Stoffe.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
Struktur des Pb4+-Ions
Struktur des Acetat-Ions






