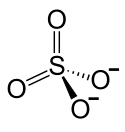
Blei(II)-sulfat
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Blei(II)-sulfat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | PbSO4 | ||||||||||||||||||
| Kurzbeschreibung | weißer kristalliner Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 303,26 g·mol−1 | ||||||||||||||||||
| Aggregatzustand | fest[1] | ||||||||||||||||||
| Dichte | 6,2 g·cm−3 [2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | sehr schlecht in Wasser (0,0445 g·l−1)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Zulassungsverfahren unter REACH | besonders besorgniserregend: fortpflanzungsgefährdend (CMR)[5] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Blei(II)-sulfat (PbSO4), ein weißer kristalliner Feststoff, ist das Blei(II)-Salz der Schwefelsäure.
Vorkommen
In der Natur findet man Blei(II)-sulfat in Form von rhombischem, diamantglänzendem Anglesit (Vitriolbleierz).[6] In reinem Zustand spricht man auch von „Bleiglas“.[7]
Bei der Entladung von Bleiakkumulatoren bildet sich Blei(II)-sulfat:[8]
- Am Minuspol des Akkumulators wird Blei in Bleisulfat umgewandelt.
- Am Pluspol entsteht aus Blei(IV)-oxid und Sulfat Bleisulfat.
Darstellung
Das in Wasser weitgehend unlösliche Blei(II)-sulfat entsteht als weißer Niederschlag bei der Reaktion von Blei(II)-oxid oder löslicher Blei(II)-salze wie Blei(II)-nitrat oder Blei(II)-acetat mit löslichen Sulfaten wie Natriumsulfat oder Schwefelsäure:[6]
- Blei(II)-sulfat
- Blei(II)-sulfat, gefällt
(Auflichtaufnahme im Lösungstropfen, 40er-Objektiv)
Eigenschaften
Die Bleiverbindung ist ein Feststoff mit einer relativ hohen Dichte von 6,35 g/cm3. In Wasser ist sie nahezu unlöslich, in konzentrierter Schwefelsäure und starken Säuren löst sie sich gut.[6][7]
- Festes Blei(II)-sulfat setzt sich mit Schwefelsäure zu löslichem Blei(II)-hydrogensulfat um.
Deswegen enthält Schwefelsäure, die nach dem Bleikammerverfahren gewonnen wird, Blei(II)-sulfat, das beim Verdünnen der Säure größtenteils wieder ausfällt.[7]
Konzentrierte Alkalilaugen vermögen Blei(II)-sulfat unter Bildung von Plumbat(II)-Ionen (Blei(II)-trihydroxokomplex) zu lösen.[6]
- Festes Blei(II)-sulfat setzt sich mit Hydroxidionen zu gelösten Plumbat(II)ionen und Sulfat um .
In konzentrierten Lösungen von Sulfaten erhöht sich die Löslichkeit von Bleisulfat durch Bildung eines Sulfatokomplexes
Ab 1170 °C schmilzt die Verbindung unter teilweiser Abspaltung von Schwefeltrioxid. Silicate wie Glas oder Porzellan zersetzen Blei(II)-sulfat unter Bildung von Bleisilicat.[6]
Verwendung
Blei(II)-sulfat wurde als weiße Malerfarbe verwendet.[11] Ihr Vorteil liegt darin, dass sie gegen Licht und Luft beständig ist. Nachteilig ist dagegen, dass die Farbe schlechter deckt und trocknet als zum Beispiel Bleiweiß. Schwefelwasserstoff und Bleisulfidbildung führen zu einem Nachdunkeln. Darüber hinaus wurde Blei(II)-sulfat für die Herstellung von Leinölfirnis sowie als Beschwerungsmittel verwendet.[12] Blei(II)-sulfat darf wegen seiner Giftigkeit in Deutschland nicht mehr frei verkauft werden.
Das Ausfällen von Blei(II)-sulfat durch Versetzen von Bleisalzlösungen mit verdünnter Schwefelsäure wird in der Analytik zur quantitativen Bestimmung von Blei genutzt.[6]
Einzelnachweise
- ↑ a b c d Eintrag zu Blei(II)-sulfat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ a b Datenblatt Blei(II)-sulfat bei Alfa Aesar, abgerufen am 3. Januar 2020 (Seite nicht mehr abrufbar).
- ↑ NIST-data review 1980
- ↑ Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag Bleiverbindungen mit Ausnahme der namentlich in diesem Anhang bezeichneten im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 14. Dezember 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Eintrag in der SVHC-Liste der Europäischen Chemikalienagentur, abgerufen am 17. Juli 2014.
- ↑ a b c d e f Karl A. Hofmann: Anorganische Chemie. Springer-Verlag, 2013, ISBN 978-3-663-14240-9, S. 540 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c Arnold F. Holleman, Egon Wiberg: Lehrbuch der anorganischen Chemie. Walter de Gruyter, 1995, ISBN 978-3-11-012641-9, S. 978 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Gert Blumenthal, Dietmar Linke, Siegfried Vieth: Chemie Grundwissen für Ingenieure. Springer-Verlag, 2007, ISBN 978-3-8351-9047-4, S. 261 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Gary L. Gardner, George H. Nancollas: Complex formation in lead sulfate solutions. In: Analytical Chemistry. Band 42, Nr. 7, 1. Juni 1970, S. 794–795, doi:10.1021/ac60289a003.
- ↑ Sven Hagemann: Thermodynamische Eigenschaften des Bleis in Lösungen der ozeanischen Salze. Braunschweig 1999, doi:10.24355/dbbs.084-200511080100-200 (tu-braunschweig.de [abgerufen am 11. März 2021]).
- ↑ Werner Baumann, Bettina Herberg-Liedtke: Druckereichemikalien Daten und Fakten zum Umweltschutz. Springer-Verlag, 2013, ISBN 978-3-642-97337-6, S. 256 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Martin Bertau, Armin Müller, Peter Fröhlich, Michael Katzberg: Industrielle Anorganische Chemie. John Wiley & Sons, 2013, ISBN 978-3-527-33019-5, S. 291 (eingeschränkte Vorschau in der Google-Buchsuche).
Auf dieser Seite verwendete Medien
Globales Harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS) Piktogramm für gesundheitsgefährdende Stoffe.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
Struktur des Pb2+-Ions
Autor/Urheber: Heiko4, Lizenz: CC BY-SA 4.0
Blei(II)-sulfat, gefällt, 400fach vergrößert, Aufnahme im Lösungstropfen, Auflicht