Blauzungenvirus
| Blauzungenvirus | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Blauzungenvirus | ||||||||||||||||||||
| Systematik | ||||||||||||||||||||
| ||||||||||||||||||||
| Taxonomische Merkmale | ||||||||||||||||||||
| ||||||||||||||||||||
| Wissenschaftlicher Name | ||||||||||||||||||||
| Bluetongue virus | ||||||||||||||||||||
| Kurzbezeichnung | ||||||||||||||||||||
| BTV | ||||||||||||||||||||
| Links | ||||||||||||||||||||
|
Das Blauzungenvirus (engl. Bluetongue virus, kurz BTV) ist eine Virusspezies aus der Familie der Reoviridae und die Typusspezeis der Gattung Orbivirus. Es ruft bei Wiederkäuern die Blauzungenkrankheit hervor.
Beim BTV handelt es sich um einen unbehüllten Viruspartikel mit einem Durchmesser von 80 nm. Das Genom besteht aus linearer doppelsträngiger RNA, welche in zehn verschieden große Segmente unterteilt ist. Vom BTV sind 24 verschiedene Serotypen mit typspezifischen Antigenen bekannt. Bei dem 2006 erstmals in Deutschland nachgewiesenen Virus handelt es sich um den Typ 8 (BTV-8).
Das Virus wird durch Mücken aus der Familie der Gnitzen vom Frühjahr bis zum Herbst übertragen. Eine Temperatur von 25 bis 30 °C ist für die Virusvermehrung in den Gnitzen optimal. Im infizierten Tier bleibt das BTV etwa 40–80 Tage aktiv, kann danach aber noch längere Zeit (Schaf 100, Rind 240 Tage) mittels der Polymerase-Kettenreaktion nachgewiesen werden.
Das Blauzungenvirus ist relativ fragil – die Infektiosität geht im leicht sauren Milieu verloren.
Replikationszyklus

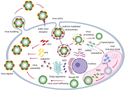
Die Virionen gelangen in die Wirtszelle durch die Bindung von des Kapsidproteins VP2 an Sialinsäur-Rezeptoren und entweder durch Clathrin-vermittelte Endozytose oder Makropinozytose. Der saure pH-Wert im Endosom bewirkt den Verlust von VP2 und bewirkt, dass die aus dem Kapsidprotein VP5 gebildete Membran durchlässig wird. Der Viruspartikel verliert so seine Kapsidschichten und der das Innere (mit demsegmentierten Genom) wird in das Zytoplasma der Wirtszelle freigesetzt. Die Transkription und Translation der Virus-Proteine findet unter Ausnutzung der Wirtszellmaschinerie statt. Im weiteren Verlauf werden die zusammengesetzten (assemblierten) Kernpartikel mit den Kapsidhüllen (Proteine VP5 und VP2) versehen, so dass reife Virionen entstehen. Die Partikel werden durch Knospung oder durch Lyse der Wirtszelle freigesetzt.[3]
Quellen
- Bluetongue virus. In: ICTVdB - The Universal Virus Database, version 4. abgerufen am 9. Dezember 2007.
- Friedrich-Loeffler-Institut: Blauzungenkrankheit. Stand 13. Dezember 2018 [1].
- P. Roy: Molecular Dissection of Bluetongue Virus. In: T. C. Mettenleiter u. F. Sobrino (Hrsg.): Animal Viruses Molecular Biology. Caister Academic Press UK, Kapitel 7.
Einzelnachweise
- ↑ a b c d e ICTV: Bluetongue virus, EC 51, Berlin, Germany, July 2019; Email ratification March 2020 (MSL #35)
- ↑ ICTV Master Species List 2018b v1 MSL #34, Feb. 2019
- ↑ a b Susan J. Dennis, Ann E. Meyers, Inga I. Hitzeroth, Edward P Rybicki: African Horse Sickness: A Review of Current Understanding and Vaccine Development, in: MDPI Viruses, Band 11, Nr. 9, Special Issue Equine Viruses, 11. September 2019, 844, doi:10.3390/v11090844
Auf dieser Seite verwendete Medien
Negatively stained bluetongue virus–like particle that caused a cytopathic effect in BHK-21 cells. Scale bar = 50 nm
(c) CSIRO, CC BY 3.0
Bluetongue is an insect-borne viral disease of ruminants. Australia is free of bluetongue disease, but transmission of bluetongue viruses occurs in far northern Australia, coastal Queensland and the north coast and Hunter Valley regions of New South Wales. This transmission electron micrograph shows bluetongue virus prepared by negative contrast electron microscopy. Image produced by Electron Microscopy Unit, Australian Animal Health Laboratory.
Autor/Urheber: Susan J Dennis 1, Ann E Meyers, Inga I Hitzeroth, and Edward P Rybicki, Lizenz: CC BY 4.0
Diagrammatic representation of the replication cycle of bluetongue virus (BTV)/African horse sickness virus (AHSV). The virus enters the cell by the attachment of VP2 to sialic acid receptors and either clathrin-mediated endocytosis or macropinocytosis. The acidic pH in the endosome causes the loss of VP2 and mediates VP5 membrane permeabilization, which results in uncoating of the virion and release of the transcriptionally active core particle into the host cell cytoplasm. Transcription and translation of viral proteins occurs, utilizing the host cell machinery and the VIBs act as sites of assembly for the progeny virions. Assembled core particles are then trafficked from the VIB on exocytotic vesicles by NS3 interaction with calpactin. The outer capsid proteins VP5 and VP2 are acquired during this process to produce mature virions. Particles are released from the cell via budding mediated by NS3 or via host cell lysis.
Autor/Urheber: Daniel Luque, Carlos P. Mata, Nobuhiro Suzuki, Said A. Ghabrial and José R. Castón, Lizenz: CC BY 4.0
T = 1 capsid protein X-ray- and cryo-EM-based structures. Top row: T = 1 capsids of bluetongue virus (BTV) a double-stranded RNA virus.
Autor/Urheber: Eva Calvo-Pinilla, Alejandro Marín-López, Sandra Moreno, Gema Lorenzo, Sergio Utrilla-Trigo, Luis Jiménez-Cabello, Julio Benavides, Aitor Nogales, Rafael Blasco, Alejandro Brun, and Javier Ortego, Lizenz: CC BY 4.0
Three concentric layers constituted by VP2 and VP5 (outer capsid), VP7 (intermediate layer), and VP3 (subcore) characterized bluetongue virus (BTV) virions (~90 nm in diameter). The RNA polymerase complex, which is located inside the inner capsid, is composed by structural proteins VP1, VP4, and VP6. Five additional proteins (NS1, NS2, NS3/NS3A, NS4, and NS5) are synthesized inside the cell during the replicative cycle. VP2 and NS1 proteins of BTV are expressed by the recombinant MVAs.