Bisphosphonate

Bisphosphonate (auch Diphosphonate) sind chemische Verbindungen, die über zwei Phosphonat-Gruppen verfügen.
Verwendung
Bisphosphonate gehören einer Medikamentengruppe an, die seit den 1980er Jahren für diagnostische und therapeutische Zwecke bei Knochen- und Calciumstoffwechselkrankheiten entwickelt wurde. Einige Verbindungen dieses Typs werden in Medikamenten zur Behandlung der Osteoporose verwendet. Sie sind in Deutschland zur Therapie der Osteoporose bei postmenopausalen Frauen, der Osteodystrophia deformans und der Tumor-assoziierten Hyperkalzämie zugelassen. Darüber hinaus finden sie Einsatz bei der Behandlung von Knochenmetastasen und Fibröser Dysplasie.[1]
In einer Studie aus dem Jahr 2009 wurde außerdem durch Hinzufügen von Zoledronat (eine Substanz aus der Gruppe der Bisphosphonate) zur endokrinen Therapie bei hormonsensiblem Brustkrebs eine längere rezidivfreie Überlebenszeit erzielt.[2]
Bisphosphonate dienen auch in Verbindung mit 99mTechnetium als Tracer in dem nuklearmedizinischen Untersuchungsverfahren Skelettszintigrafie. Dabei werden sie in einer sehr niedrigen, pharmakologisch nicht wirksamen Dosis angewendet.
Das Bisphosphonat Lexidronam wird in Verbindung mit dem überwiegenden Beta-Strahler 153Samarium zur palliativen analgetischen Therapie bei Knochenmetastasen eingesetzt (Radionuklidtherapie).
Wirkmechanismus
Bisphosphonate können Biomembranen zwar nur sehr schwer überwinden, die Osteoklasten nehmen Bisphosphonate aber im Rahmen des Abbaus von Knochensubstanz durch Phagozytose auf. Diese Aufnahme führt dazu, dass die Lebensdauer der Osteoklasten verkürzt wird. Dies wiederum bewirkt letztlich die therapeutisch erwünschte Verringerung des Knochenabbaus.
Bisphosphonate üben mehrere Effekte auf den Knochen aus: Durch Anlagerung an die Knochenoberfläche hemmen sie einerseits die Mineralisation der Knochensubstanz, andererseits hemmen sie den Knochenabbau durch Hemmung der Osteoklasten-Aktivität: Insbesondere die stickstoffreichen Bisphosphonate hemmen die Protonen-ATPase (direkt toxischer Effekt) und hemmen die Enzyme des Mevalonsäurestoffwechsels. Experimentell und klinisch belegt ist außerdem ihr direkter Einfluss auf das Monozyten-Makrophagen-System, indem sie die Rekrutierung und Fusionierung der Osteoklasten-Vorläufer torpedieren. Außerdem bewirken sie die Verkürzung der osteoklastären Lebensdauer durch Induktion der Apoptose, wahrscheinlich verbunden mit einer Verlängerung der osteoblastären Lebensdauer: Durch Hemmung der Farnesylpyrophosphat-Synthase können die Produkte dieses Enzyms, Farnesyl- und Geranylpyrophosphat, kleine G-Proteine (u. a. Ras) nicht mehr in der Zellmembran verankern. Fehlen diese G-Proteine, haben an Zellrezeptoren gebundene Wachstumsfaktoren keine Auswirkung auf die Zelle mehr. Infolgedessen sterben die Osteoklasten im Rahmen der Apoptose ab.[3] Und schließlich bewirken sie die Hemmung von Prostacyclinen und anderen Cytokininen im Knochengewebe.[4]
Wirkstoffe

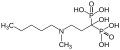
Die Bisphosphonate sind Ester und Salze der Methylendiphosphonsäure (Medronsäure). Sie sind Diphosphat-Analoga, in denen der Sauerstoff der P–O–P-Bindung durch Kohlenstoff ersetzt ist. Verbindungen dieses Typs zählen zu den Phosphonaten. Sie unterliegen im Körper keiner enzymatischen Hydrolyse. Bevor man ihre therapeutische Wirkung bei Osteoporose entdeckte, wurden Bisphosphonate unter anderem als Waschmittelzusätze verwendet. Durch Modifikationen der Molekülstruktur wurden ihre therapeutischen Eigenschaften schrittweise verbessert. So sind die neuesten Bisphosphonate 20000-mal potenter als Etidronat, das Bisphosphonat der ersten Generation. Sie unterscheiden sich in den Seitenketten und bilden demnach vier Gruppen:
- Bisphosphonat ohne Stickstoff: Etidronat, Clodronat, Tiludronat
- Aminobisphosphonate: Pamidronat, Alendronat
- am Stickstoff substituierte Aminobisphosphonate: Ibandronat
- Bisphosphonate mit einem basischen Heterocyclus: Risedronat, Zoledronat.
In Deutschland sind folgende Bisphosphonate zugelassen: Alendronat, Clodronat, Etidronat, Ibandronat, Pamidronat, Risedronat, Tiludronat und Zoledronat. Zur Skelettszintigrafie wird unter anderem Oxidronat (HDP) (nur in der Schweiz zugelassen) verwendet.
Es gab bis 2011 keine Studien, welche die vorhandenen Bisphosphonate miteinander vergleichen, weshalb eine generelle Empfehlung bezüglich eines bestimmten Wirkstoffs noch nicht gestellt werden konnte.[5] Je nach Lokalisation der Brüche konnte das Risiko um 25 bis 70 % reduziert werden.[5]
Pharmakokinetik
Bisphosphonate werden im Darm schlecht resorbiert und bilden mit Calcium unlösliche Komplexe. Die Resorptionsquote nach oraler Einnahme liegt zwischen 1 und 10 % der eingenommenen Dosis, teilweise ist sie noch geringer. Die Einnahmevorschriften müssen daher genau eingehalten werden. Bisphosphonate sollten morgens nüchtern mindestens 30 Minuten vor weiterer Nahrungsaufnahme oder anderen Medikamenten mit einem vollen Glas Leitungswasser eingenommen werden. Diese Vorschriften entfallen bei intravenöser Gabe durch Infusion oder Injektion.
Etwa 20–50 % der resorbierten Menge wird im Knochen gespeichert. Der Rest wird innerhalb von 24 Stunden mit dem Urin oder Stuhl ausgeschieden. Die Halbwertszeit der Bisphosphonate im Skelett beträgt viele Jahre, ähnlich wie bei Tetracyclinen oder Strontium.
Nebenwirkungen
Bei oraler Gabe treten bei zwei bis zehn Prozent der Patienten gastrointestinale Beschwerden wie Übelkeit, Bauchschmerzen, Erbrechen und Durchfall auf. Aufrechte Haltung während der Einnahme kann einen Rückfluss in die Speiseröhre (gastroösophagealer Reflux) und damit Schädigungen der Speiseröhre vermeiden. Durch Komplexbildung mit Calciumionen im Darm können gelegentlich Hypokalzämien vorkommen. In Schwangerschaft und Stillzeit sind Bisphosphonate kontraindiziert.
Eine bekannte Nebenwirkung sind bisphosphonatassoziierte Knochennekrosen im Kieferbereich (BONJ). Ein relevantes Risiko für eine BP-assoziierte ONJ besteht besonders, wenn Bisphosphonate aufgrund einer malignen Grunderkrankung intravenös in hohen Dosen und über einen längeren Zeitraum verabreicht werden. Bei oraler Medikation sind eher selten Fälle von Kieferknochennekrosen bekannt geworden, meist im Zusammenhang mit einer vorhergehenden Zahnextraktion. Die Bisphosphonate stören nämlich die intraossäre Angiogenese des Knochens, sodass er sich bei Infekten oder bei Traumata nicht so gut regenerieren kann.
Studien zur Langzeitanwendung der Alendronsäure zeigten zudem ein Risiko für das Entstehen von atypischen Frakturen des Femurschafts auf.[6] Diese können durch ein minimales Trauma ausgelöst werden, kommen jedoch auch ohne Trauma vor. Die Frakturen sind häufig beidseitig und weisen eine schlechte Heilungstendenz auf.[7] Da so der Verdacht entstand, dass Bisphosphonate langfristig den Knochenumbau stören und das Risiko für Frakturen deutlich erhöhen könnten, wird gegenwärtig eine maximale Therapiedauer von 5 Jahren empfohlen.[8]
Laut der HORIZON-Studie trat bei Behandlung mit dem Bisphosphonat Zoledronsäure bei nicht wenigen Patientinnen (1,3 Prozent) auch schweres Vorhofflimmern auf, das bisher bei Bisphosphonaten nicht beobachtet worden war. Das Vorhofflimmern lag unter der für diese Altersgruppe zu erwartenden Rate und wurde in anderen Studien mit Zoledronsäure nicht beobachtet.[9]
Weitere mögliche Nebenwirkungen von Bisphosphonaten sind Verwirrtheit sowie optische, akustische und olfaktorische Halluzinationen.
In der Skelettszintigrafie verwendete Bisphosphonate haben aufgrund der extrem niedrigen Dosierung keine Nebenwirkungen. Lediglich bei fehlerhafter Injektion in das Gewebe neben der Vene kommt es zu einem sehr kurz anhaltenden brennenden Gefühl. Die Einschränkungen der Indikation nuklearmedizinischer Untersuchungen in Schwangerschaft und Stillzeit sowie die Strahlenexposition durch das Radionuklid sind zu beachten.
Einzelnachweise
- ↑ R. Chapurlat: Current pharmacological treatment for fibrous dysplasia and perspectives for the future. In: Joint Bone Spine, 2005, Band 72, Nummer 3, S. 196–198; doi:10.1016/j.jbspin.2004.08.001.
- ↑ M. Gnant, B. Mlineritsch, W. Schippinger u. a.: Endocrine therapy plus zoledronic acid in premenopausal breast cancer. In: N Engl J Med., Februar 2009, Band 360, Nummer 7, S. 679–691, PMID 19213681.
- ↑ Heinz Lüllmann, Klaus Mohr, Lutz Hein: Pharmakologie und Toxikologie. Thieme, Stuttgart 2006, ISBN 978-3-13-368516-0, S. 262–264.
- ↑ R. Bartl, C. Bartl, R. Gradinger: Einsatz der Bisphosphonate in der Orthopädie und Unfallchirurgie. In: Der Orthopäde. Band 37, Nr. 6, Juni 2008, S. 595–614, doi:10.1007/s00132-008-1280-y.
- ↑ a b J. J. Body: How to manage postmenopausal osteoporosis? In: Acta Clin Belg. Band 66, Nr. 6, 2011, S. 443–447, doi:10.1179/ACB.66.6.2062612.
- ↑ Bisphosphonates: atypical femoral fractures. In: Drug Safety Update. Band 4, Nr. 11, Juni 2011 (online).
- ↑ E. Shane, D. Burr, P. R. Ebeling u. a.: Atypical subtrochanteric and diaphyseal femoral fractures: report of a task force of the American Society for Bone and Mineral Research. In: J Bone Miner Res., 2010, Band 25, Nr. 11, S. 2267–2294; doi:10.1002/jbmr.253.
- ↑ 9. Therapie | DVO Leitlinie Osteoporose 2023. Abgerufen am 24. Juli 2024 (deutsch).
- ↑ Ergebnis der randomisierten HORIZON-Studie: Once-Yearly Zoledronic Acid for Treatment of Postmenopausal Osteoporosis. In: New England Journal of Medicine, 2007, Band 356, S. 1809–1822, doi:10.1056/NEJMoa067312. Hier zitiert nach: Deutsches Ärzteblatt, 3. Mai 2007;aerzteblatt.de ( vom 16. Juli 2012 im Webarchiv archive.today)
Auf dieser Seite verwendete Medien
Struktur von Dicarboxypropan-diphosphonsäureen: Structure of dicarboxypropane diphosphonic acid (DPD)
Basisstruktur der Bisphosphonate.
HEDP, 1-Hydroxyethan-(1,1-diphosphonsäure)
Chemical structure of zoledronate (INN: zoledronic acid). Created using ACD/ChemSketch and Inkscape.
Structure of Ibandronic acid
Alendronsäure; Alendronat
chemical structure of medronic acid (methylene diphosphonate)