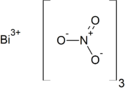Bismut(III)-nitrat
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
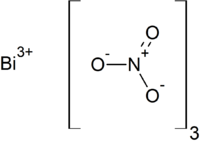 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Bismut(III)-nitrat | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | Bi(NO3)3 | |||||||||||||||
| Kurzbeschreibung | weißer Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | ||||||||||||||||
| Aggregatzustand | fest[1] | |||||||||||||||
| Dichte | 2,83 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | 75–80 °C[1] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Bismut(III)-nitrat ist eine anorganische chemische Verbindung des Bismuts aus der Gruppe der Nitrate.
Gewinnung und Darstellung
Bismut(III)-nitrat kann durch Lösen von Bismut oder Bismut(III)-oxid in Salpetersäure gewonnen werden. Es lässt sich als Pentahydrat isolieren.[4]
Eigenschaften
Bismut(III)-nitrat-pentahydrat ist ein farbloser Feststoff, der in Form von stäbchenförmigen, triklinen Kristallen vorliegt. Er wandelt sich beim Erhitzen ab etwa 60 °C in verschiedene basische Bismut(III)-nitrate und bei höheren Temperaturen in Bismut(III)-oxid um. Er ist löslich in starken anorganischen Säuren sowie in Glycerin und Eisessig. In Wasser erfolgt Hydrolyse zu basischen Salzen, wie Bismut(III)-subnitrat.[4][5] Mit Metallnitraten bildet er Doppelsalze.[6]
Verwendung
Bismut(III)-nitrat ist ein ausgezeichnetes Oxidationsmittel für eine Vielzahl von 4-substituierten Hantzsch-1,4-Dihydropyridinen. Es ist ein komfortables Reagenz zur selektiven Oxidation von Sulfiden zu Sulfoxiden.[1] Es wird auch als Katalysator für eine Michael-Addition mit hoher Ausbeute von verschiedenen Substraten, darunter Aminen, Imidazolen und Indolen zu Enonen verwendet.[2]
Die Oxidation von Bismut(III)-nitrat mit Kalilauge lässt Kaliumbismutat synthetisieren.[7]
Einzelnachweise
- ↑ a b c d e f g Datenblatt Bismuth(III) nitrate pentahydrate, 99.999% trace metals basis bei Sigma-Aldrich, abgerufen am 2. Januar 2014 (PDF).
- ↑ a b c d e f Datenblatt Bismuth(III) nitrate pentahydrate, ACS, 98% bei Alfa Aesar, abgerufen am 2. Januar 2014 (PDF) (JavaScript erforderlich).
- ↑ a b Eintrag zu Bismut(III)-nitrat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ a b Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 602.
- ↑ G. Gattow, G. Kiel: Über Wismutnitrate. IV. Darstellung und Eigenschaften von Bi(NO3)3 * 5 H2O. In: Zeitschrift für anorganische und allgemeine Chemie. 335, 1965, S. 61–73, doi:10.1002/zaac.19653350106.
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 826.
- ↑ Tu N. Nguyen, Daniel M. Giaquinta, William M. Davis, Hans Conrad zur Loye: Electrosynthesis of KBiO3 (potassium bismuth oxide): a potassium ion conductor with the KSbO3 (potassium antimony oxide) tunnel structure. September 1993, S. 1273–1276, doi:10.1021/cm00033a015.
Auf dieser Seite verwendete Medien
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for oxidizing substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Autor/Urheber: Copiero ergo sum, Lizenz: CC BY-SA 4.0
Strukturformel von Bismut(III)-nitrat