Biotinidase
| Biotinidase | ||
|---|---|---|
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 523 AA (Mensch) | |
| Isoformen | 4 | |
| Bezeichner | ||
| Gen-Name | BTD | |
| Externe IDs |
| |
| Enzymklassifikation | ||
| EC, Kategorie | 3.5.1.12, Hydrolase | |
| Reaktionsart | Hydrolyse | |
| Substrat | Biocytin + H2O | |
| Produkte | Biotin + Lysin | |
| Vorkommen | ||
| Homologie-Familie | BTD/VNN | |
| Übergeordnetes Taxon | Opisthokonta | |
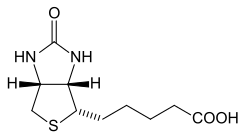
Biotinidase ist ein Enzym aus der Klasse der Hydrolasen, das das Vitamin Biotin aus Proteinen freisetzt. Das ist bei dem im Körper stattfindenden Recycling des Biotins wichtig, aber auch bei dessen Aufnahme aus der Nahrung.[1]
Nach Erforschung von Vorkommen und Verteilung der Biotinidase in den verschiedenen Organismen in den 1950er und 1960er Jahren rückte das Enzym ab 1983 wieder ins wissenschaftliche Interesse durch die Entdeckung, dass ein Biotinidase-Defekt Ursache einer seltenen, erblich bedingten Stoffwechselkrankheit ist. Die Erforschung der verschiedenen Ausprägungsformen des nun als Biotinidasemangel bezeichneten Defekts (engl. biotinidase deficiency) brachte eine Reihe von neuen Informationen über die Funktion der Biotinidase und die Rolle des Biotins im Organismus.
Vorkommen
Bisher wurde Biotinidase außer im Menschen auch in diversen Wirbeltieren sowie in Fruchtfliegen und Pilzen gefunden. Obwohl sich die Biotinidasen der verschiedenen Arten unterscheiden, sind bestimmte Abschnitte des Enzyms im Laufe der Evolution erhalten geblieben. Der Stammbaum der Biotinidase reicht bis ins Präkambrium.[2][3][4]
Manche Bakterien wie die Milchsäurebakterien Lactobacillus casei oder Enterococcus faecalis (früher Streptococcus faecalis) enthalten ebenfalls ein Enzym, das Biotin freisetzen kann, ein anderes Milchsäurebakterium Lactobacillus arabinosus jedoch nicht.[5][6]
Struktur
Für einige Biotinidasen aus verschiedenen Lebewesen ist die komplette Abfolge der Aminosäuren im Protein bekannt. So besitzt menschliche Biotinidase 523[7] Aminosäuren, die der Ratte 521, bei der Maus sind es 520 und beim Kugelfisch 504 Aminosäuren. Bei anderen Tieren konnten erst Fragmente sequenziert werden.[2]
Über die dreidimensionale Struktur ist wenig bekannt. Eine Kristallstrukturanalyse scheiterte bislang an der Schwierigkeit, Biotinidase zu kristallisieren (Stand Anfang 2009). Es existiert lediglich ein auf Computersimulationen basierendes Modell, das aber nach Aussage der Autoren im Detail unsicher ist.[8]
Funktion
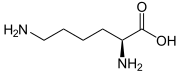
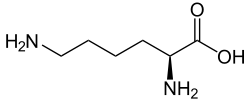
Die Biotinidase spaltet katalytisch das beim Abbau der Carboxylasen anfallende Biocytin in Biotin und die Aminosäure Lysin.
Außerdem gibt es Hinweise, dass die Biotinidase auch als Transferase eine Rolle spielt. Experimenten in vitro zufolge ist das Enzym in der Lage, abgespaltenes Biotin chemisch zu binden. Sind Histone zugegen, die Bindungsstellen für Biotin besitzen, werden sie biotinyliert. Dabei ist die Biotinidase nicht das einzige Enzym, das Biotin an Histone binden kann, die Holocarboxylase Synthetase hat ebenfalls diese Fähigkeit. Jedoch ist die Biotinidase auch in der Lage Histone zu debiotinylieren. Welche der Reaktionen an welchen Histonen unter welchen Bedingungen stattfinden, ist Gegenstand der aktuellen Forschung. Epigenetische Effekte werden diskutiert.[9][10]
Genetik
Das die Biotinidase codierende Gen befindet sich beim Menschen auf Chromosom 3 im Bereich p25. Es sind eine Reihe von Mutationen bekannt, die zu einer Stoffwechselkrankheit namens Multipler Carboxylase-Mangel führen.[11] Mittlerweile wird in vielen Ländern im Rahmen des Neugeborenenscreenings auf Biotinidasemangel getestet.
Belege
- ↑ J. Hymes, B. Wolf: Biotinidase and its roles in biotin metabolism. In: Clin. Chim. Acta 255(1); 1996 Nov 15: S. 1–11. PMID 8930409
- ↑ a b Proteindatenbank Uniprot, Einträge für Biotinidase
- ↑ B. Wolf, K. Jensen: Evolutionary conservation of biotinidase: implications for the enzyme's structure and subcellular localization. In: Mol. Genet. Metab. 86(1-2); Sep/Oct 2005: S. 44–50. PMID 16150625
- ↑ Stammbaum der Genfamilie bei HOGENOM (Memento des vom 24. Juli 2015 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- ↑ M. Koivusalo, C. Elorriaga, Y. Kaziro, S. Ochoa: Bacterial Biotinidase. In: J. Biol. Chem. 238; March 1963: S. 1038–42. PMID 14034272 (Volltext)
- ↑ K. Hayakawa, L. Guo, E.A.Terentyeva, K. X. Li, H. Kimura, M. Hirano, K. Yoshikawa, T. Nagamine, N. Katsumata, T. Ogata, T. Tanaka: Determination of specific activities and kinetic constants of biotinidase and lipoamidase in LEW rat and Lactobacillus casei (Shirota). In: J. Chromatogr. B Analyt. Technol. Biomed. Life Sci. 844(2); Dec 2006: S. 240–50. Epub July 2006. PMID 16876490
- ↑ Proteindatenbank UniProt P43251
- ↑ K. Pindolia, K. Jensen, B. Wolf: Three dimensional structure of human biotinidase: computer modeling and functional correlations. In: Mol. Genet. Metab. 92(1-2); Sep/Oct 2007, S. 13–22. Epub 12. July 2007. PMID 17629531
- ↑ J. Hymes, B. Wolf: Human Biotinidase Isn’t Just for Recycling Biotin. In: J. Nutr. 129; Feb 1999: S. 485S–489S PMID 10064314 (Volltext)
- ↑ Y. I. Hassan, J. Zempleni: Epigenetic regulation of chromatin structure and gene function by biotin. In: J. Nutr. 136(7); 2006 Jul: S. 1763–5 PMID 16772434 (Volltext)
- ↑ Datenbankeintrag zu Biotinidase. In: Online Mendelian Inheritance in Man. (englisch)
Auf dieser Seite verwendete Medien
Struktur von L-Lysin
Struktur von Biocytin (Nε-Biotinyl-L-lysin). 1) Biocytin entsteht bei der Proteolyse biotinabhängiger Carboxylasen, wie z. B. der Pyruvat-Carboxylase. Zum Recycling des Vitamins Biotin muss Biocytin durch das Enzym Biotinidase gespalten werden. 2) In der Hirnforschung wird Biocytin als neuronaler Tracer eingesetzt.
Strukturformel von Biotin