Biolumineszenz



Als Biolumineszenz (griechisch βιός biós ‚Leben‘ und lateinisch lumen ‚Licht‘) oder Biofluoreszenz wird in der Biologie die Fähigkeit von Lebewesen bezeichnet, selbst oder mit Hilfe von Symbionten Licht zu erzeugen. Die Erzeugung des Lichtes findet bei höher organisierten Organismen oft in speziellen Leuchtorganen statt, bei eukaryotischen Einzellern in besonderen Organellen und bei Bakterien im Cytoplasma. Sie basiert auf chemischen Prozessen, bei denen freiwerdende Energie in Form von Licht abgegeben wird, es handelt sich also um eine Chemilumineszenz. Unterschieden wird bei der Biolumineszenz zwischen primärem und sekundärem Leuchten. Den Regelfall stellt das primäre Leuchten dar, bei dem ein Tier zum Selbstleuchten in der Lage ist. Entsteht das Leuchten stattdessen durch symbiontische Bakterien, wie z. B. von Fischen bekannt, spricht man vom sekundären Leuchten.
Ein Großteil der zu Biofluoreszenz fähigen Organismen lebt aquatisch; so konnte bei Fischen, Kopffüßern, Quallen, Schnecken, Weichtieren und einigen Korallen Biolumineszenz nachgewiesen werden.
Wird das Licht nach unmittelbar vorhergehender Absorption von Licht anderer Wellenlänge erzeugt, wird es Biofluoreszenz genannt (zur Einordnung siehe Lumineszenz; beachte Unterschied zur farbigen Reflexion (Remission)).
Biologische Funktion
Biolumineszenz kann verschiedene Funktionen haben:
- Anlocken von Beute oder Partnern
- Kommunikation
- Warn- oder Drohfunktion
- Abschreckungs- oder Ablenkungsfunktion
- Tarnung durch die Anpassung des eigenen Lichts an das Licht der Umgebung
Verbreitung
In fast allen Reichen der Organismen gibt es biolumineszierende Arten, jedoch nicht unter höheren Pflanzen und Landwirbeltieren.
| Reich | primäres oder sekundäres Leuchten |
|---|---|
| Tiere (mehrere Stämme) | primäres Leuchten (bei Wirbeltieren nur sekundäres Leuchten) |
| Pilze (wenige Arten) | primäres Leuchten |
| höhere Pflanzen | kein Leuchten |
| Einzeller (einige) | primäres Leuchten |
| Bakterien (wenige) | primäres Leuchten |
Aquatisch lebende Tiere
Fische
Bei über 180 Fischarten konnten Wissenschaftler in einer 2014 veröffentlichten Untersuchung Biofluoreszenz nachweisen.[1] Dazu zählen unter anderem:[1]
- Anglerfische (Antennariidae), z. B. Antennarius maculatus
- Eidechsenfische (Synodontidae), z. B. Synodus dermatogenys
- Grundeln (Gobiidae), der Gattung Eviota, wie z. B. Eviota atriventris
- Seezungen, z. B. Soleichthys heterorhinos
- Plattköpfe, der Gattung Cociella, wie z. B. Cociella hutchinsi
- „falsche Muränen“, der Gattung Kaupichthys, wie z. B. Kaupichthys brachychirus
- Sandsterngucker (Dactyloscopidae), der Gattung Gillellus, wie z. B. Gillellus uranidea
- Scheinschnapper der Gattung Scolopsis, wie z. B. Scolopsis bilineata
- Seenadeln (Syngnathidae), der Gattung Corythoichthys, wie z. B. Corythoichthys haematopterus
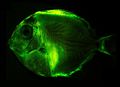
- der Blaue Doktorfisch (Acanthurus coeruleus)
- der Buckel-Drachenkopf (Scorpaenopsis diabolus)
- der Jamaika-Stechrochen (Urobatis jamaicensis)
- der Schwellhai (Cephaloscyllium ventriosum)
- arktische Scheibenbäuche (Liparidae) aus der Gattung Liparis[2]
- Kaupichthys brachychirus zählt zu den „ falschen Moränen“
- Jamaika-Stechrochen
- Soleichthys heterorhinos
- Buckel-Drachenkopf
- Scheinschnapper Scolopsis bilineata
- Leuchtorgane des Tiefseefisches Photostomias guernei
Sonstige aquatisch lebende Tiere
Besonders verbreitet ist die Biolumineszenz unter Meeresbewohnern, vor allem in der Tiefsee (bis zu 90 Prozent der Tiefseeorganismen), aber auch in Küstengewässern (etwa fünf Prozent). Verschiedene Kopffüßer wie der Vampirtintenfisch (Vampyroteuthis infernalis), die Wunderlampen (Lycoteuthis) und andere Kalmare (Teuthida), Leuchtgarnelen (Krill, Euphausiacea), Leuchtquallen (Leuchtqualle Pelagia noctiluca, Aequorea victoria, Kronenqualle Periphylla periphylla), Vielborster (Polychaeten) wie Eusyllis blomstrandi im Helgoländer Felswatt (Helgoland), der im Sand verborgen lebende Chaetopterus variopedatus und der freischwimmende Tomopteris helgolandica, Korallen wie Renilla reniformis und verschiedene Tiefseefische.
Unter den Nacktkiemern (Nudibranchia), meereslebenden Nacktschnecken, gibt es ebenfalls mehrere biolumineszente Arten, wie z. B. Plocamopherus imperialis[3] und Phylliroe bucephalum.[4]
Insekten
Insekten mit Biolumineszenz sind zum Beispiel Leuchtkäfer (Glühwürmchen; Lampyridae) und Leuchtschnellkäfer (Gattungen Cucujo und Pyrophorus). Es gibt auch leuchtende Collembolen (Springschwänze).
Pilze

Von über 100.000 untersuchten Pilzarten sind nur 71 biolumineszent. Dazu zählen der Honiggelbe Hallimasch (Armillaria mellea), der Leuchtende Ölbaumpilz (Omphalotus olearius) und einige Arten der Gattungen Zwergknäuelinge (Panellus, z. B. Panellus stipticus), Seitlinge (Pleurotus, z. B. Pleurotus japonicus) und Helmlinge (Mycena, z. B. Mycena citricolor, Mycena lux-coeli).[5]
Die Biolumineszenz entwickelte sich in vier Abstammungslinien. Es konnte gezeigt werden, dass die Biolumineszenzerscheinungen bei allen vier Abstammungslinien auf den gleichen Grundlagen beruhen.[6]
Einzeller

Das so genannte Meeresleuchten wird durch Plankton hervorgerufen, zum Beispiel von einzelligen Dinoflagellaten (Noctiluca scintillans), die auf Strömungsveränderungen mit der Aussendung von Licht reagieren. Meeresleuchten lässt sich an zahlreichen Küsten beobachten.
Bakterien
Es gibt einige im Meerwasser freilebende Leuchtbakterien, die auch auf Lebensmitteln wie Fisch, Fleisch und Eiern zu finden sind. Hierzu gehören zum Beispiel Aliivibrio fischeri und Photobakterien. Aliivibrio fischeri vermehrt sich auf toten Salzwasserfischen und lässt sich leicht beobachten, wenn man einen toten, frischen Salzhering einige Zeit kühl aufbewahrt, der dann im Dunklen stellenweise leuchtet.
Außerdem gibt es symbiotisch lebende Leuchtbakterien, die in besonderen Organen von Meerestieren vorkommen; vor allem Angler- und Laternenfische leben in Symbiose mit Leuchtbakterien.
Erzeugung

Es werden zwei Formen der Biolumineszenz unterschieden: das primäre und das sekundäre Leuchten. Als primäres Leuchten wird es bezeichnet, wenn der Organismus die Lumineszenz selbst erzeugt. Als sekundäres Leuchten hingegen wird bezeichnet, wenn ein Organismus eine Symbiose mit anderen Lebewesen eingeht (etwa mit Leuchtbakterien), welche die Möglichkeit zum primären Leuchten besitzen.
Symbiosen
Es kommen häufig Symbiosen von Tieren mit Leuchtbakterien vor. Dabei werden die Bakterien von ihren Wirten mit Nahrung und Sauerstoff versorgt und leben oft in speziellen Hauttaschen oder Körperpartien. Ein Beispiel sind die Tiefseeanglerfische.
Luciferin / Luciferase
Eine häufig zur Biolumineszenz genutzte chemische Reaktion ist die exergone Oxidation von Luciferinen wie D-Luciferin mit molekularem Sauerstoff (O2), katalysiert durch Enzyme der Luciferasen. Dabei entstehen Dioxetane bzw. Dioxetanone, die unter Abgabe von Kohlenstoffdioxid zerfallen und die gespeicherte Energie in Form von Licht freisetzen.
Sowohl die Luciferine als auch die Luciferasen sind art- oder gruppenspezifisch, also für jede Organismengruppe kennzeichnend. Dabei sind die Luciferasen offensichtlich im Laufe der Evolution aus anderen Enzymen, den Oxygenasen, hervorgegangen. Bei der Veränderung, meistens der Abspaltung von Teilgruppen an dem Luciferin, entsteht Energie, die als Lichtquant abgegeben wird.
Aequorin / Coelenterazin / Coelenteramid

Eine andere Art der Lichterzeugung, nämlich durch Photoproteine, verwendet die Qualle Aequorea victoria. Dieser Coelenterat (Hohltier) verwendet Aequorin, ein Ca2+-abhängiges primäres Photoprotein. Da es im Laufe der Reaktion nicht wie andere Luciferine chemisch umgewandelt wird, sondern nach der Emission des Lichts in seinen Ausgangszustand zurückgelangt, ist es unbegrenzt wiederverwertbar. Das blau-grüne Leuchten dieser Quallen entsteht durch die Kombination von Aequorin mit dem grün fluoreszierenden Protein (GFP), welches heutzutage zudem als integraler Bestandteil (zell-)biologischer Forschung zum Einsatz kommt.[7]
Foxfire-Biolumineszenz
Pilze nutzen die Foxfire-Biolumineszenz, wobei das Enzym Superoxiddismutase (SOD) zur Erzeugung von Biolumineszenz führt.[5][8]
Anwendung

Bereits im Mittelalter wurde in Form von Bakterienlampen die Biolumineszenz genutzt. Auch gab es Anleitungen, Buchstaben zu malen, die nachts leuchten und am Tag unsichtbar sind.[9][10] Biolumineszenz ist nicht nur für die Grundlagenforschung von Interesse. Seit einiger Zeit werden verschiedene technische Anwendungen von Biolumineszenz routinemäßig eingesetzt. So wird Biolumineszenz etwa als risikoarme Markierungsmethode in der Molekularbiologie angewendet, die zusammen mit Fluoreszenz-Markierungen die Methode der radioaktiven Markierung weitgehend ersetzt hat. Auch als Nachweismethode in der Ökotoxikologie wird Biolumineszenz zum Nachweis und der Quantifizierung von Toxinen verwendet. Die Verwendung von Dinoflagellaten in der Strömungsforschung zum Nachweis von Turbulenzen wird diskutiert. Einige Forscher kündigen bereits selbstleuchtende Monitore auf Basis von Biolumineszenz an.
1999 berichteten britische Zeitungen – und anschließend Medien in anderen Ländern – über angebliche Arbeiten an selbst leuchtenden Weihnachtsbäumen.[11] Diese hat es allerdings nie gegeben.[12]
In jüngster Vergangenheit ist es den Bio-Ingenieuren des US-amerikanischen Unternehmens BioGlow gelungen, mit Hilfe von Genmanipulation und biolumineszierenden Enzymen eine autolumineszente Pflanze zu züchten. Ziel der Entwicklung war es, eine saubere, nachhaltige und bezahlbare pflanzliche Alternative für Lichtquellen zu generieren. Erzielt wird diese neue Eigenschaft der Pflanze dadurch, dass in das Chloroplastengenom der Ziertabak-Art Nicotiana alata marine Bakterien integriert wurden. Diese produzieren im Rahmen ihres induzierten Stoffwechsels auf natürlichem Weg Licht.[13] 2020 gelang es Wissenschaftlern, Pflanzen mittels Geneditierung eigenständig und permanent heller leuchten zu lassen als bisher. Sie fügten dazu Gene eines biolumineszenten Pilzes zur Produktion von Luciferin in das Pflanzengenom ein.[14][15][16][17][18]
Verwendung in der Natur
Biolumineszenz hat mehrere Funktionen bei verschiedenen Taxa.[19] Steven Haddock et al. (2010) nennen folgende Funktionen, die bei Meeresorganismen mehr oder weniger sicher sind: Schutzfunktionen der Abschreckung,[20] Gegenlicht (Tarnung), Irreführung (Nebelwand), abschreckende Körperteile, Sicherheitssignalisierung (die es erleichtert, höhere Raubtiere zu beobachten) und Warnungen zur Abschreckung von Siedlern; offensive Funktionen des Lockvogels, Betäubung oder Verwirrung der Beute, Beleuchtung der Beute und Anziehung / Wiedererkennung des Partners. Es ist für Forscher viel einfacher zu entdecken, dass eine Art in der Lage ist, Licht zu erzeugen, als chemische Mechanismen zu analysieren oder zu beweisen, welche Funktion das Licht erfüllt.[21] In einigen Fällen ist die Funktion unbekannt, wie bei Arten von drei Familien von Regenwürmern (Oligochaeta), wie Diplocardia longa, wo die Coelome-Flüssigkeit leuchtet, wenn das Tier sich bewegt.[22] Die folgenden Funktionen sind bei den genannten Organismen recht gut entwickelt.
Biolumineszenz wird auf verschiedene Weise und zu verschiedenen Zwecken verwendet. Der gestielte Tintenfisch Stauroteuthis syrtensis nutzt die Biolumineszenz, die von seinen saugnapfartigen Strukturen ausgeht.[23] Es wird angenommen, dass diese Strukturen von dem entstanden sind, was weithin als Saugnäpfe eines Tintenfischs bekannt ist. Sie haben nicht die gleiche Funktion wie normale Saugnäpfe, weil sie aufgrund der Evolution von Photophoren nicht mehr in der Lage sind, zu manipulieren oder zu greifen.
Die Schutzmechanismen biolumineszierender Organismen können verschiedene Formen annehmen; Abschreckung von Beute, Gegenlicht, Rauchschleier oder Ablenkung, abschreckende Körperteile, Sicherheitssignalisierung, Opfermarkierung oder Warnfarben.[24][25] Die Garnelenfamilie Oplophoridae Dana nutzt ihre Biolumineszenz als Mittel zur Abschreckung ihrer Verfolger.[26]
Literatur
- Osamu Shimomura: Bioluminescence. Chemical Principles and Methods. World Scientific Publishing Company, New Jersey 2006, ISBN 981-256-801-8.
- E. A. Widder: Bioluminescence in the ocean. Origins of biological, chemical, and ecological diversity. In: Science. Band 328, Nr. 5979, 7. Mai 2010, S. 704–708, doi:10.1126/science.1174269, PMID 20448176.
- Aldo Roda (Hrsg.): Chemiluminescence and Bioluminescence. Past, Present and Future. RSC Publishing, Cambridge 2011, ISBN 978-1-84755-812-1.
- Thérèse Wilson, J. Woodland Hastings: Bioluminescence. Living Lights, Lights for Living. Harvard University Press, Cambridge (Massachusetts) 2013, ISBN 978-0-674-06716-5.
Einzelnachweise
- ↑ a b Lichtspektakel unter Wasser – Biolumineszenz in Meerestieren von Gabriele Kerber am 3. Juni 2018 Spektrum der Wissenschaft, aufgerufen am 16. Februar 2022
- ↑ David F. Gruber & John S. Sparks. 2021. First report of biofluorescence in Arctic snailfishes and rare occurrence of multiple fluorescent colors in a single species. American Museum Novitates 3967; doi:10.5531/sd.sp.48
- ↑ Bill Rudman: Plocamopherus imperialis. In: seaslugforum.net. Australian Museum, Sydney, 21. Dezember 1998, abgerufen am 17. Juli 2016.
- ↑ Bill Rudman: Phylliroe bucephalum. In: seaslugforum.net. Australian Museum, Sydney, 9. August 2000, abgerufen am 17. Juli 2016.
- ↑ a b Osamu Shimomura: The role of superoxide dismutase in regulating the light emission of luminescent fungi. In: Journal of Experimental Botany. Band 43, Nr. 11, 1992, S. 1519–1525, doi:10.1093/jxb/43.11.1519.
- ↑ Anderson G. Oliveira, Dennis E. Desjardin, Brian A. Perry, Cassius V. Stevani: Evidence that a single bioluminescent system is shared by all known bioluminescent fungal lineages. In: Photochemical & Photobiological Sciences. Band 11, Nr. 5, 2012, S. 848–852, doi:10.1039/C2PP25032B.
- ↑ Jonathan M. Kendall, Michael N. Badminton: Aequorea victoria bioluminescence moves into an exciting new era. In: Trends in Biotechnology. Band 16, Nr. 5, Mai 1998, S. 216–224, doi:10.1016/S0167-7799(98)01184-6, PMID 9621461.
- ↑ Dennis E. Desjardin, Anderson G. Oliveira, Cassius V. Stevani: Fungi bioluminescence revisited. In: Photochemical & Photobiological Sciences. Band 7, Nr. 2, Januar 2008, S. 170–182, doi:10.1039/B713328F.
- ↑ Gerhard Eis: Bakterienlampen im Mittelalter. In: Sudhoffs Archiv. Band 40, 1956, S. 289–294.
- ↑ Gundolf Keil: Randnotizen zum „Stockholmer Arzneibuch“. In: Studia neophilologica. Band 44, Nr. 2, 1972, S. 238–262, hier: S. 249.
- ↑ Genetically modified Christmas tree would glow. In: BBC News. 25. Oktober 1999, abgerufen am 17. Juli 2016.
- ↑ Marcel Robischon: Green Glow and Fantasy. Stories of Genetically engineered Christmas Trees. In: Christmas Trees. Januar 2006, ISSN 0199-0217, OCLC 1711451, S. 23–26.
- ↑ Starlight Avatar. BioGlow, archiviert vom am 14. April 2016; abgerufen am 17. Juli 2016.
- ↑ Sustainable light achieved in living plants In: phys.org. Abgerufen am 18. Mai 2020 (englisch).
- ↑ Scientists use mushroom DNA to produce permanently-glowing plants In: New Atlas, 28. April 2020. Abgerufen am 18. Mai 2020 (englisch).
- ↑ Scientists create glowing plants using mushroom genes In: the Guardian, 27. April 2020. Abgerufen am 18. Mai 2020 (englisch).
- ↑ Amy Woodyatt: Scientists create glow-in-the-dark plants In: CNN. Abgerufen am 23. Mai 2020 (englisch).
- ↑ Tatiana Mitiouchkina, Alexander S. Mishin, Louisa Gonzalez Somermeyer, Nadezhda M. Markina, Tatiana V. Chepurnyh, Elena B. Guglya, Tatiana A. Karataeva, Kseniia A. Palkina, Ekaterina S. Shakhova, Liliia I. Fakhranurova, Sofia V. Chekova, Aleksandra S. Tsarkova, Yaroslav V. Golubev, Vadim V. Negrebetsky, Sergey A. Dolgushin, Pavel V. Shalaev, Dmitry Shlykov, Olesya A. Melnik, Victoria O. Shipunova, Sergey M. Deyev, Andrey I. Bubyrev, Alexander S. Pushin, Vladimir V. Choob, Sergey V. Dolgov, Fyodor A. Kondrashov, Ilia V. Yampolsky, Karen S. Sarkisyan: Plants with genetically encoded autoluminescence. In: Nature Biotechnology. 38. Jahrgang, Nr. 8, 27. April 2020, S. 944–946, doi:10.1038/s41587-020-0500-9, PMID 32341562 (englisch).
- ↑ Bioluminescence Facts and Light Production in Multiple Species. owlcation.com, abgerufen am 6. Februar 2025 (englisch).
- ↑ Bioluminescence. www.britannica.com, abgerufen am 6. Februar 2025 (englisch).
- ↑ Evolution of bioluminescence in Anthozoa with emphasis on Octocorallia. pmc.ncbi.nlm.nih.gov, abgerufen am 6. Februar 2025 (englisch).
- ↑ Light and vision in the deep-sea benthos: I. Bioluminescence at 500–1000 m depth in the Bahamian Islands. journals.biologists.com, abgerufen am 6. Februar 2025 (englisch).
- ↑ Evidence for light perception in a bioluminescent organ. www.pnas.org, abgerufen am 6. Februar 2025 (englisch).
- ↑ Bioluminescens. www.geeksforgeeks.org, abgerufen am 6. Februar 2025 (englisch).
- ↑ Bioluminescence as a defense mechanism: Study reveals dinoflagellate plankton glow to prevent predators from eating them. ecology.news, abgerufen am 6. Februar 2025 (englisch).
- ↑ Bioluminescence: The science of why living things glow. www.scientiaproject.com, abgerufen am 6. Februar 2025 (englisch).
Weblinks
- The Bioluminescence Webpage
- Homepage von D. Weiß, Universität Jena
- ARTE MEDIATHEK | ARTE | Faszinierende Leuchttiere. Abgerufen am 3. Juni 2017.
Auf dieser Seite verwendete Medien
This deep-sea fish, Photostomias guernei, has a built-in bioluminescent "flashlight" it uses to help it see in the dark.
Autor/Urheber: Mike, Lizenz: CC BY-SA 2.0
Bioluminescent dinoflagellates (Lingulodinium polyedra) lighting a breaking wave at midnight. The blue light is a result of a luciferase enzyme (like firefly luciferase, but the enzyme in L. polyedra shares no similarity with that of the firefly enzyme). Under the right conditions, the dinoflagellates become so numerous that the water takes on a muddy reddish color (hence the name "Red Tide"). The bioluminescence is only visible at night. The photo was taken 6/26/2005 with a Canon Rebel XT - 6s, f5.6, ISO 1600, 85mm (135mm equiv).
Autor/Urheber: Wofl~commonswiki, Lizenz: CC BY-SA 2.0 de
Lampyris noctiluca, female, own picture, June 2005, Germany
Autor/Urheber: Sparks, J. S.; Schelly, R. C.; Smith, W. L.; Davis, M. P.; Tchernov, D.; Pieribone, V. A.; Gruber, D. F., Lizenz: CC BY 4.0
Biofluorescence of Acanthurus coeruleus
Autor/Urheber: self, Lizenz: CC BY-SA 3.0
Mycena chlorophos at Hachijojima botanical park(ヤコウタケ・八丈島植物公園)
Autor/Urheber: art farmer from evansville indiana, usa, Lizenz: CC BY-SA 2.0
Firefly (photinus pyralis) glowing
Coelenterazin wird zu Coelenteramid durch Aequorin abgebaut
Autor/Urheber: Christian Gloor from Wakatobi Dive Resort, Indonesia, Lizenz: CC BY 2.0
Fluorescent moray eel
Autor/Urheber: Sparks, J. S.; Schelly, R. C.; Smith, W. L.; Davis, M. P.; Tchernov, D.; Pieribone, V. A.; Gruber, D. F., Lizenz: CC BY 4.0
Biofluorescence of Scolopsis bilineata
Autor/Urheber: Sparks, J. S.; Schelly, R. C.; Smith, W. L.; Davis, M. P.; Tchernov, D.; Pieribone, V. A.; Gruber, D. F., Lizenz: CC BY 4.0
Biofluorescence of Scorpaenopsis diabolus
Autor/Urheber: Sparks, J. S.; Schelly, R. C.; Smith, W. L.; Davis, M. P.; Tchernov, D.; Pieribone, V. A.; Gruber, D. F., Lizenz: CC BY 4.0
Biofluorescence of Kaupichthys brachychirus
Autor/Urheber: Sparks, J. S.; Schelly, R. C.; Smith, W. L.; Davis, M. P.; Tchernov, D.; Pieribone, V. A.; Gruber, D. F., Lizenz: CC BY 4.0
A, swell shark (Cephaloscyllium ventriosum); B, ray (Urobatis jamaicensis); C, sole (Soleichthys heterorhinos); D, flathead (Cociella hutchinsi); E, lizardfish (Synodus dermatogenys); F, frogfish (Antennarius maculatus); G, false stonefish (Scorpaenopsis diabolus); H, false moray eel (Kaupichthys brachychirus); I, false moray eel (Kaupichthys nuchalis); J, pipefish (Corythoichthys haematopterus); K, sand stargazer (Gillellus uranidea); L, goby (Eviota sp.); M, goby (Eviota atriventris); N, surgeonfish (Acanthurus coeruleus, larval); O, threadfin bream (Scolopsis bilineata). doi:10.1371/journal.pone.0083259.g001
Autor/Urheber: Sparks, J. S.; Schelly, R. C.; Smith, W. L.; Davis, M. P.; Tchernov, D.; Pieribone, V. A.; Gruber, D. F., Lizenz: CC BY 4.0
Biofluorescence of Soleichthys heterorhinos
Autor/Urheber: Sparks, J. S.; Schelly, R. C.; Smith, W. L.; Davis, M. P.; Tchernov, D.; Pieribone, V. A.; Gruber, D. F., Lizenz: CC BY 4.0
Biofluorescence of Urobatis jamaicensis
Autor/Urheber: Anna Pospisilova, Lizenz: CC BY 4.0
Syngnathus sp. - lateral view on the head showing bones on the skull. Their jaws are modified into a tube. Bones (red color) were stained with Alizarin Red and visualised under the fluorescence microscope.