Binodale
Als Binodale wird eine Phasengrenzlinie im Zustandsraum eines thermodynamischen Systems bezeichnet, die ein Koexistenzgebiet von einem Einphasengebiet abgrenzt und dabei einen als kritischer Punkt bezeichneten Extremwert aufweist. In der Regel sind alle in der Umgebung der Binodalen auftretenden Phasen fluid, also flüssig oder gasförmig. Die Zustände, welche die miteinander im thermodynamischen Gleichgewicht stehenden koexistierenden Phasen innerhalb des Koexistenzgebietes repräsentieren, sind auf der Binodalen beiderseits des kritischen Punktes lokalisiert und werden durch Konoden verbunden. Wird im Verlauf einer Zustandsänderung die Binodale überquert, findet ein Phasenübergang statt, der zur Bildung koexistierender Phasen aus einer homogenen Phase oder zur Bildung einer homogenen Phase aus koexistierenden Phasen führt.[1][2][3]
Thermodynamische Einordnung

Zustände, die koexistierende Phasen repräsentieren, müssen sich zumindest in einer Zustandsgröße unterscheiden, wobei es sich um extensive Zustandsgrößen, wie die Zusammensetzung von Gemischen und das absolute Volumen, oder um intensive Zustandsgrößen, wie das molare Volumen und die Dichte, handeln kann. Hingegen nimmt nach dem nullten Hauptsatz der Thermodynamik die Temperatur, bei der es sich ihrerseits um eine intensive Zustandsgrößen handelt, in allen miteinander im Gleichgewicht stehenden koexistierenden Phasen immer denselben Wert an. Auch der Druck als weitere intensive Zustandsgröße muss in allen im Gleichgewicht stehenden Phasen gleich groß sein (siehe Abschnitt Phasenregel für nicht chemisch reagierende Substanzen im Artikel Gibbssche Phasenregel).[4] Wird die freie Enthalpie eines thermodynamischen Systems, in dem koexistierende Phasen vorliegen, als Funktion einer Zustandsgröße, in der sich die koexistierenden Phasen unterscheiden, aufgetragen, weist die erhaltene Kurve zwei Minima auf. Diese Minima markieren die Zustände, in denen die miteinander im Gleichgewicht stehenden koexistierenden Phasen vorliegen. Das Mengenverhältnis, in dem die koexistierenden Phasen vorliegen, lässt sich mit Hilfe der Konodenregel ermitteln.[5] Wird die freie Enthalpie als Funktion der die Zustände der koexistierenden Phasen unterscheidenden Zustandsgröße für verschiedene Werte einer weiteren intensiven Zustandsgröße ermittelt, die in allen koexistierenden Phasen denselben Wert besitzt, bilden die Minima der so erhaltenen Profile der freien Enthalpie im Zustandsraum des betrachteten thermodynamischen Systems die Binodale.[6]
Kritische Punkte können sowohl in Form von Maxima als auch in Form von Minima vorliegen. Nähert man das betrachtete System durch Änderung einer der intensiven Zustandsgrößen, die in den koexistierenden Phasen denselben Wert besitzen, aus dem Koexistenzgebiet heraus einem kritischen Punkt an, rücken die Minima der freien Enthalpie als Funktion der die koexistierenden Phasen unterscheidenden Zustandsgröße zusammen. Folgedessen nähern sich die Eigenschaften der koexistierenden Phasen an. Am kritischen Punkt werden die Eigenschaften der koexistierenden Phasen innerhalb des Koexistenzgebiets sowie der außerhalb existierenden homogenen Phase ununterscheidbar.[7] Die Binodale umschließt weiterhin die innerhalb des Koexistenzgebietes verlaufende Spinodale, mit der sie lediglich die kritischen Punkte gemeinsam hat.[3] Innerhalb des Koexistenzgebietes ist eine homogene Phase im Bereich zwischen Binodaler und Spinodaler metastabil. Die Umwandlung der metastabilen homogenen Phase in die stabilen koexistierenden Phasen verläuft dort über einen Nukleationsmechanismus[8][9] und kann hinsichtlich ihres zeitlichen Verlaufs durch die Johnson-Mehl-Avrami-Kolmogorow-Gleichung beschrieben werden.
Fluide Reinstoffe
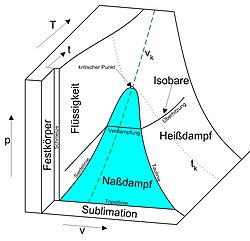
In den in Druck-Volumen-Temperatur-Phasendiagrammen dargestellten Zustandsflächen fluider Reinstoffe treten Koexistenzgebiete von flüssiger Phase und Gasphase auf, die von nach unten geöffneten Binodalen umschlossen werden.[2] Beim Übertritt von der flüssigen Phase in das Koexistenzgebiet verdampft die Flüssigkeit. Beim Übertritt aus der Gasphase in das Koexistenzgebiet kondensiert das Gas. Die so entstehenden koexistierenden flüssigen und gasförmigen Phasen werden durch Zustände auf der Binodalen beiderseits des kritischen Punktes repräsentiert, die durch denselben Druck und dieselbe Temperatur charakterisiert sowie durch Konoden parallel zur Volumen- oder Molvolumenachse verbunden sind. Der die flüssige Phase repräsentierende Zustandspunkt liegt auf dem Ast der Binodalen bei kleineren Volumina beziehungsweise Molvolumina, der die Gasphase repräsentierende Zustandspunkt auf dem Ast der Binodalen bei größeren Volumina beziehungsweise Molvolumina.
Wird der Zustandsraum eines fluiden Reinstoffes in die Druck-Volumen-Ebene projiziert, so dass ein Druck-Volumen-Phasendiagramm erhalten wird, weist die Binodale ein Maximum am kritischen Punkt auf. Im Falle von van der Waals-Fluiden läuft die Binodale mit zunehmendem Volumen asymptotisch gegen die Volumenachse. In den Zustandsflächen realer Reinstoffe wird das Koexistenzgebiet unten, also bei niedrigen Temperaturen, durch die Tripellinie begrenzt.
Wird der Zustandsraum eines fluiden Reinstoffes in die Druck-Temperatur-Ebene projiziert, so dass ein Druck-Temperatur-Phasendiagramm resultiert, erscheint die Binodale als Siedepunktskurve, die den Tripelpunkt mit dem kritischen Punkt verbindet. Der Grund hierfür ist, dass koexistierenden Phasen jeweils im thermischen Gleichgewicht stehen und daher dieselbe Temperatur und denselben Druck besitzen müssen. Die parallel zur Volumenachse verlaufenden Konoden stehen senkrecht auf der Druck-Temperatur-Ebene. Die Äste der Binodalen beiderseits des kritischen Punktes fallen folgedessen zusammen.[10]
Gemische

Mischungslücken

Gemische können eine Mischungslücke aufweisen, die von einer Binodalen umgrenzt ist. Außerhalb der Mischungslücke liegt das Gemisch im Gleichgewicht als homogene Mischphase vor. Innerhalb der Mischungslücke liegen im Gleichgewicht koexistierende Phasen vor, die sich in ihren stofflichen Zusammensetzungen unterscheiden und typischerweise alle Reinstoffe des Gemisches in jeweils unterschiedlichen Anteilen enthalten. Wird ein Gemisch durch eine Zustandsänderung von einem Zustand, in dem eine homogene Mischphase stabil ist, durch Überquerung der Binodalen in einen Zustand innerhalb einer Mischungslücke überführt, tritt Entmischung ein. Umgekehrt vereinigen sich koexistierende Phasen zu einer homogenen Mischphase, wenn das Gemisch aus einer Mischungslücke in einen Bereich des Zustandsraumes überführt wird, in dem es als homogene Mischphase stabil ist.
Kritische Punkte
Binodalen, die im Zustandsraum von Gemischen Mischungslücken umfassen, können sowohl Minima als auch Maxima aufweisen, die jeweils kritischen Punkten entsprechen. Die zu den kritischen Punkten gehörenden Temperaturen werden als kritische Lösungstemperaturen bezeichnet. Weist eine Binodale ein Minimum auf, wird die zum Minimum der Binodalen gehörende Temperatur als untere kritische Lösungstemperatur (englisch: lower critical solution temperature oder LCST) bezeichnet. Diese ist die niedrigste Temperatur, bei der das Gemisch in Form koexistierender Phasen vorliegen kann. In derartigen Fällen kann Entmischung induziert werden, wenn die Binodale im Verlauf einer Temperaturerhöhung überquert wird. Binodalen mit Minima treten insbesondere bei Mischungen von Polymeren auf.[11] Weist eine Binodale ein Maximum auf, ist die zum Maximum gehörende obere kritische Lösungstemperatur (englisch: upper critical solution temperature oder UCST) die höchste Temperatur, bei der koexistierende Phasen stabil sind. Entmischung kann dann eintreten, wenn die Binodale im Verlauf einer Temperaturerniedrigung überquert wird. Es existieren auch Beispiele geschlossener Mischungslücken, die von einer geschlossenen Binodalen umfasst werden und die sowohl einen unteren als auch einen oberen kritischen Punkt aufweisen.
Darstellung in Phasendiagrammen
Das Phasenverhalten binärer Gemische aus zwei Reinstoffen wird häufig in Temperatur-Zusammensetzungs-Phasendiagrammen dargestellt. Typischerweise sind sowohl Mischphasen als auch koexistierende Phasen, die auf oder in der Umgebung einer eine Mischungslücke umfassenden Binodalen auftreten, flüssig. Daher treten Mischungslücken umfassende Binodalen bei niedrigeren Temperaturen auf als die Siede- und Kondensationskurven, die Dampf-Flüssigkeit-Gleichgewichte von Mischungen beschreiben. Binodalen, die Mischungslücken ternärer Gemische umfassen, lassen sich für festgelegte Drücke und Temperaturen als Funktion der Mischungszusammensetzung in Dreiecksdiagrammen darstellen.[12][13] Die Schnittpunkte der Konoden mit den Binodalen definieren dabei jeweils die Zusammensetzungen der innerhalb einer Mischungslücke koexistierenden Phasen.[5][7]
Siehe auch
Literatur
- Pablo G. Debenedetti: Metastable liquids: concepts and principles. Princeton University Press, Princeton, N.J. 1996, ISBN 0-691-08595-1.
- Bruno Predel, Michael Hoch, Monte Pool: Phase Diagrams and Heterogeneous Equilibria: a Practical Introduction. Springer-Verlag, Berlin/Heidelberg 2004, ISBN 3-662-09276-X, doi:10.1007/978-3-662-09276-7.
- Peter Stephan, Karlheinz Schaber, Karl Stephan, Franz Mayinger: Thermodynamik – Grundlagen und technische Anwendungen. 2: Mehrstoffsysteme und chemische Reaktionen. Springer-Verlag, Berlin 2017, doi:10.1007/978-3-662-54439-6.
Einzelnachweise
- ↑ J. B. Clarke, J. W. Hastie, L. H. E. Kihlborg, R. Metselaar und M. M. Thackeray: Definitions of terms relating to phase transitions of the solid state (IUPAC Recommendations 1994). In: Pure and Applied Chemistry. Band 66, Nr. 3, 1994, S. 577–594, doi:10.1351/pac199466030577.
- ↑ a b Pablo G. Debenedetti: Metastable liquids: concepts and principles. Princeton University Press, Princeton, N.J. 1996, ISBN 0-691-08595-1, S. 69 ff.
- ↑ a b Pierre Papon, Jacques Leblond, Paul H. E. Meijer: The physics of phase transitions: concepts and applications. 2. Auflage. Springer-Verlag, Berlin 2006, ISBN 3-540-33390-8, S. 132 ff.
- ↑ Kenneth Denbigh: The Principles of Chemical Equilibrium: With Applications in Chemistry and Chemical Engineering. 4. Auflage, Cambridge University Press, Cambridge 1981, ISBN 0-521-28150-4, doi:10.1017/CBO9781139167604, S. 184.
- ↑ a b Bruno Predel, Michael Hoch, Monte Pool: Phase Diagrams and Heterogeneous Equilibria: a Practical Introduction. Springer-Verlag, Berlin/Heidelberg 2004, ISBN 3-662-09276-X, Kapitel „3.8 The Lever Rule“, doi:10.1007/978-3-662-09276-7.
- ↑ Günter Jakob Lauth, Jürgen Kowalczyk: Thermodynamik – Eine Einführung. Springer, Berlin/Heidelberg 2015, ISBN 978-3-662-46228-7, Kapitel „18 Nicht vollständig mischbare Mehrkomponentensysteme und deren Phasendiagramme“, doi:10.1007/978-3-662-46229-4.
- ↑ a b Gert R. Strobl: The physics of polymers: concepts for understanding their structures and behavior. 3. Auflage. Springer, Berlin/Heidelberg/New York 2007, ISBN 978-3-540-68411-4, S. 105 ff., doi:10.1007/978-3-540-68411-4.
- ↑ John W. Cahn, John E. Hilliard: Free Energy of a Nonuniform System. III. Nucleation in a Two‐Component Incompressible Fluid. In: The Journal of Chemical Physics. Band 31, Nr. 3, September 1959, ISSN 0021-9606, S. 688–699, doi:10.1063/1.1730447.
- ↑ K. Binder: Theory of first-order phase transitions. In: Reports on Progress in Physics. Vol. 50, Nr. 7, 1. Juli 1987, ISSN 0034-4885, S. 783–859, doi:10.1088/0034-4885/50/7/001 (englisch).
- ↑ Klaus Stierstadt: Thermodynamik – von der Mikrophysik zur Makrophysik. Springer-Verlag, Berlin/Heidelberg 2010, ISBN 978-3-642-05097-8, Kapitel 9, Abbildung 9.5, doi:10.1007/978-3-642-05098-5.
- ↑ Takeji Hashimoto: Structure of Polymer Blends. In: R. W. Cahn, P. Haasen, E. J. Kramer (Hrsg.): Materials Science and Technology: a Comprehensive Treatment. 12 Structure and Properties of Polymers. VCH, Weinheim 1993, ISBN 3-527-26813-8, S. 251–300.
- ↑ Bruno Predel, Michael Hoch, Monte Pool: Phase Diagrams and Heterogeneous Equilibria: a Practical Introduction. Springer-Verlag, Berlin/Heidelberg 2004, ISBN 3-662-09276-X, Kapitel „4 Phase Equilibria in Three-Component Systems and Four-Component Systems with Exclusion of the Gas Phase“, doi:10.1007/978-3-662-09276-7.
- ↑ Burkhard Lohrengel: Thermische Trennverfahren: Trennung von Gas-, Dampf- und Flüssigkeitsgemischen. 3. Auflage. Walter de Gruyter, Berlin/Boston 2017, ISBN 978-3-11-047322-3, Kapitel „4.4.2 Teilweise Löslichkeit von Trägerstoff und Extraktionsmittel“.
Auf dieser Seite verwendete Medien
Beispiel für ein Phasendiagramm ohne Dichteanomalie.
Autor/Urheber: Flitzer707, Lizenz: CC0
Idealisiertes Phasendiagramm einer binären Mischung der Komponenten A und B mit UCST Mischungslücke
Autor/Urheber: Wilfried Cordes, Lizenz: CC BY-SA 3.0 de
Schematische Darstellung eines Flüssig-Flüssig-Gleichgewichts mit Binodalen und Spinodalen
Autor/Urheber: Volker Sperlich, Lizenz: CC BY-SA 2.0 de
Qualitatives p-v-T-Diagramm für reine Stoffe



