Bifunktionelles Purinsyntheseprotein
| Bifunktionelles Purinsyntheseprotein | ||
|---|---|---|
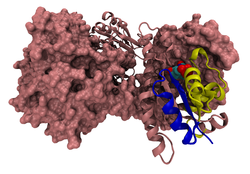 | ||
| Oberflächen-/Bändermodell des PURH-Dimers nach PDB 1PKX. Die AICAR-Formyltransferase-Domäne ist gelb und die IMP-Cyclohydrolase blau gerendert. | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 592 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homodimer | |
| Bezeichner | ||
| Gen-Name | ATIC | |
| Externe IDs |
| |
| Enzymklassifikationen | ||
| EC, Kategorie | 2.1.2.3, Transferase | |
| Reaktionsart | Übertragung eines Formylrests | |
| Substrat | 10-Formyl-THF + AICAR | |
| Produkte | THF + FAICAR | |
| EC, Kategorie | 3.5.4.10, Hydrolase | |
| Reaktionsart | Cyclisierende Dehydratisierung | |
| Substrat | FAICAR | |
| Produkte | IMP + H2O | |
| Vorkommen | ||
| Homologie-Familie | Hovergen | |
| Übergeordnetes Taxon | Lebewesen[1] | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 471 | 108147 |
| Ensembl | ENSG00000138363 | ENSMUSG00000026192 |
| UniProt | P31939 | Q9CWJ9 |
| Refseq (mRNA) | NM_004044 | NM_026195 |
| Refseq (Protein) | NP_004035 | NP_080471 |
| Genlocus | Chr 2: 215.31 – 215.35 Mb | Chr 1: 71.56 – 71.58 Mb |
| PubMed-Suche | 471 | 108147 |
Das bifunktionelle Purinsyntheseprotein (ATIC, PURH) ist das Enzym, das die letzten beiden Schritte in der de-novo-Biosynthese des Inosinmonophosphat (IMP), die Formylierung und anschließende Dehydratisierung von AICAR katalysiert. Die einzelnen Enzymfunktionen heißen AICAR-Formyltransferase und IMP-Cyclohydrolase. PURH kommt in allen Lebewesen vor, und die Bifunktionalität ist überall konserviert. Mutationen im ATIC-Gen des Menschen können PURH-Mangel und dieser AICA-Ribosurie, eine seltene Erbkrankheit verursachen.[2]
PURH-Aktivität wird durch Phosphorylierung erhöht; in mehreren Tumor-Zelllinien liegt PURH phosphoryliert vor.[3]
Katalysierte Reaktionen
AICAR wird zu FAICAR formyliert.
FAICAR cyclisiert unter Wasserabspaltung zu IMP.
Die AICAR-Formyltransferase-Domäne (Aminosäuren 199-592) und die IMP-Cyclohydrolase-Domäne (1-199) sind 50 Å voneinander entfernt und behalten ihre Aktivität bei getrennter Expression.[4][5]
Weblinks
- D’Eustachio / reactome: 5'-phosphoribosyl-5-aminoimidazole-4-carboxamide (AICAR) + 10-formyltetrahydrofolate ⇒ 5'-phosphoribosyl-5-formaminoimidazole-4-carboxamide (FAICAR) + tetrahydrofolate
- Jassal / reactome: 5'-phosphoribosyl-5-formaminoimidazole-4-carboxamide (FAICAR) ⇔ inosine 5'-monophosphate + H2O
Einzelnachweise
- ↑ Orthologe bei OMA
- ↑ UniProt P31939
- ↑ Boccalatte FE, Voena C, Riganti C, et al.: The enzymatic activity of 5-aminoimidazole-4-carboxamide ribonucleotide formyltransferase/IMP cyclohydrolase is enhanced by NPM-ALK: new insights in ALK-mediated pathogenesis and the treatment of ALCL. In: Blood. 113. Jahrgang, Nr. 12, März 2009, S. 2776–90, doi:10.1182/blood-2008-06-161018, PMID 18845790, PMC 2661863 (freier Volltext).
- ↑ Cheong CG, Wolan DW, Greasley SE, Horton PA, Beardsley GP, Wilson IA: Crystal structures of human bifunctional enzyme aminoimidazole-4-carboxamide ribonucleotide transformylase/IMP cyclohydrolase in complex with potent sulfonyl-containing antifolates. In: J. Biol. Chem. 279. Jahrgang, Nr. 17, April 2004, S. 18034–45, doi:10.1074/jbc.M313691200, PMID 14966129 (jbc.org).
- ↑ Rayl EA, Moroson BA, Beardsley GP: The human purH gene product, 5-aminoimidazole-4-carboxamide ribonucleotide formyltransferase/IMP cyclohydrolase. Cloning, sequencing, expression, purification, kinetic analysis, and domain mapping. In: J. Biol. Chem. 271. Jahrgang, Nr. 4, Januar 1996, S. 2225–33, doi:10.1074/jbc.271.4.2225, PMID 8567683 (jbc.org).
Auf dieser Seite verwendete Medien
Struktur von Inosinmonophosphat (IMP)
Struktur von 5-Aminoimidazol-4-carboxamidribonucleotid (AICAR)
Struktur von 5-Formamidoimidazol-4-carboxamidribonucleotid (FAICAR)






