Biaryle
| Biaryle |
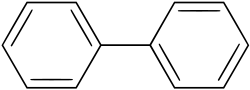 Biphenyl (nicht: Diphenyl)[1] |
 |
 |
 |
 |
Als Biaryle (nicht: Diaryle) bezeichnet man Verbindungen, bei denen zwei Arylgruppen über eine Einfachbindung miteinander verknüpft sind. Das einfachste Biaryl ist Biphenyl. Verbindungen, in denen drei Arylgruppen über Einfachbindungen miteinander verknüpft sind, nennt man Teraryle und solche mit vier Quateraryle.
Synthese
Die Synthese kann durch verschiedene Methoden erfolgen:
- Ullmann-Reaktion ausgehend von Arylhalogeniden und Kupferpulver. Es werden so vor allem symmetrische Biaryle hergestellt.
- Kreuzkupplungen (Hiyama-Kupplung, Kumada-Kupplung, Negishi-Kupplung, Stille-Kupplung, Suzuki-Kupplung) erlauben die gezielte Synthese unsymmetrischer Biaryle.
Verwendung
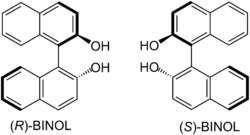
Die Herstellung von Biarylen mittels Kreuzkupplung ist ein wichtiges Werkzeug in der präparativen organischen Chemie und hat hier ganz besondere Bedeutung in der Synthese von Wirkstoff-Bibliotheken, um Struktur-Wirkungs-Beziehungen (SAR) zu untersuchen. Reine Enantiomere von BINOL und BINAP[2] – sowie entsprechende Derivate – haben Bedeutung als enantioselektive Katalysatoren in der gezielten Herstellung von enantiomerenreinen Naturstoffen und Arzneistoffen erlangt. BINOL dient beispielsweise als Ligand eines Lanthanoids in der Shibasaki-Aldolreaktion, um unmodifizierte Aldehyde enantioselektiv an Ketone zu addieren.[3] Vom BINOL abgeleitete Heterobimetallkatalysatoren werden auch in der enantioselektiven Addition von Phosphornukleophilen an Imine eingesetzt.[4][5]
Einzelnachweise
- ↑ Otto-Albrecht Neumüller (Hrsg.): Römpps Chemie-Lexikon. Band 1: A–Cl. 8. neubearbeitete und erweiterte Auflage. Franckh’sche Verlagshandlung, Stuttgart 1979, ISBN 3-440-04511-0, S. 426.
- ↑ Russell E. Malz: Catalysis of organic reactions. Marcel Dekker, New York 1996, ISBN 0-8247-9807-4, S. 147 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ J. Bülle, A. Hittermann: Das Basiswissen der Organischen Chemie. Thieme, Stuttgart 2000, S. 308 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ H. Gröger, Y. Saida, H. Sasai, K. Yamaguchi, J. Martens, M. Shibasaki: A New and Highly Efficient Asymmetric Route to Cyclic alpha-Amino Phosphonates: The first Catalytic Enantioselective Hydrophosphonylation of Cyclic Imines Catalyzed by Chiral Heterobimetallic Lanthanoid Complexes. In: J. Am. Chem. Soc. 120, 1998, S. 3089–3103, doi:10.1021/ja973872i.
- ↑ I. Schlemminger, Y. Saida, H. Gröger, W. Maison, N. Durot, H. Sasai, M. Shibasaki, J. Martens: Concept of Rigidity: How to Make Enantioselective Hydrophosphonylation of Cyclic Imines Catalyzed by Chiral Heterobimetallic Lanthanoid Complexes almost Perfect. In: J. Org. Chem. 65, 2000, S. 4818–4825, doi:10.1021/jo991882r.
Auf dieser Seite verwendete Medien
chemical structure of biphenyl
Diphensäure
(c) Neon2001 in der Wikipedia auf Deutsch, CC BY-SA 3.0
Strukturformeln von (R)- und (S)-BINOL.
2D structure of 2-phenylphenol
BINAP_Enantiomers
Struktur von Biphenyl-4,4'-dicarboxylsäure