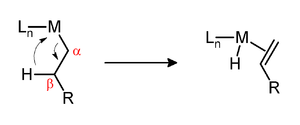
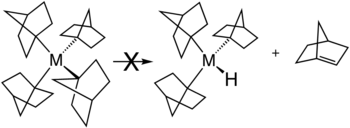β-Hydrideliminierung
Eine β-Hydrideliminierung ist eine Reaktion, in der eine an ein Metallzentrum gebundene Alkylgruppe unter Abspaltung eines Metallhydrids zum Alken reagiert.[1] Voraussetzung für eine β-Hydrideliminierung ist die Existenz eines Wasserstoffatoms in β-Stellung. Aus diesem Grund können beispielsweise Komplexe mit n- und tert in dieser Form reagieren, nicht jedoch solche mit Methyl- und neo. Weiterhin muss das Metallzentrum eine freie Bindungsstelle in cis-Stellung zur Alkylgruppe aufweisen.
β-Hydrideliminierung kann einerseits ein wichtiger Reaktionsschritt in einer Synthese sein, ist andererseits aber oft eine unerwünschte Nebenreaktion. Beispielsweise beruht der SHOP-Prozess auf β-Hydrideliminierung, um α-Alkene herzustellen, die dann genutzt werden, um Detergentien herzustellen. Die Darstellung verzweigter Polymere aus Ethen beruht auf dem Chain-walking-Mechanismus, in dem β-Hydrideliminierung einen entscheiden Schritt darstellt.
Beispiel einer unerwünschten β-Hydrideliminierung ist die β-Hydrideliminierung im Ziegler-Natta-Verfahren, die dazu führt, dass die hergestellten Polymere eine verringerte Kettenlänge aufweisen. Auch im Falle Nickel- und Palladium-katalysierter Kupplungsreaktionen von Arylhalogeniden mit Grignard-Reagenzien kann β-Hydrideliminierung die Ausbeute verringern.
In einigen Fällen ist β-Hydrideliminierung der erste einer Reihe von Schritten. Dies ist beispielsweise in der Synthese von RuHCl(CO)(PPh3)3 aus Ruthenium(III)-chlorid, Triphenylphosphan und 2-Methoxyethanol der Fall. Dort reagiert das intermediär gebildete Alkoholat unter β-Hydrideliminierung und bildet dabei den Hydridliganden und den π-gebundenen Aldehyd, der dann später in den Carbonylliganden umgewandelt wird.
β-Hydrideliminierung vermeiden
Es existieren verschiedene Strategien, um β-Hydrideliminierung zu vermeiden. Die am weitesten verbreitete besteht darin, Alkylliganden wie Methyl- und neo einzusetzen, die kein β-Wasserstoffatom aufweisen. β-Hydrideliminierung ist auch gehemmt, wenn dabei ein sterisch gespanntes Alken entstehen würde. Dies wird beispielsweise durch die Stabilität von Metallkomplexen mit Norbornylliganden illustriert.[2]
Sperrige Alkylliganden, wie tert oder Trimethylsilylliganden, können das β-H-Atom daran hindern, eine koplanare Konfiguration mit dem Metall und den α- und β-Atomen zu erreichen, die für den konzertierten Mechanismus der β-H-Eliminierung erforderlich ist. Weist das Metallzentrum keine freie Koordinationsstelle auf, beispielsweise weil der Komplex bereits die 18-Elektronenregel erfüllt, ist β-Hydrideliminierung ebenfalls nicht möglich.
In einigen Fällen können andere Liganden Geometrien erzwingen, die eine β-H-Eliminierung verhindern. Diese Fähigkeit haben etwa Diphosphanliganden, in denen die beiden Phosphor-Atome räumlich in trans-Stellung fixiert sind. Dies kann beispielsweise dadurch erreicht werden, dass die Phosphor-Atome in eine Ferroceneinheit eingebettet werden, welche den Abstand der koordinierenden Atome im Komplex starr vorgibt. Beispiele sind die Nickel- und Palladiumkomplexe von 1,1′-Diphosphinoferrocenen, die strukturell so aufgebaut sind, dass das Metall-Atom von zwei in trans-Stellung stehenden Phosphor-Atomen koordiniert wird. Da beide Metalle quadratisch planare Komplexe bilden, kann keine freie Bindungsstelle in cis-Stellung zum Alkylliganden ausgebildet werden, wodurch β-H-Eliminierung verhindert wird.
Einzelnachweise
- ↑ Christoph Elschenbroich: Organometallchemie, 5., überarbeitete Auflage 2005, Wiley-VCH Weinheim, Seite 26. ISBN 3-519-53501-7.
- ↑ Barton K. Bower, Howard G. Tennent "Transition metal bicyclo[2.2.1]hept-1-yls" Journal of American Chemical Society 1972, Volume 94, S. 2512–2514, doi:10.1021/ja00762a056
Auf dieser Seite verwendete Medien
betahydride elim NOT