Beryllocen
| Strukturformel | |||||||||
|---|---|---|---|---|---|---|---|---|---|
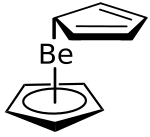 | |||||||||
| Kristallsystem | monoklin[1] | ||||||||
| Allgemeines | |||||||||
| Name | Beryllocen | ||||||||
| Andere Namen |
| ||||||||
| Summenformel | BeC10H10 | ||||||||
| Kurzbeschreibung | farblose Kristalle[2] | ||||||||
| Externe Identifikatoren/Datenbanken | |||||||||
| |||||||||
| Eigenschaften | |||||||||
| Molare Masse | 139,2 g·mol−1 | ||||||||
| Aggregatzustand | fest | ||||||||
| Schmelzpunkt | |||||||||
| Siedepunkt | 233 °C[2] | ||||||||
| Löslichkeit | löslich in Benzol, Diethylether und Petrolether[2] | ||||||||
| Sicherheitshinweise | |||||||||
| |||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||
Beryllocen oder nach IUPAC-Nomenklatur Bis(η1,η5-cyclopentadienyl)beryllium(II), ist eine metallorganische Verbindung aus der Familie der Metallocene. Die farblose Substanz lässt sich bei −60 °C aus Petrolether in Form weißer Nadeln kristallisieren und zersetzt sich rasch bei Kontakt mit Luftsauerstoff und Wasser.[2]
Gewinnung und Darstellung
Beryllocen wurde erstmals 1959 durch Ernst Otto Fischer und Hermann Pankraz Hofmann aus Berylliumchlorid und Cyclopentadienylnatrium in Benzol oder Diethylether synthetisiert.[2]
Eigenschaften
Physikalische Eigenschaften
Im Gegensatz zu den ungeladenen Metallocenen der Übergangsmetalle V, Cr, Fe, Co, Ni, Ru und Os, die eine streng symmetrische und daher dipollose Struktur aufweisen, besitzt Beryllocen ein deutliches Dipolmoment von 2,46 Debye (in Benzol), bzw. 2,24 Debye (in Cyclohexan), was auf eine Unsymmetrie des Moleküls hinweist. Im IR-Spektrum findet man Signale bei 1524, 1610, 1669, 1715 und 1733 cm−1, die ebenfalls belegen, dass die Struktur nicht der des Ferrocens entsprechen kann.[2] Das 1H-NMR-Spektrum zeigt dagegen bis hinunter zu einer Temperatur von −135 °C nur ein Signal, was entweder auf eine symmetrische Struktur oder auf eine schnelle Fluktuation der Ringe hinweist.[5]
Beryllocen zeigt je nach Aggregatzustand unterschiedliche Molekülgeometrien. In der Tieftemperatur-Röntgenstrukturanalyse zeigt sich eine slipped-Sandwich-Struktur, d. h. die Ringe sind gegeneinander versetzt – ein Ring ist η5 koordiniert mit einem Be-Cp-Abstand von 152 pm, der zweite nur η1 koordiniert (Be-Cp-Abstand: 181 pm).[6][1][7] Der Grund für die η5,η1-Struktur ist, dass die Orbitale des Beryllocens nur mit maximal 8 Valenzelektronen besetzt werden können. In der Gasphase scheinen beide Ringe η5 koordiniert zu sein. Tatsächlich ist ein Ring deutlich weiter vom Zentralatom entfernt als der andere (190 und 147 pm) und die scheinbare η5-Koordination ist auf eine schnelle Fluktuation der Bindung zurückzuführen.[8] Aufgrund von Gasphasen-Elektronenbeugungsuntersuchungen bei 120 °C wurde 1979 von Arne Haarland gefolgert, dass die beiden Ringe nur etwa 80 pm gegeneinander verschoben sind und nicht η5,η1, sondern eher η5,η3 koordiniert sind.[5]
Ernesto Carmon u. a. untersuchten mittels Röntgenstrukturanalyse die Struktur von Beryllocenen mit sterisch anspruchsvolleren Liganden: Be(C5Me4H)2 und Be(C5Me5)2. Dabei fanden sie, dass im Festkörper das Be(C5Me4H)2 eine slipped-Sandwich-Struktur mit η5,η1-Koordinierung hat, während das Be(C5Me5)2 die klassische η5,η5-Koordinierung zeigt. Im Kristall sind die Be-C-Abstände allerdings nicht gleich lang, sondern variieren zwischen 196,9(1) und 211,4(1) pm.[9]
Chemische Eigenschaften
In Tetrahydrofuran (THF) zersetzt sich Beryllocen relativ rasch unter Bildung eines gelblichen Gels. Beryllocenkristalle bilden mit Luftsauerstoff an der Oberfläche rasch eine Oxidschicht, während sie sich mit Wasser heftig zu Berylliumhydroxid und Cyclopentadien umsetzen.[2]
Wie Magnesocen bildet auch Beryllocen mit Eisen(II)-chlorid Ferrocen.[2] Die Triebkraft ist dabei die Bildung des sehr stabilen Ferrocenmoleküls.
Sicherheitshinweise
Beryllium und Berylliumverbindungen sind giftig und karzinogen.
Einzelnachweise
- ↑ a b C.-H. Wong, T.-Y. Lee, K.-J. Chao and S. Lee: Crystal structure of bis(cyclopentadienyl)beryllium at −120°C. In: Acta Crystallographica. B28, 1972, S. 1662–1665, doi:10.1107/S0567740872004820.
- ↑ a b c d e f g h i Ernst Otto Fischer, Hermann P. Hofmann: Über Aromatenkomplexe von Metallen, XXV. Di-cyclopentadienyl-beryllium. In: Chem. Ber. Band 92, Nr. 2, 1959, S. 482–486, doi:10.1002/cber.19590920233.
- ↑ Eintrag zu Berylliumverbindungen in der GESTIS-Stoffdatenbank des IFA, abgerufen am 23. August 2021. (JavaScript erforderlich)
- ↑ Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag Berylliumverbindungen, ausgenommen Beryllium-Tonerdesilikate, und ausgenommen die namentlich in diesem Anhang bezeichneten im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 23. August 2021. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ a b Arne Almenningen, Arne Haaland, Janusz Lusztyk: The molecular structure of beryllocene (C5H5)2Be. A reinvestigation by gas phase electron diffraction. In: J. Organomet. Chem. Band 170, Nr. 3, 1979, S. 271–284, doi:10.1016/S0022-328X(00)92065-5.
- ↑ Christoph Elschenbroich: Organometallchemie. B. G. Teubner Verlag, 2008, ISBN 978-3-8351-0167-8 (Seite 60 in der Google-Buchsuche).
- ↑ James E. Huheey, E. Keiter, R. Keiter: Anorganische Chemie. De Gruyter Verlag, 1993, ISBN 3-11-017903-2 (Seite 799 in der Google-Buchsuche).
- ↑ Erwin Riedel: Moderne Anorganische Chemie. De Gruyter, 2007, ISBN 978-3-11-019060-1 (Seite 623 in der Google-Buchsuche).
- ↑ María del Mar Conejo, Rafael Fernández, Enrique Gutiérrez-Puebla, Ángeles Monge, Caridad Ruiz, Ernesto Carmona: Synthesis and X-ray Structures of [Be(C5Me4H)2] and [Be(C5Me5)2]. In: Angewandte Chemie. Band 112, Nr. 11, 2000, S. 2025–2027, doi:10.1002/1521-3757(20000602)112:11<2025::AID-ANGE2025>3.0.CO;2-A.
Auf dieser Seite verwendete Medien
Global harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS): Piktogramm für giftige / toxische Chemikalien
Globales Harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS) Piktogramm für gesundheitsgefährdende Stoffe.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances






